一种简便的拓宽噬菌体宿主谱方法的建立 及其结果分析
周 艳,薛金鑫,叶 敏,张 辉,包红朵,王 冉
(1.江苏省农业科学院农产品质量安全与营养研究所 江苏省食品质量安全重点实验室 省部共建国家重点实验室培育基地,南京210014;2.南京大学金陵学院化学与生命科学学院,南京210014)
在畜禽养殖业中,多年来抗生素的滥用不仅导致环境与动物机体中抗生素的大量残留,而且多重耐药菌和超级细菌的出现也给人类健康和畜禽养殖业带来了危害[1-5]。针对耐药性致病菌,尤其是革兰氏阴性菌,目前尚缺乏新型抗菌药物,而裂解性噬菌体(Bacteriophage,phage)作为一类可侵染并裂解耐药菌的细菌病毒,已成为各国研发新型抗菌制剂的热点之一。因此,噬菌体疗法(Phage Therapy)有望成为改善和解决耐药性致病菌感染的有效策略[6-9]。
产肠毒素大肠杆菌(EnterotoxigenicEscherichia coli,ETEC)是一类致人和幼畜胃肠道感染以及腹泻的病原性致病菌;肠出血性大肠杆菌(EnterohemorrhagicE. coli,EHEC)O157∶H7是世界公认的食源性病原菌和人兽共患病病原[10-14]。针对这两种致病菌,相继有研究表明从环境中分离到了裂解性ETEC噬菌体和EHEC O157∶H7噬菌体,并且目前已有商品化的EHEC O157∶H7裂解性噬菌体产品[12]。然而,自然界分离的噬菌体对宿主菌具有高度专一性[15],噬菌体宿主谱较窄,然而在畜禽养殖环境中,动物疾病往往由多种致病菌导致,病原菌较为复杂,宿主单一的噬菌体很难对疾病进行有效控制[16-18],作为抗菌制剂在应用时会受到制约。如何在已有噬菌体的基础上,简便快速地拓宽噬菌体宿主谱,目前相关的研究报道较少。
为解决噬菌体宿主谱窄的问题,本研究[19]将前期分离到的一株ETEC噬菌体vB_EcoM_JS09(简称JS09)与一株非宿主菌EHEC O157∶H7 47共培养,通过优化培养体系和条件,经过多轮共培养筛选到了能同时裂解ETEC和EHEC O157∶H7菌株的噬菌体,拓宽了亲本噬菌体JS09的宿主谱,建立了一种拓宽噬菌体宿主谱的方法,并进一步研究了裂解性较好的宽宿主谱噬菌体Bp47-12的生物学特性和裂解特性。
1 材料与方法
1.1 菌株、噬菌体与试剂噬菌体vB_EcoM_JS09(简称JS09,GenBank登录号:KF582788)由本实验室分离并保存;ETEC EK99-F41菌株由本实验室保存;EHEC O157∶H7 47菌株来源于牛,EHEC O157∶H7 86-24菌株来源于人,EHEC O157∶H7 363菌株来源未知,以上菌株均由江苏省农业科学院兽医所赠与;EHEC O157∶H7 012和027菌株来源于猪,由中国农业科学院上海兽医所王少辉赠与;LB培养基购自海博(青岛)生物技术有限公司。
1.2 噬菌体的培养挑取ETEC EK99-F41的单个菌落接种于4 mL液体LB中,于37℃、150 r/min振荡培养过夜,得到宿主菌浓度约为1×109CFU/mL。取EK99-F41菌液(1×109CFU/mL)150 μL加入噬菌体JS09纯培养液(1×1010PFU/mL)200 μL中,室温静置吸附15 min,加入10 mL液体LB培养基,37℃、160 r/min摇床中培养6 h,于4℃条件下11 269 ×g离心10 min,收集上清,0.22 μm滤膜过滤,并保存于4℃。
1.3 噬菌体宿主谱的拓宽方法按照MOI为100的比例,取1 mL噬菌体JS09(1×1010PFU/mL)与 100 μL EHEC O157∶H7 47(1×109CFU/mL)充分混合,室温静置吸附15 min后,进行双层琼脂平板试验,加入3.5 mL 55℃左右的0.6%琼脂LB培养基,迅速混匀倒入1.2%琼脂LB平板上,凝固后37℃培养12 h,共3个双层琼脂平板。
1.4 宽宿主谱噬菌体的分离与纯化标记双层琼脂平板上的典型噬菌斑,分别编号,用枪头分别移取噬菌斑于500 μL LB培养液中,37℃、160 r/min振荡培养8 h。选取液体澄清的编号样品,进行下一步扩大培养。
取上述样品,全部与100 μL EHEC O157∶H7 47(1×109CFU/mL)混合,室温静置吸附15 min后,接入5 mL LB培养液中。37℃静置培养6 h,选取液体澄清的样品,7826×g离心10 min,取上清液,0.22 μm滤膜过滤,保存于4℃。分别测定单一噬菌斑,重复该纯化操作3~5次即得纯化噬菌体。
1.5 噬菌体宿主谱的点样试验通过点样试验分析纯化的噬菌体宿主谱[19],当噬菌体能够裂解细菌时会出现抑菌圈,统计噬菌体对各细菌的裂解情况得到该噬菌体的宿主谱(表1)。
1.6 宽宿主谱噬菌体噬菌斑形态分析参照1.3中的双层琼脂平板试验方法,将筛选到的裂解效果较好的宽宿主谱噬菌体Bp47-12,以EHEC O157∶H7 363为宿主菌进行双层琼脂平板试验。
1.7 宽宿主谱噬菌体最佳感染复数(multiplicity of infection,MOI)的测定 取对数期宿主菌EHEC O157∶H7 363,按不同感染复数1∶1000、1∶100、1∶10、1∶1、10∶1、100∶1加入噬菌体Bp47-12和宿主菌EHEC O157∶H7 363,37℃、 150 r/min振荡培养5 h,4℃、10 000×g离心10 min,得上清液测定各组噬菌体效价。试验重复3次,设置不加噬菌体的宿主菌培养液为试验对照。
1.8 宽宿主谱噬菌体一步生长曲线绘制参考Leuschner等[20]的方法,取对数期宿主菌EHEC O157∶H7 363,以MOI≥10加入噬菌体Bp47-12,37℃水浴15 min,10 000×g离心1 min,去上清,LB液洗涤2次,细菌沉淀加入37℃预热的LB液中混匀,迅速于37℃、180 r/min振荡培养,同时开始计时。每10 min取样测噬菌体效价,设立不加噬菌体的宿主菌培养液和不加宿主菌的噬菌体作为试验对照。以感染时间为横坐标,噬菌体效价对数值为纵坐标,绘制一步生长曲线,试验重复3次,每次设2个平行。
1.9 宽宿主谱噬菌体吸附曲线分析培养过夜细菌EHEC O157∶H7 363(接种一个单菌落到5 mL LB中,37℃振荡过夜培养),取0.5 mL该菌液加入到10 mL LB中,此时细菌浓度约为2×108CFU/mL,再置于37℃振荡培养60 min。用LB稀释噬菌体Bp47-12,制备10 mL效价为2×105PFU/mL的噬菌体Bp47-12(稀释好后测定噬菌体效价);将步骤培养的细菌与制备好的噬菌体充分混合,摇匀后立即取1 mL样品,于4℃、15 000×g离心1 min,取上清测定噬菌体效价;按照以上取样方法,每隔5 min取样测定噬菌体效价至30 min,重复3次取平均值,绘制吸附曲线。
1.10 宽宿主谱噬菌体酸碱稳定性和热稳定性测定配 制pH值分别为2、3、4、5、6、8、9、10、11、12、13的蛋白胨水,取不同pH值的蛋白胨水与噬菌体Bp47-12等量混合,37℃水浴2 h后测定效价;取100 μL噬菌体于离心管中,测定初始效价,将离心管分别置于30℃、40℃、50℃、60℃、70℃、80℃的水浴环境中作用30 min和60 min,测定噬菌体效价变化。两个试验均重复3次,每次设2个平行,取平均值。
1.11 宽宿主谱噬菌体体外裂解特性分析分别取过夜培养的EHEC O157∶H7 363,EHEC O157∶H7 47和ETEC EK99-F41菌液,用LB将其OD600值调整为0.86(约为2.5×106CFU/mL)左右,以MOI为10的比例加入噬菌体Bp47-12并至终浓度为1×107PFU/mL,于37℃静置培养,同时以不加噬菌体作为对照组。在培养的0~5 h,每1 h检测一次OD600值的变化。
2 结果
2.1 宽宿主谱噬菌体的分离纯化及其宿主谱分析噬菌体JS09与EHEC O157∶H7 47共培养后,以EHEC O157∶H7 47为宿主菌,在3个双层琼脂平板上共生长了12个较小的噬菌斑。对12个噬菌斑分别进行3次重复分离纯化后,最终筛选到能够使EHEC O157∶H7 47菌液由浑浊变澄清的宽宿主谱噬菌体,分别命名为Bp47-1、Bp47-2、Bp47-3、Bp47-8、Bp47-9和Bp47-12。
通过点样试验观察LB培养平板上是否出现抑菌圈,结果可知,对照组噬菌体JS09仅能够裂解ETEC EK99-F41,而噬菌体Bp47-1、Bp47-2、Bp47-3、Bp47-8、Bp47-9和Bp47-12不仅能裂解ETEC EK99-F41,而且能裂解EHEC O157∶H7 47、363、86~24(图1),以及从临床分离的猪源EHEC O157:H7菌株012和027(重复3代噬菌体以上)(表1)。

图1 噬菌体JS09、Bp47-1、Bp47-2、Bp47-3、Bp47-8、Bp47-9 和Bp47-12 原液单层平板点样试验Fig.1 Spot tests of phages JS09, Bp47-1, Bp47-2, Bp47-3, Bp47-8, Bp47-9 and Bp47-12 in the liquid samples

表1 噬菌体的宿主谱Table 1 Host range of phages
2.2 宽宿主谱噬菌体的噬菌斑形态选取裂解效果较好的宽宿主谱噬菌体Bp47-12,以EHEC O157∶H7 363为宿主菌,双层琼脂平板试验表明,噬菌体Bp47-12在平板上均呈现出了典型裂解性噬菌体特征,空斑透亮,边缘整齐清晰,无晕环噬菌斑(图2)。
2.3 宽宿主谱噬菌体的最佳感染复数噬菌体Bp47-12在MOI为1∶1时,宿主菌EHEC O157∶H7 363释放的子代噬菌体效价为5.5×108PFU/mL,在各试验组中最高,为噬菌体扩增时的最佳MOI值(表2)。
2.4 宽宿主谱噬菌体的一步生长曲线噬菌体Bp47-12感染宿主菌EHEC O157∶H7 363的潜伏期约 30 min,爆发持续时间约70 min,根据爆发末期的噬菌体效价和感染初期的宿主菌浓度算得平均爆发量为15(平均爆发量=爆发末期的噬菌体效价/感染初期的宿主菌浓度)(图3)。
2.5 宽宿主谱噬菌体的吸附曲线吸附曲线表明,在37℃时噬菌体Bp47-12在25 min内能够完全吸附到宿主菌EHEC O157∶H7 363表面(图4)。
2.6 宽宿主谱噬菌体的热稳定性和酸碱稳定性测定噬菌体Bp47-12在各温度下作用30、60 min后效价变化无太大差别,30℃、40℃、50℃、60℃下几乎维持在初始时的效价,但70℃时下降较快,80℃之后已基本无噬菌体存在(图5A)。
噬菌体Bp47-12在pH3~9范围内效价较稳定,pH值小于3以及大于9噬菌体效价都会明显降低,pH≤2或≥10时基本检测不到噬菌斑,表明此时大部分噬菌体已经失活(图5B)。
2.7 宽宿主谱噬菌体的体外裂解特性加入噬菌体Bp47-12至菌液作用1 h后,Bp47-12组OD600值由0.86降至0.66左右;2 h后,该组OD600值仍在下降,肉眼可观察到菌液明显较对照组澄清;作用5 h后,Bp47-12组的OD600值降至0.20左右,下降了约0.66个OD600值,此时菌液变得较为透亮且澄清,而对照组OD600值仍在上升,达到1.4以上,上升了约0.55个OD600值,且菌液较为混浊(图6A、6B)。
当宿主菌为ETEC EK99-F41时,加入噬菌体Bp47-12至菌液作用2 h后,Bp47-12组OD600值开始下降,在5 h时OD600值降至0.20左右(图6C),因此,当MOI为10时,噬菌体Bp47-12能够有效裂解EHEC O157∶H7 363,EHEC O157:H7 47和ETEC EK99-F41。

图2 宽宿主谱噬菌体Bp47-12 双层琼脂平板试验 Fig.2 Bp47-12 with expanded host range in double layer agar plate
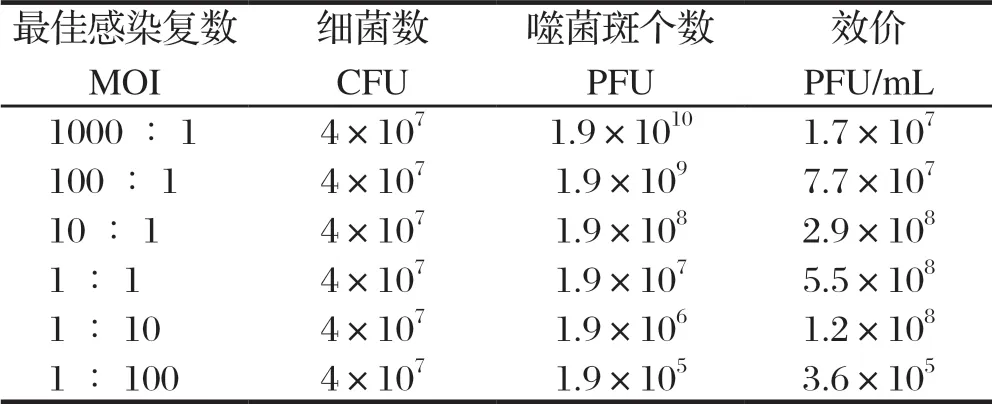
表2 噬菌体Bp47-12 的最佳感染复数测定Table 2 Determination of optimal MOI of Bp47-12

图3 噬菌体Bp47-12 一步生长曲线 Fig.3 One-step growth curve of Bp47-12

图4 噬菌体Bp47-12 吸附曲线Fig.4 Adsorption curve of Bp47-12
3 讨论
噬菌体是地球上最丰富和具有多样性的生物体,大约有1032个有尾噬菌体[21-22]。随着抗生素在畜牧养殖业和医学上的使用,抗生素耐药性已经成为一个危害全世界公共健康的问题,大肠杆菌中耐多粘菌素MCR-1(plasmid-mediated colistin resistance)耐药基因的发现,标志着细菌对抗生素的耐药性已突破最后一道防线[23]。近年来,将噬菌体应用于畜牧兽医和医学领域,已受到全球科研机构和企业的重视。裂解性噬菌体虽能够特异性侵染并裂解细菌,但从自然界中分离的裂解性噬菌体宿主谱较窄[24],尽管有研究者通过分离宽宿主谱噬菌体、改造噬菌体基因组以及混合多种噬菌体等方法来改变或扩大噬菌体的宿主谱和裂解特性,但这些方法比较费时费力[18,24]。

图5 噬菌体Bp47-12 对温度(A)及酸碱度(B)的耐受能力Fig.5 Resistance of Bp47-12 to temperature (A), acid and alkali (B)

图6 噬菌体Bp47-12 的体外裂解特性分析 Fig.6 In vitro lytic assay of Bp47-12
由于非宿主菌对噬菌体不敏感,本研究在前期分离的亲本ETEC噬菌体JS09基础上,建立了一种简便的扩大噬菌体宿主谱的方法。试验发现,通过提高MOI的比例将效价较高的噬菌体与非宿主菌共培养能够有利于筛选到宽宿主谱噬菌体。噬菌体的生存离不开细菌,噬菌体在细菌的进化过程中发挥着重要的作用[24],噬菌体的宿主特异性不是一成不变的,噬菌体与细菌在生长循环过程中相互作用共进化,这种互相作用受到环境条件和整体模式的影响,使得噬菌体或细菌能够发生适应性变异[25]。因此推测,在特定的生长条件和选择压力下,可促使亲本噬菌体的宿主特异性发生变化。
噬菌体的宿主谱由噬菌体在感染过程中受体结合蛋白与宿主菌的受体蛋白相互作用决定[2]。有尾噬菌体T4通过尾丝蛋白识别宿主受体,包括长尾丝蛋白和短尾丝蛋白[26]。研究表明,通过改变长尾丝蛋白基因的His box序列能够拓宽T4噬菌体的宿主 谱[27]。与亲本噬菌体JS09相比,噬菌体Bp47-12的短尾丝蛋白基因序列发生改变(数据尚未发表)可能导致宿主谱的拓宽,对此机制的研究仍在进行中。通过改变宿主受体结合蛋白基因能够改变噬菌体宿主谱,Yoichi等[28]利用同源重组技术将T2噬菌体宿主受体识别基因gp37和gp38替换为EHEC O157∶H7特异性噬菌体pp01的gp37和gp38,构建了一株重组噬菌体T2ppD1,该重组噬菌体能够侵染大肠杆菌O157∶H7及其近缘属种,但是不能侵染原宿主菌大肠杆菌K12或其衍生菌。
借助于噬菌体与宿主菌共进化,将噬菌体与非特异性细菌共同培养,以期拓宽噬菌体的宿主谱,此技术无需繁琐耗时的基因操作。Mapes等[24]通过将噬菌体与多株耐药性不同的铜绿假单胞菌经过几轮共培养,拓宽了铜绿假单胞菌特异性噬菌体的宿主谱,并能够有效抑制铜绿假单胞菌形成的生物膜。EHEC O157∶H7导致的食品污染和腹泻严重威胁着人类健康[5]。研究表明,EHEC O157∶H7噬菌体主要应用于食品和食品加工器械表面的消毒,以及动物体内的杀菌试验[29]。在37℃条件下,pp01、e11/2和e4/1c三种噬菌体混合制剂能够有效地去除肉类中的EHEC O157∶H7[30]。因此,本研究中筛选的能够裂解EHEC O157∶H7的宽宿主谱噬菌体具有潜在的应用价值。
本研究建立的拓宽噬菌体宿主谱的方法和分离到的宽宿主谱噬菌体Bp47-12能够同时裂解ETEC和EHEC O157∶H7菌株,因此具有潜在的应用价值和一定的研究意义,同时也为拓宽裂解性噬菌体宿主谱和应用噬菌体提供科学依据和可行性。

