黑灵芝多糖对丙烯酰胺致大鼠肝脏氧化 损伤的保护作用
江国勇,雷艾彤,杨 莹,余 强,谢建华,陈 奕
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
丙烯酰胺(acrylamide,AA)是一种应用广泛的工业化学品,同时还普遍存在于炸、烘、烤等高温食品中,与人类生活环境密切相关[1-3]。然而,AA具有多种生理毒性,已被国际癌症研究机构列为“可能人类致癌物”(2A类)[4]。由于AA是一种水溶性小分子物质,渗透性强,人体可通过消化道、呼吸道、皮肤黏膜等多种途径接触并吸收AA,在消化过程中可以快速分布于全身的组织中造成毒性[5]。肝脏是AA毒性的靶器官之一,研究表明AA能诱导肝细胞产生过量活性氧(reactive oxygen species,ROS),消耗解毒过程中的重要物质谷胱甘肽(glutathione,GSH)并引起脂质过氧化(丙二醛(malondialdehyde,MDA)含量增高),引起肝细胞氧化损伤[6-8]。
以往对AA的研究主要集中在其形成抑制方面,尤其是在热加工过程中如何采取各种措施以降低食品中AA的含量,然而,中西方饮食习惯导致人体无法避免地长期暴露在低水平AA环境下。因此如何削弱AA体内毒性,寻找可拮抗AA毒性的天然产物,构建人类AA毒性防护的第二道屏障具有重要意义。近年来大量研究表明,多种植物来源天然产物对生物来源的ROS具有显著的清除和抑制作用。Gedik[9]和Shrivastava[10]等研究发现,藏红花素和橙皮素处理AA染毒的大鼠后,抗氧化酶活力得到显著提升,炎症缓解,一定程度上缓解了AA毒性。Alturfan等[11]研究发现白藜芦醇对AA致大鼠氧化应激和DNA氧化损伤起到保护作用。大型植物真菌黑灵芝(Ganoderma atrum)在我国作为药食同源食品已有2 000多年历史,然而关于黑灵芝来源的天然产物对于AA体内毒性的抑制作用尚无报道。本课题组的前期研究[12-13]报道了一种从黑灵芝子实体中分离出的黑灵芝多糖(Ganoderma atrumpolysaccharides,PSG),对其结构表征发现,PSG的主要水溶性成分PSG-1是一种由酸性1,3-糖苷键连接支链、1,6-糖苷键连接β-Glcp主链的杂多糖-蛋白质复合物,其分子质量为1 013 kDa,由葡萄糖、甘露糖、半乳糖和半乳糖醛酸以物质的量比为4.91∶1∶1.28∶0.71组成。众多体内外研究表明PSG具有抗氧化防御能力,能够改善过氧化氢诱导的氧化应激,在清除自由基功能方面尤其突出[14-16]。
本课题组最近一项研究[17]表明,PSG能通过改善IEC-6细胞氧化应激和线粒体凋亡途径有效抑制AA毒性,然而到目前为止,关于PSG对AA诱导的肝脏损伤是否具有保护作用鲜见报道。因此,本研究旨在探讨PSG对AA诱导大鼠肝脏氧化损伤的保护作用,以期为PSG的充分应用与深度开发提供一定的理论依据,同时为AA膳食防治提供指导。
1 材料与方法
1.1 材料与试剂
黑灵芝购于江西赣州灵芝基地。清洁级雄性SD大鼠(体 质量160~180 g,生产许可证号:SCXK(湘)2016-0002,使用许可证号:SYXK(赣)2005-0001)购于湖南斯莱克景达实验动物有限公司。
AA(纯度>99.9%) 上海阿拉丁生化科技股份有限公司;谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine transaminase,ALT)、甘油三酯(triglyceroles,TG)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 南京建成生物工程研究所;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、碱性磷酸酶(alkaline phosphatase,ALP)、BCA蛋白浓度试剂盒 上海碧云天生物科技有限公司;白细胞介素(interleukin,IL)-1β、 I L-1 0 酶联免疫吸附测定试剂盒 武汉博士德 公司;其余试剂均为国产分析纯。
1.2 仪器与设备
3K15高速台式离心机 德国Sigma公司;3001全波长扫描式多功能读数仪(多功能酶标仪) 美国Thermo公司;A10超纯水仪 美国Millipore公司;2HWY-2102生化培养箱 上海森信实验仪器公司;KZ-II组织破 碎仪 武汉塞维尔生物科技有限公司;AL104型电子 天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 PSG的提取制备
黑灵芝子实体经粉碎机反复粉粹处理至粉状细微颗粒,用体积分数95%乙醇溶液浸泡24 h后,采用改良的热水浸提醇沉法提取PSG。将浸提液旋蒸浓缩至原体积1/5,采用Sevag法脱蛋白处理,脱蛋白后依次用自来水透析2 d、蒸馏水透析1 d、超纯水透析1 d,再用体积分数95%乙醇溶液沉淀,沉淀物分别用无水乙醇、丙酮、无水乙醚各洗涤2 次,浓缩,冷冻干燥,得到精制PSG。
1.3.2 AA诱导大鼠肝损伤模型的建立
选取健康雄性SD大鼠60 只,体质量160~180 g,于12 h明暗交替条件下适应1 周。随机分为6 组,每组10 只:1)正常组:等体积的生理盐水;2)模型组:20 mg/kgmbAA溶液;3)阳性对照组:200 mg/kgmbN-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC);4)PSG低、中、高剂量组:PSG 50、100、200 mg/kgmb。各给药组在给予相应药物0.5 h后,口腔灌胃AA水溶液,连续30 d。最后1 次给药后,禁食不禁水18 h处死,进行相关指标测定。
1.3.3 大鼠一般情况观察
实验期间观察大鼠的精神状态、行为、毛发光泽度、有无死亡情况等,拍照并记录。
1.3.4 肝脏病理检测
取大鼠肝脏部分右叶(后续测定取肝脏左叶相应部位),生理盐水清洗,滤纸吸干,于体积分数10%中性福尔马林溶液中固定,石蜡包埋,切片,苏木素-伊红(hematoxylineosin,HE)染色,光镜下观察组织切片并拍照。
1.3.5 肝功能指标测定
采用眼球取血法,室温放置2 h,待血清分层后于4 000 r/min、4 ℃下冷冻离心10 min,吸取上层血清部分,-80 ℃条件下保存备用。按照检测试剂盒步骤测定血清ALT、AST、ALP活力和TG浓度。
1.3.6 肝脏氧化指标测定
称取100 mg肝脏组织加入900 μL生理盐水制备肝脏组织匀浆液,于8 000 r/min、4 ℃下离心15 min,吸取上清液,根据检测试剂盒步骤测定SOD、CAT、GSH-Px活力和MDA含量。
1.3.7 免疫指标测定
采用1.3.5节所制血清样品,按照检测试剂盒步骤测定血清IL-Iβ、IL-10质量浓度。
1.4 数据处理与分析
采用SPSS 16.0软件进行数据分析,所有实验均重复3 次, 结果以平均值±标准差表示;采用Graph Pad Prism 6 软件作图;采用单因素方差分析和Tukey’s多因素t检验进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 大鼠一般情况观察及死亡率
在AA造模期间,各组大鼠均未出现中毒死亡。AA染毒第20天,模型组大鼠开始出现抱团嗜睡、后肢瘫痪并容易被激怒的现象,且毛发凸起失去光泽(图1B),表明灌胃AA第20天AA的蓄积毒性作用开始体现。

图 1 AA造模期间大鼠一般情况Fig. 1 General conditions of normal and AA-treated rats
2.2 PSG对AA致大鼠肝脏组织病理变化的影响
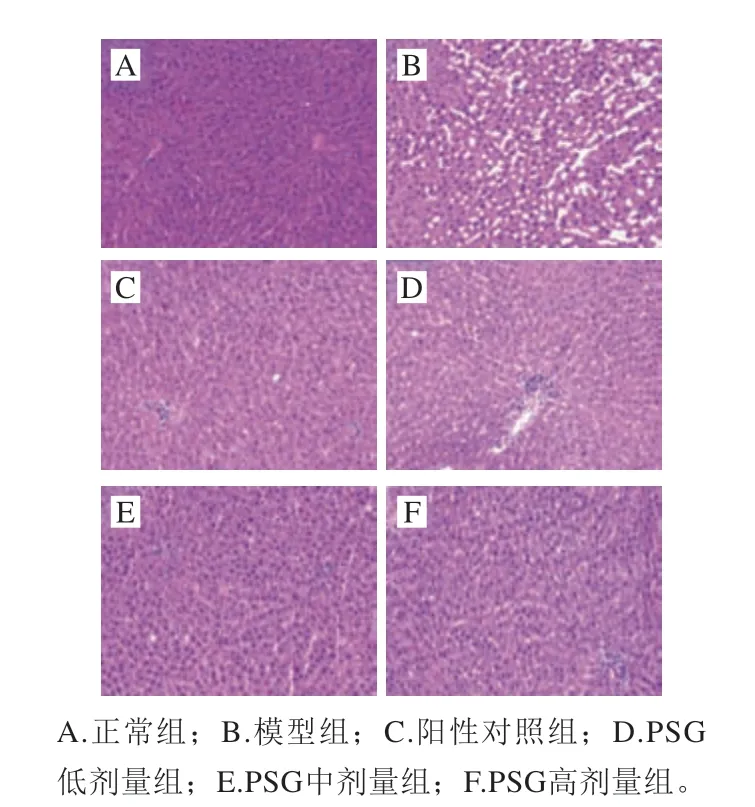
图 2 PSG对AA致大鼠肝脏损伤的组织病理变化影响 (HE染色)(200×)Fig. 2 Effect of Ganoderma atrum polysaccharides on AA-induced hist opathological changes in rats (HE staining) (200 ×)
由图2可知:正常组肝脏组织结构正常,肝细胞以中央静脉为中心,向四周呈发散性排列,细胞排列致密,肝细胞索排列规律,无充血和炎性细胞浸润,核仁清晰(图2A);模型组肝索断裂,细胞质大量丢失,空泡严重,且细胞核固缩较严重,出现炎症细胞浸润 (图2B);相对于模型组,阳性对照组和PSG低剂量组肝索恢复,核仁清晰,排列整齐,空泡化现象基本缓解,仅有少量细胞质丢失(图2C、D);PSG中、高剂量组基本接近于正常组(图2E、F)。上述结果表明,AA染毒使大鼠肝细胞核固缩,细胞质丢失,导致肝细胞坏死,从而损伤肝脏组织;而PSG和阳性药物干预处理后,肝细胞组织形态趋于正常,提示PSG对AA致大鼠肝脏损伤具有较好的保护作用。
2.3 PSG对AA致大鼠肝脏功能损伤的影响

图 3 PSG对AA致大鼠肝功能损伤的影响Fig. 3 Effect of Ganoderma atrum polysaccharides on liver function injury induced by AA in rats
由图3可知,与正常组相比,模型组大鼠血清中AST、ALT、ALP活力均极显著升高(P<0.01),TG浓度显著升高(P<0.05)。与模型组相比,NAC处理后,阳性对照组大鼠血清中AST活力和TG浓度得到一定程度降低,但不显著,ALT和ALP活力显著降低(P<0.05)。与模型组相比,低、中、高剂量PSG处理后,大鼠AST、ALT、ALP活力和TG浓度均极显著降低(P<0.01),降低程度远大于阳性对照组。结果表明,AA染毒后各项肝功能指标显示大鼠肝脏受到损伤,同时PSG对AA致大鼠肝损伤具有显著的保护作用,且其效果远远优于NAC。
2.4 PSG对AA致大鼠肝脏氧化损伤的影响
氧化应激是肝脏损伤的重要机制之一。体内自由基代谢的平衡主要通过抗氧化系统维持,主要包括SOD、GSH-Px、CAT等,MDA是脂质过氧化物降解的主要产物,MDA的含量也能间接反映机体细胞受自由基攻击的严重程度[18]。
由表1可知,模型组大鼠中MDA含量极显著高于正常组(P<0.01),NAC和低、中、高剂量PSG均能够极显著降低大鼠体内MDA含量(P<0.01)。灌胃AA后,肝组织抗氧化酶(SOD、GSH-Px、CAT)活力均极显著降低(P<0.01),而NAC和不同剂量PSG处理均能不同程度地提升抗氧化酶活力,且PSG尤其是高剂量时,其提升抗氧化酶活力的能力远大于NAC。结果提示,PSG能够维持大鼠体内抗氧化系统,提高抗氧化酶活力,同时降低脂质过氧化,从而缓解AA导致的大鼠肝脏损伤。
2.5 PSG对AA致大鼠肝脏损伤中血清炎症因子水平的影响

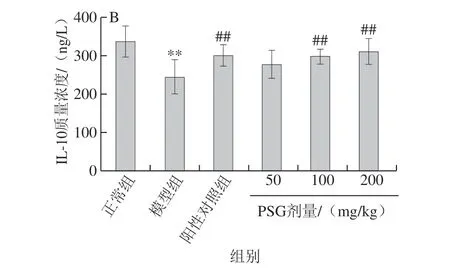
图 4 PSG对AA致大鼠肝脏损伤中血清炎症因子IL-1β(A)、IL-10(B)质量浓度的影响Fig. 4 Effect of Ganoderma atrum polysaccharides on serum IL-1β (A) and IL-10 (B) levels in rats with AA-induced liver injury
炎症细胞因子参与炎症反应,在众多炎症细胞因子中,起主要作用为IL-1β、IL-6、IL-10、肿瘤坏死因子等。由图4可知,与正常组相比,模型组大鼠中血清IL-1β质量浓度极显著升高(P<0.01)。与模型组相比,阳性对照组和PSG处理组大鼠体内IL-1β质量浓度均显著降低(P<0.01,P<0.05)。与模型组相比,中、高剂量PSG能够极显著提高血清IL-10质量浓度(P<0.01)。以上结果表明,灌胃不同剂量的PSG均可以有效缓解AA导致的炎症反应,抑制AA诱导的大鼠肝组织中促炎细胞因子IL-1β的表达,并提高抗炎因子IL-10水平,从而达到对肝脏的保护作用。
3 讨 论
AA对人类健康造成潜在的重大风险,包括致突变性、遗传毒性、致癌性[19]。肝脏是主要的解毒代谢器官,因此也成为AA的主要靶器官之一。本实验结果表明,AA处理后,大鼠血清AST、ALT和ALP活力 (P<0.01)及TG浓度(P<0.05)显著或极显著增加。ALT和AST是动物体内2 种重要的转氨酶,正常情况下在血清中很少,但当肝脏发生损伤时,肝细胞结构受到一定破坏,AST、ALT就会漏出至血液,因此血清中AST、ALT活力变化可以作为肝脏受到损害时的一种应答反应[20-21]。 肝脏受损时胆汁循环受阻,ALP活力升高,同时导致机体对游离脂肪酸的利用减少,血液中游离脂肪酸水平升高,导致血清中TG浓度升高,因此血清中TG浓度也间接反映了肝脏受损程度[22]。氧化应激是AA损伤的主要机制之一[2]。Jiang Guoyong等[17]的研究结果提示,在IEC-6细胞模型中,AA能刺激IEC-6细胞产生过量ROS。Ghorbel等[1]发现不同剂量的AA可诱导破坏肝细胞中促氧化剂和抗氧化剂平衡而引起氧化损伤。机体接触AA后会通过酶与非酶系统产生ROS。当ROS增多至超过机体清除自由基能力时,机体内抗氧化系统就会失衡,从而发生氧化损伤。Luo等[23]研究发现AA及其代谢物(缩水甘油酰胺)能与GSH结合形成共轭异构体,AA给药后体内GSH水平降低。在氧化应激状态下,GSH消耗可能会导致脂质过氧化。MDA是脂质过氧化的主要产物。MDA水平升高提示机体可能发生了氧化损伤,机体抗氧化系统平衡遭到破坏[24]。当机体氧化应激第一道防线被突破,过多的ROS开始攻击DNA生物大分子,引起DNA损伤。氧化应激通过核因子κB激活产生炎症因子并发生炎症 反应[25]。因此本研究采用自由基清除能力突出的PSG干预AA毒性作用,并进行肝脏组织病理观察,测定血清AST、ALT、ALP活力、TG浓度等肝脏功能指标,机体氧化与抗氧化系统状态,及相关免疫因子评价AA诱导的肝脏损伤情况。肝损伤组织病理学特征表明,与模型组大鼠相比,PSG处理缓解了AA诱导的肝细胞损伤。AA可以促进自由基产生并诱导肝组织损伤[26]。动物造模后各项肝功能指标均与正常组差异显著(P<0.01、P<0.05),提示肝损伤模型成功。进一步评价机体氧化/抗氧化系统发现,AA处理后机体内产生过量ROS,抗氧化系统紊乱,主要表现为抗氧化酶(SOD、CAT、GSH-Px)活力极显著降低(P<0.01)和脂质过氧化产物(MDA)含量极显著升高(P<0.01),最终导致肝脏发生氧化损伤,这与Yu Rongmin等[27]的研究结果相一致。在氧化损伤情况下,ROS攻击生物大分子并促使机体产生炎症因子。本实验中,AA处理后大鼠体内促炎因子IL-1β质量浓度极显著上升(P<0.01)。
PSG良好的生物功能与其化学结构密不可分。本课题组前期研究中,PSG具有良好的体外抗氧化活性,这可能主要归因于其中的酚类和蛋白质成分[28]。文献[29]报道,真菌提取物中常见的酚类化合物,如酚酸类、酚类衍生物具有良好的抗氧化活性。酚类物质的抗氧化活性可认为是氢在氧化反应中充当了H-或者电子供体的角色,最终终止氧化电子反应链[30]。另外,抗氧化活性多肽或蛋白中典型的氨基酸包括亲核含硫氨基酸、芳香族氨基酸、咪唑氨基酸等组分也在PSG中发现[12]。进一步探讨其与免疫活性的关系发现,PSG免疫活性与其蛋白质、总酚、中性糖含量均无明显关系,但与糖醛酸含量呈现线性关系,其中酸性β-(1→3,1→6)-葡聚糖结构对PSG发挥免疫活性具有关键性作用。
4 结 论
综上所述,作为天然活性产物来源,PSG可以提高AA诱导肝损伤大鼠体内抗氧化酶(SOD、CAT、GSH-Px) 活力,降低促炎因子(IL-1β)、提高抗炎因子(IL-10)质量浓度,一定程度地恢复肝脏功能和修复组织病理损伤。PSG对AA诱导的大鼠肝脏损伤具有保护作用,作用机制可能与其酚类蛋白成分的抗氧化作用和酸性β-(1→3,1→6)葡聚糖结构的免疫调节有关。上述研究对于治疗或早期预防AA毒性具有重要的理论意义和实践价值,也能为膳食营养提供科学指导和实验依据,同时也为以PSG为原料的高附加值产品的开发提供积极的影响。

