幽门螺杆菌联合血清胃蛋白酶对胃癌的诊断价值
任秀梅 石 莎 赵亚升
胃癌(gastric cancer)是指源于胃黏膜上皮细胞的恶性肿瘤,其发病率和死亡率均居于我国恶性肿瘤的首位,且发病年龄群逐渐年轻化[1]。胃癌早期缺乏特异性症状,早期诊断率较低,确诊时多数患者为胃癌晚期,预后比较差[2]。幽门螺杆菌(Helicobacter pylori,Hp)感染是胃癌发生与发展的重要影响因素,Hp感染正常人的胃上皮黏膜后,可诱发消化道疾病的发生[3]。有关研究显示90%左右的胃癌患者的胃黏膜中存在Hp感染,而且随着Hp感染程度加重,胃癌的进展程度也加重[4]。胃蛋白酶原(Pepsinogen,PG)是胃蛋白酶的前体,在人体内主要由胃黏膜腺体细胞分泌,其中PGⅠ主要由胃底腺的颈黏液细胞和主细胞分泌,PGⅡ除由颈黏液细胞和主细胞分泌外,还可来源于胰腺、前列腺、十二指肠腺、幽门腺等[5]。机体分泌的PG在细胞受刺激后可有部分通过胃黏膜毛细血管进入血液循环,可在血液中稳定表达,从而可以用来评估胃损伤程度和功能变化[6-7]。本文具体探讨了血清Hp联合血清PG对胃癌的诊断价值,以提高胃癌的早期检出率。现报告如下。
1 材料与方法
1.1 一般资料
选择2016年2月至2018年2月在我院诊治的胃部疾病患者189例,纳入标准:临床资料完整;医院伦理委员会批准了此次研究;首诊患者,检测前未行任何治疗。排除标准:患有其他系统肿瘤或严重疾病者;孕妇、哺乳期及过敏体质患者;严重心肺肝肾功能不全患者;临床资料缺乏患者;中途进行过影响血清标志物水平的治疗,无法判断水平变化者;3个月内参加过其他临床试验者。入选的189例患者中胃癌患者39例(观察组),胃炎患者150例(对照组),2组患者的收缩压、体重指数、舒张压、性别、年龄等对比,差异无统计学意义(P>0.05)。见表1。在观察组中,平均肿瘤直径为(3.89±0.29)cm;分化程度:高分化22例、低分化10例,中分化7例;临床分期:Ⅰ期14例、Ⅱ期16例、Ⅲ期6例、Ⅳ期3例;区域淋巴结转移14例,远处转移16例。在对照组中,非萎缩性胃炎30例,萎缩性胃炎120例。
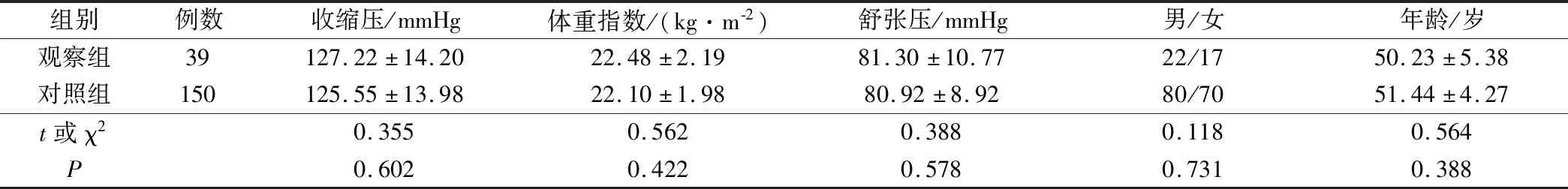
表1 2组一般资料对比
1.2 Hp检测
采用C-13呼气试验检测系统进行检测,所有患者检查前需空腹3 h以上,用温开水口服一颗胶囊,静坐15 min后向专用的呼气卡(三明市贝真生物科技有限公司)中吹气留取样本,再将呼气卡放入专用的检测仪内进行判断,呼气卡颜色呈红色-紫红色为阳性。
1.3 血清PG检测
所有患者均空腹(≥8 h)抽取静脉血3 ml,4 000 r/min下离心5~10 min,收集上层血清,-20 ℃下冷冻保存待检。采用化学发光微粒子免疫分析法检测血清PGⅠ和PGⅡ含量,按照标准操作流程进行操作,PGⅠ和PGⅡ检验临界参考值:PGⅠ<80 ng/ml,PGⅡ<90 ng/ml。
1.4 统计方法
本研究所有数据的统计分析均使用SPSS 22.00软件完成,计量数据以均数±标准差表示,计数数据以率表示,对比为t检验与卡方χ2检验等,记录胃癌诊断敏感度、特异度、阳性预测值、阴性预测值等指标,P<0.05为差异有统计学意义。
2 结果
2.1 Hp阳性率对比
观察组与对照组的Hp阳性率分别为82.1%(32/39)和40.0%(60/150),观察组显著高于对照组(χ2=21.909,P=0.000)。
2.2 血清PGⅠ和PGⅡ阳性率对比
观察组的血清PGⅠ和PGⅡ阳性率为92.3%、100.0%,显著高于对照组的44.0%和28.7%(P<0.05),见表2。

表2 2组血清PGⅠ和PGⅡ阳性率对比(例,%)
2.3 诊断价值对比
在观察组中,PGⅡ的诊断敏感性最高(96.0%),PGⅠ的诊断特异性最高(32.0%)。见表3。
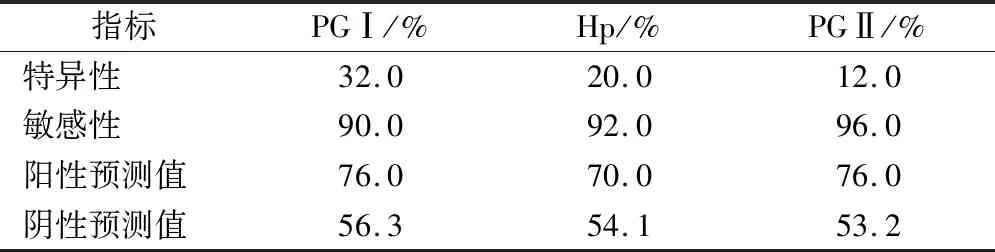
表3 Hp联合血清胃蛋白酶对胃癌的诊断价值(n=39)
3 讨论
胃癌是因胃黏膜上皮组织恶变而出现的消化道恶性肿瘤,多由胃炎发展而来,在我国具有很高的发病率,不过发病早期无特异性症状或明显不适体征,因此,很多患者在就诊时处于晚期,死亡率增加[8]。该病的具体发病机制还不明确,不过幽门螺杆菌(Hp)感染与胃癌的发生关系密切,也是公认的胃癌第一致癌因子[9]。Hp感染可以引起胃黏膜慢性炎症,继而出现黏膜非典型增生、萎缩、肠化,最终形成胃癌[10]。本研究显示观察组与对照组的Hp阳性率分别为82.1%和40.0%,观察组显著高于对照组(P<0.05)。有研究报道,在当前的新发胃癌病例中,大约80%以上与Hp密切相关[11]。Hp是一种定植在胃黏膜组织上皮细胞的螺旋状、微需氧革兰氏阴性菌,电镜下观察有4~6条带鞘鞭毛,光镜下呈s型。胃炎合并有Hp感染,可增加胃癌发生的几率[12]。不过也有研究表明Hp感染通常是在胃癌初始阶段起作用,但不是决定性因素[13]。
分子生物学研究显示发现胃癌的发生与癌基因的异常表达、抑癌基因的失活密切相关,这些基因的生物学特性的改变可以引起胃黏膜上皮细胞增殖与凋亡失衡,诱发胃癌的发生。肿瘤标志物是由恶性肿瘤组织细胞分泌和产生的抗原生物活性物质,在肿瘤上的应用多数为血清相关标志物。较好的血清相关标志物常需满足以下条件:易于检测、半衰期较短、与肿瘤特征显著相关、敏感度高、特异度高等[14]。PG由胃黏膜分泌的并且在胃酸的作用下被激活为具有消化作用的胃蛋白酶的前体,其中PG I由胃体、胃底腺的主细胞和颈黏液细胞分泌,而PGⅡ则广泛存在于胃体、十二指肠近端、胃窦十二指肠腺[15]。本研究显示观察组的血清PGⅠ和PGⅡ阳性率为92.3%、100.0%,显著高于对照组的44.0%和28.7%(P<0.05)。从机制上分析,当胃癌发生时,胃黏膜中主细胞和黏液细胞减少,导致PGⅠ和PGⅡ分泌量上升。有研究也显示,在胃癌的发病过程中,由于胃黏膜细胞质量和数量上的改变,必将会引起PGⅠ和PGⅡ分泌的增加[16-17]。
绝大部分胃癌患者一般会生存5年以上的时间,但是对于晚期胃癌患者,仅30%的患者会生存到5年以上。因此对胃癌患者进行早期诊断,是改善患者预后的关键[18]。胃癌的形成是多因素协同作用的结果,虽然发病机制目前尚未完全明确,但是Hp感染会导致胃黏膜上皮细胞增殖与凋亡失衡[19]。不过本研究显示在观察组中,PGⅡ的诊断敏感性最高(96.0%),PGⅠ的诊断特异性最高(32.0%),说明血清PG的应用诊断效果更好。当前也有研究显示PG联合其他肿瘤标志物诊断萎缩性胃炎和胃癌敏感性和特异性较单项诊断有所提高,可对现有的传统标志物进行有效补充[20-21]。本研究也有一定不足,总体例数比较少,数据为回顾性分析,缺少前瞻性研究,将在下一步进行深入分析。
总之,Hp联合血清PG对胃癌的早期诊断具有很好的临床应用价值,能反映胃部疾病患者癌变的可能。

