幽门螺杆菌感染与胃癌细胞侵袭转移的关系研究
李 睿 龚 琳 李 庚 潘国庆
目前,成人幽门螺杆菌(helicopter pylori,H.pylori)的感染率在世界范围内已超过50%,在我国幽门螺杆菌感染率更高达80%[1-2]。潘等[3]研究表明,MMP-9的表达能促进胃癌细胞的运动和侵袭能力,其与胃癌的预后相关。本研究拟采用不同浓度的H.pylori感染胃癌细胞,利用Western-blot实验来检测胃癌细胞中MMP-9、p-ERK1/2和t-ERK1/2表达的变化水平,再进一步利用细胞侵袭实验,观察H.pylori对胃癌细胞侵袭能力的影响,来探究H.pylori与胃癌细胞侵袭转移能力改变的分子机制,为胃癌中根治H.pylori提供一定的理论依据。
1 材料与方法
1.1 材料
胃癌细胞株SGC7901购自于上海柯雷生物科技有限公司;幽门螺杆菌26695菌株(ATCC 26695国际标准株)购自于美国ATCC;胎牛血清(FBS)购自杭州四季青生物工程材料有限公司;Ham's F12和RPMI1640培养基购自美国Hyclone公司;链青霉素购自北京索莱宝科技有限公司,基质胶购自于美国BD生物科技有限公司,MMP-9抗体购自美国Abcam公司,ERK/p-ERK抗体购自美国Cell Signaling Technology公司,GADPH购自于美国Sigma Aldrich公司,24孔Transwell室购自于美国Corning公司。
1.2 方法
1.2.1 细胞及细菌共培养 使用Ham's F12培养基,于37 ℃,5%CO2浓度的培养箱内培养,培养2~3天后传代。幽门螺杆菌26695国际标准株种植于含5%无菌脱纤维羊血、且经过高压灭菌的哥伦比亚琼脂培养基,于微需氧培养罐中,使用微需氧产气袋,置于37 ℃培养箱中进行培养。培养基经高压灭菌后自然冷却至50 ℃时添加脱纤维羊血及多粘菌素B(250 U/L),万古霉素(6 mg/l),两性霉素(2 mg/l),TMP(5 mg/l),混匀后浇板。将长成菌落的H.pylori悬浮于含3%胎牛血清的Ham's F12培养基中,测定OD660值,1 OD660=1×108菌落形成单位(CFU)。按胃癌细胞与幽门螺杆菌菌落之比为1∶0、1∶50、1∶100共培养12 h;按胃癌细胞与幽门螺杆菌菌落之比为1∶100,与SGC7901共培养0、12、24 h。再用PBS清洗5次,收集细胞并提取蛋白。
1.2.2 Western-blot 使用RIPA裂解液将待测蛋白调整至相同浓度待用。将等量蛋白加入到10%浓度SDS-PAGE胶上样孔中,电泳120 min后用半干转移法恒流转移,60 min后将凝胶上的蛋白转移至PVDF膜上。用含5% BSA的TBST室温封闭1.5 h,再按照分子量剪下膜与抗MMP-9及GADPH抗体进行孵育,4 ℃过夜。一抗孵育结束后TBST洗3次,每次10 min。接着在室温下与辣根过氧化物酶标记的二抗孵育1 h,孵育结束后TBST洗3次,每次10 min。去掉多余的TBST后在膜上滴加ECL发光液发光,于数码凝胶分析系统(天能)采集曝光数据,用Image J图形处理软件分析目标条带。
1.2.3 Transwell 侵袭实验不处理组按1∶8比例用无血清Ham's F12培养基稀释基质胶,混匀后吸取100 μl添加到Transwell小室中,37 ℃温箱成胶1 h后取出,于下室添加500 μl含10%胎牛血清的F12培养基,上室加入无血清F12培养基重悬的SGC7901细胞,放入37 ℃培养箱内。36 h后取出。无菌棉签拭去小室上层的细胞,2%多聚甲醛固定小室下层5 min。PBS清洗后苏木精染色5 min,再次PBS清洗。高倍镜下随机选取5个视野计数。处理组加入无血清Ham's F12培养基稀释基质胶时,再加入ERK抑制剂U0126,孵育4 h后,其余步骤同不处理组。
1.3 统计分析
应用SPSS 13.0软件采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 幽门螺杆菌对胃癌细胞中MMP-9表达的影响
与h.pylori 共培养24 h之后,胃癌细胞中MMP-9的表达量随胃癌细胞与h.pylori菌数比例的增加而增加(图1)。
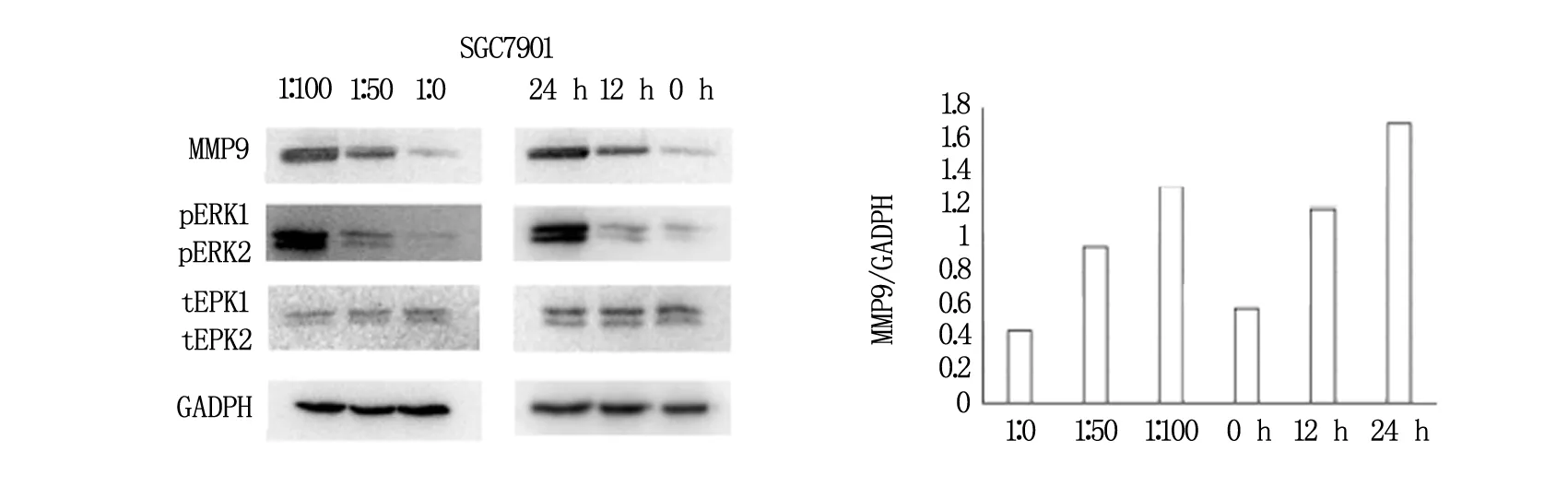
图1 MMP-9在SGC7901中表达情况
2.2 H.pylori对胃癌细胞p-Erk1/2、t-Erk1/2表达的影响
如图2所示,与h.pylori共培养之后胃癌细胞中p-Erk1/2的表达量也随胃癌细胞与h.pylori比例的增加而增加,而t-Erk1/2的表达变化不明显。

图2 p-Erk1/2、t-Erk1/2在SGC7901中表达情况
2.3 Transwell侵袭实验结果
不处理组中,随着胃癌细胞与H.pylori比例的增加,穿透基膜的胃癌细胞数目增加,各组穿透基底膜的细胞数之间差异有统计学意义(P<0.01),而加入ERK抑制剂U1206的处理组中,穿透基膜的细胞数明显减少,各组之间的差异有统计学意义(P<0.01),见图3。
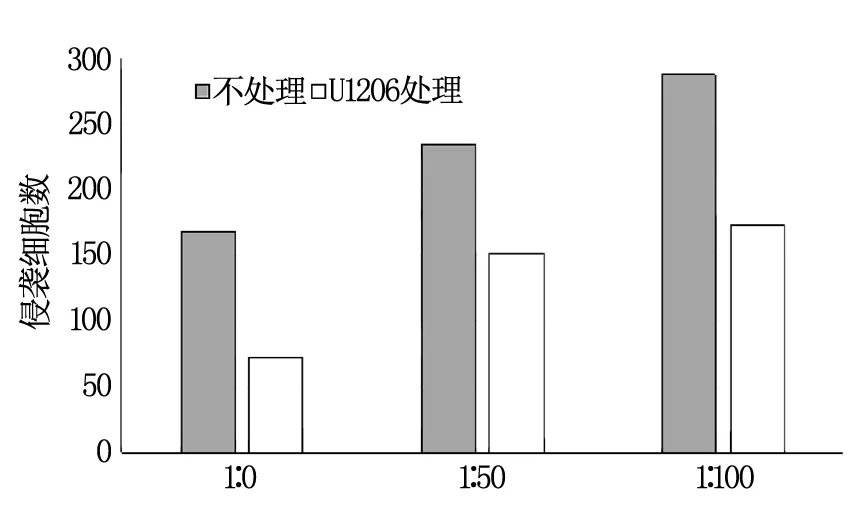
图3 胃癌细胞侵袭情况
3 讨论
H.pylori感染与人体慢性胃炎、消化性溃疡、胃癌、粘膜相关性淋巴组织淋巴瘤等疾病的发生、发展密切相关[4]。幽口螺杆茵作为细菌性致癌物,是胃癌最主要的致癌因素之一,但其潜在的致癌机制还尚不完全清楚。胃癌是起源于胃黏膜上皮的消化道恶性肿瘤,在我国胃癌的发病率占恶性肿瘤的第四位,死亡率占恶性肿瘤的第二位[5],而死亡率高的主要原因又与胃癌的复发和转移有关。
侵袭与转移是恶性肿瘤最主要的生物学特征,也是胃癌患者复发及死亡的主要原因[6]。肿瘤细胞侵袭转移是1个多因素、多步骤的复杂生物学过程,肿瘤细胞依靠内皮靶点和基底膜进行继发性侵袭[7]。目前的文献[8]表明MMPs可介入肿瘤的产生、侵袭、转移调控机制,其中MMP-9是MMPs中降解基底膜主要成分Ⅳ型胶原蛋白最主要的酶,它还可通过破坏局部组织结构促进肿瘤生长和肿瘤新血管形成而促进肿瘤转移。在肺癌、乳腺癌、卵巢癌和胃癌等[9-11]中,MMP-9的过表达与肿瘤侵袭转移呈正相关。
为了探究H.pylori是否是通过MMP-9 而促进胃癌细胞的侵袭转移能力,本研究中,把胃癌细胞和H.pylori按1∶0、1∶50、1∶100的比例共同培养,Western-blot实验结果显示,MMP-9的表达量增加了。说明h.pylori可能是通过影响胃癌细胞中MMP-9的表达,而增强肿瘤细胞的侵袭转移能力。
同时,在肿瘤侵袭转移过程中,信号转导通路的作用也至关重要[7]。丝裂原活化蛋白激酶(MAPK)信号转导通路,包括MAPK激酶激酶(MKKK)、MAPK激酶(MKK)和MAPK,是连接细胞外与细胞核之间信号转导的重要通路,其磷酸化形式激活后共同参与体内多种生理或病理过程的调节过程。其中,细胞外信号调节蛋白激酶1/2(ERK1/2)是MAPKs家族中的一个亚族,磷酸化细胞外信号调节蛋白激酶1/2(p-ERK1/2)是ERK1/2 磷酸化后的活性形式,通过从胞浆向胞核传递信号,参与细胞增殖分化等调节作用[12]。有文献[13]报道,在肺癌中激活ERK1/2,能使肿瘤细胞体外侵袭转移能力增强。ERK1/2 的活化异常与肿瘤发生、发展过程有关[14]。而ERK1/2信号通路将通过磷酸化激活转录因子如激活蛋白1(AP-1),Elk-1 等,其中 AP-1 位于基质金属蛋白酶家族(MMPs)基因启动子区域,持续的ERK1/2通路活化将上调MMPs表达,导致重要的蛋白水解酶MMP-2等含量增加,使细胞外基质蛋白的分解增强而导致肿瘤侵袭、迁移的发生[15-16]。因此,ERK1/2 及 MMPs 是肿瘤细胞发生侵袭和转移的关键环节[17]。
为了探究H.pylori促进胃癌细胞的侵袭转移能力的机制是否是通过ERK1/2通路,Western-blot实验结果显示,磷酸化的细胞外信号调节蛋白激酶1/2(p-ERK1/2)随着H.pylori比例的增加而显著增多。为了进一步研究,我们进行了Transwell侵袭实验,不处理组是不同比例H.pylori感染的胃癌细胞,处理组是加入ERK抑制剂剂U0126的不同比例H.pylori感染的胃癌细胞,分别测定各组细胞的侵袭力。结果表明,未处理组的细胞穿透基膜的数目随着H.pylori比例的增加而增多。而处理组的细胞穿透基膜的数目却明显减少了,各组穿透基膜的数目差异具有统计学意义(P<0.01),提示H.pylori感染可能通过ERK1/2-MMP-9信号通路发挥作用,从而增强胃癌细胞侵袭能力。
综上所述,H.pylori感染和胃癌发生、发展密切相关。其中幽门螺杆菌感染可通过激活ERK1/2信号通路,促进MMP-9的表达,从而在胃癌侵袭和转移过程中发挥重要作用,此发现可有助于在胃癌的临床诊疗过程中找到可靠有效的治疗靶点。本研究中初步揭示了H.pylori可通过ERK1/2-MMP-9信号通路,调控胃癌的侵袭转移,为胃癌的治疗提供了新思路。

