快速光响应曲线的优化及在底栖甲藻光适应特性研究中的应用
黄凯旋, 陈 亨, 徐帅帅, 刘莎莎, 吕颂辉
(暨南大学 赤潮与海洋生物学研究中心, 广东 广州 510632)
底栖甲藻(benthic dinoflagellate)是指附着在海洋基底, 如沙砾、珊瑚、大型海藻、岩石等基质上的甲藻生态类群[1]。野外调查发现水深0~5 m是底栖甲藻丰度最高区域[2], 这一区域因潮汐周期存在着复杂多变的光场。因此, 底栖甲藻的一个重要的挑战是避免强光照射造成光损伤。在长期演变中, 藻类进化出一系列保护机制适应强光照射, 其中非光化学淬灭(non-photochemical quench, NPQ)起到了重要的作用[3]。
NPQ主要是由叶黄素循环, 通过去环氧化过程将部分光能以无损害的热能形式耗散[4]。硅甲藻黄素循环是在甲藻和硅藻NPQ中已知的起到重要作用的叶黄素循环, 占据将近90%的非光化能耗散[5]。该循环一个重要特点是较小的ΔpH差就可以驱动硅甲藻黄素的去环氧化[6]。因此相对于高等植物, 硅藻和甲藻的NPQ所需的光强更小, 并且诱导时间也更短[7-8]。此外, 黑暗或低光条件, 部分底栖硅藻的NPQ不会完全释放, 甚至出现上升的情况, 称之为黑暗NPQ (dark NPQ)[9], 类似的情况同样在底栖甲藻中发现。通过以上不同的叶黄素循环机制, 使得硅甲藻的NPQ过程变得更为灵活, 能快速的响应光环境变化[10]。
Beer等[11]发现光化反应下的电子传递速率(electronic transport rate, ETR)与O2或CO2代谢有着密切的关系。以ETR绘制的光合作用曲线, 称为快速光响应曲线(rapid light curves, RLCs), 类似于以光合放氧为基础的曲线。RLCs由一组上升的光强梯度组成, 通过叶绿素荧光技术进行测定, 其中每个光强梯度一般不超过60 s, 整个过程不超过10 min, 因此适用于快速变化的光场[12]。RLCs能够反映光合生物的长期或短期的光适应情况, 因此RLCs在野外调查中已经有广泛的应用, 在大型海藻[13], 底栖微藻[14]和珊瑚[15]等底栖生物的调查中均起到重要的作用。但RLCs的测定中存在内生的光适应, 能够改变叶绿素a荧光的激发, 进而导致ETR测定产生偏离。如初始PSII电子受体醌受体A(QA)的氧化或NPQ在RLCs测定过程中产生光适应,影响了荧光的测定, 甚至由于过高的NPQ导致曲线不饱和情况。Perkins等[16]提出用反序的光强梯度, 即光强下降的顺序用于底栖硅藻的RLCs测定, 能一定程度降低内生光合作用变化的影响, 更为真实的反映实际光合作用状态。非序光曲线(non-sequence light curves, N-SLCs)是每一个光梯度均用单独的, 未经任何测定的样品进行测定光曲线, 并且光梯度的测定无需按照顺序进行测定[16-17]。由于每一个光梯度的样品均是独立的, 能基本去除内生光适应效应。
本研究目标是优化RLCs程序, 减少RLCs内生偏差, 改善RLCs技术在底栖甲藻的应用。Coolia (Ostreopsidaceae, Dinophyceae)是全球分布并具有潜在毒性的底栖甲藻, 在我国亚热带海域广泛分布[18]。本文选用Coolia tropicalis, 通过不同光背景短期驯化的细胞, 分别测定不同光序列结构和不同光梯度时长的RLCs, 对比N-SLCs, 进而评估RLCs光曲线过程中诱导的快速光适应的积累和反序RLCs的可行性。
1 实验材料与方法
1.1 实验材料
藻种Coolia tropicalis分离自海南岛, 保种于暨南大学赤潮与海洋生物研究中心。细胞培养在f/2培养基加富的自然海水中, 培养温度为25℃, 光强为100 μmol photons/(m2·s)(12 h/12 h, 光暗周期), 光强度由光度计QSI2100 (Biospherical Instrument Inc., USA)测定。取处于指数生长期的细胞进行后续实验。
1.2 实验方法
1.2.1 快速光响应曲线测定
60 mL藻液分装在玻璃试管(高20 cm, 半径2 cm)中, 在LED(150 W)下照射60 min, 通过试管包裹不同层数的中性网获得不同光强(210, 350, 400, 500, 800, 1 000 μmol photons /(m2·s)), 其中210和1 000 μmol photons/(m2·s)分别记作LL和HL用于显示的RLCs曲线和NPQ诱导曲线结果。照射期间, 由循环水控温装置CA-1111(EYELA, Japan)进行控温(25 )℃。取1 mL样品于2 mL棕色离心管中黑暗15 min, 随后测定快速光响应曲线。
使用浮游植物分析仪Phyto-PAM(Walz, Germany)对叶绿素荧光进行测定, 共设置64, 164, 264, 464, 664, 864, 1 264, 1 664和2 064 μmol photons/(m2·s) 9个光化光步数, 每个光化光步长(即照射时间)为10, 30或60 s, 光化光序列采用3种序列, (1)正序(Up), 即光化光强度从低到高顺序; (2)反序(Down), 即光化光强度从高到低顺序; (3)非序(NS), 即每个光化光强度均由单独的样品进行测定, 不存在先后顺序。每个序列3个重复, 由3次独立实验完成。
1.2.2 叶绿素荧光参数
每一个光化光强度, 有效光化学效率(Yield’)由调制式饱和脉冲技术测定。200 ms、4 000 μmol photons/(m2·s)饱和脉冲能够将光系统II(PSII)受体侧完全处于还原态, 诱导实时荧光(F′)升高至最大荧光(Fm′):

Phyto-PAM提供4个波段的Yield’, 选取波段470 nm(由于甲藻含有叶绿素c和类胡萝卜素, 520 nm同样也激发)的Yield’值用于计算相对电子传递速率(rETR):
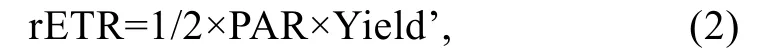
式中1/2代表两个光系统平分一个光子, PAR为光化光强度。
非光化学淬灭(NPQ)计算公式为:

硅甲藻黄素-硅藻黄素色素循环依赖的NPQ在黑暗中依旧能够维持黑暗NPQ如通过叶绿体呼吸(chlororespiration)途径。暗适应测定的最大荧光产量Fm不能够体现真实值。因此 NPQ计算用RLCs中的最大荧光产率Fm′max替代Fm[16]。
Phyto-PAM一个Gain水平上最高记录1 870 units, Fm或Fm′超过1 870 units都记录为1 870 units; 而在RLCs诱导过程中, Fm′信号低于100 units则会出现过载。因此, 过高或过低的F′信号都会导致NPQ值出现偏差。根据藻种的特性, 通过Gian的调整, 获得大约500~600 units, F′信号可避免上述情况的发生。
1.3 统计分析
根据文献[19], RLCs由公式(5)进行拟合。

式中Ps是与最大相对电子传递速率(rETRmax)相关参数, I为光化光强度, α为初始斜率, β为抑制率。

数据由SPSS16.0的One-way Anova的Tukey或Duncan法进行统计分析, P<0.05为显著。
2 结果
2.1 快速光响应曲线
如图1所示, 在LL(210 μmol photons/(m2·s))和HL(1000 μmol photons/(m2·s))光强条件驯化下, 非序和反序RLCs分别在光强664和864 μmol photons/ (m2·s)之后出现了光饱和或光抑制, 而正序RLCs并未出现光饱和或光抑制点。各RLCs序列的30 s和60 s的rETR之间无显著差异(P>0.05), 二者均显著高于10 s的rETR(HL的反序RLCs除外)(P<0.05)。 巧合的是, HL驯化下的反序和非序RLCs在30 s和60 s的曲线几乎重合(图1 d, f)。
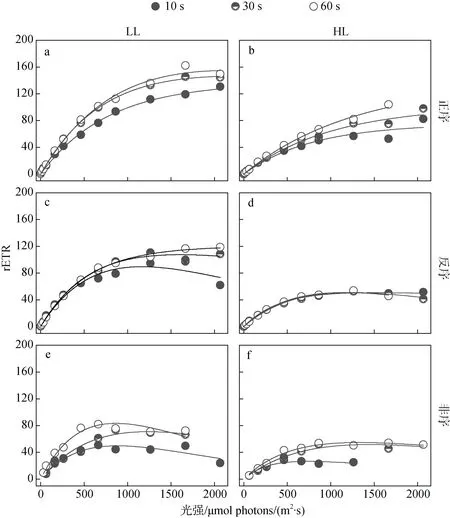
图1 步长和光序列对RLCs的影响 Fig. 1 Impact of light duration and sequence on rapid light curves
2.2 光合生理参数
对从6种光背景处理的光曲线所得出的α, rETRmax和Ek进行趋势比较(图2)。非序RLCs的α总体趋势呈现随光强的升高而降低, 其中60 s的显著高于10 s和30 s的(P<0.05)(图2 a, b, c)。反序和正序RLCs的α值高于非序RLCs(P<0.05), 并且在同一步长下表现相似的趋势。其中10 s的趋势与30 s和60 s的不同, 呈现出随光强升高而先升高后降低的趋势, 且反序RLCs的α显著高于正序(P<0.05)。
三种序列的rETRmax值的排序为: 正序RLCs>反序RLCs>N-SLCs(P<0.05)。非序RLCs的rETRmax也随着光强的升高而降低, 其中10 s的显著低于30 s和60 s的(P<0.05)(图2 d, e, f)。正反序RLCs的rETRmax趋势为随光强升高先轻微上升后下降。步长为30 s和60 s的正反序RLCs的rETRmax无显著差异(P>0.05), 且均高于10 s(P<0.05)。
三种序列RLCs的α和rETRmax总体而言的趋势是相似的, 但由rETRmax/α所得出的Ek趋势出现分化(图2 g, h, i)。30 s和60 s正序RLCs的Ek随光强升高而升高, 与10 s的趋势相反。非序和反序RLCs的Ek在光化光超过500 μmol photons/(m2·s)呈现下降趋势(10 s, LL反序RLCs结果除外, 图2 g), 在此之前维持不变或上升趋势。
2.3 NPQ动力曲线
NPQ动力曲线受到序列方式和步长的影响。其中反序RLCs的曲线与正序和非序完全不同, 其存在3个阶段的变化: 第一阶段为光强降低, 但光强较强足以诱导NPQ, 呈现NPQ随光强降低而升高; 第二阶段为光强继续降低, 当光强不足以维持最大NPQ时, NPQ随光强降低而降低; 第三阶段为由于叶绿体呼吸在低光强下NPQ重新上升。由于HL驯化下的NPQ所需诱导的光强强度更低, 所以曲线并未显示出第二阶段(图3 d)。正序和非序RLCs的NPQ均呈现随光强升高而升高的趋势, 但正序RLCs的NPQ上升速度远高于非序RLCs。
正序RLCs在高光强部分的NPQ显著高于反序和非序的(P<0.05)。正序RLCs的NPQ在光强2 064 μmol photons/(m2·s)时达到最大, 比较三种序列在此光强的NPQ, 正序RLCs步长10 s, 30 s和60 s 的NPQ在LL下分别为反序的2.86, 3.05和3.03倍, 是非序的3.21, 3.21和4.11倍; 在HL下为反序的1.64, 3.74和3.25倍, 是非序的5.74, 8.96和13.06倍。
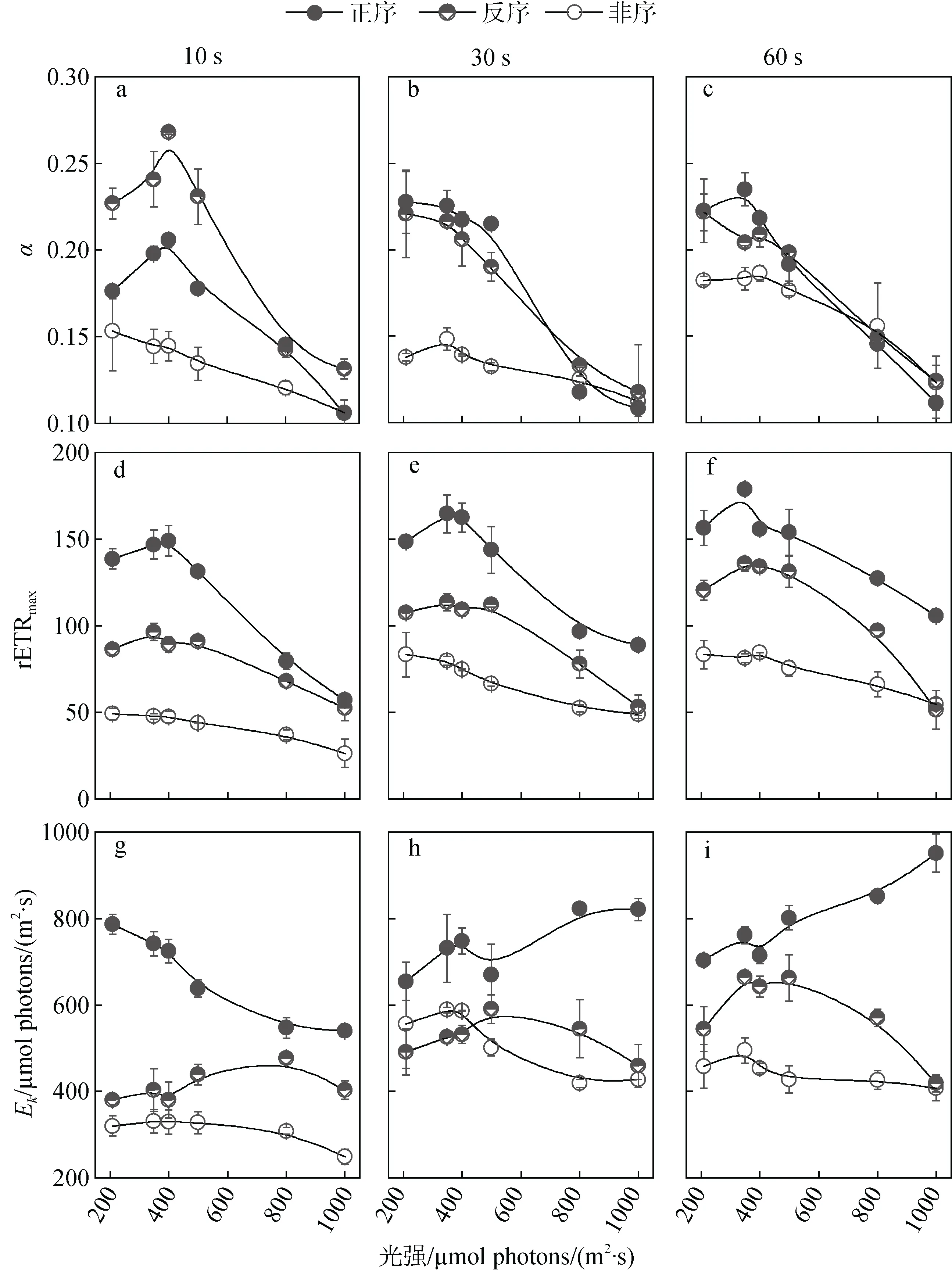
图2 步长和光序列对光合参数的影响 Fig. 2 Impact of light duration and sequence on the parameters of RLC
3 讨论
本文设置在不同光背景驯化下, 对不同光序和步长的光曲线进行比较, 目的是探究RLC曲线中内在光适应是否会影响底栖甲藻的叶绿素荧光的测定, 进而改变RLCs的结果以及由此衍生的光合生理参数。而这些结果牵涉到两个光适应阶段: 一是RLCs测定前的不同光背景驯化所导致的光适应, 也正是光曲线所测定的光适应类型; 二是在RLC期间的光适应, 而这是RLCs技术应当避免的。因此, 如果假设成立, 为更好反映光背景下的光适应, 减小RLCs期间内部光适应是必要的。

图3 步长和光序列对NPQ动力学曲线的影响 Fig. 3 Impact of light duration and sequence on NPQ kinetic curves
3.1 NPQ的影响因素与对光曲线的影响
NPQ是底栖光合生物重要的光保护机制之一, 同时也是对光环境适应的必要途径[20]。基于NPQ的特性, 是依靠光照所造成的的类囊体质子梯度的构建来驱动叶黄素循环进行热能耗散。测定RLCs期间光化光的照射不可避免的诱导NPQ的产生, 而NPQ在序列内的强弱决定了序列内光适应程度[21]。
NPQ的强弱受到步长和光化光序列方式影响。步长的延长会导致NPQ的升高, 依照最小化序列内光适应的原则, 步长应尽可能的短暂, 但同时需要考虑其他的因素。步长为10 s会造成正反序RLCs的rETRmax和Ek的低估。在phyto-PAM参数设定优化中, rETRmax和Ek基本在30 s达到稳定, 与本文的结果基本一致[22]。此外, 在反序RLCs中使用步长10 s时, 由于前序NPQ累积和叶绿体呼吸导致NPQ的上升, 造成α的高估(图2a)。因此推荐使用步长30 s进行RLCs测定。
采用非序RLCs的方式, 每个光化光的NPQ均由独立的样品测定, 可获得最小NPQ强度和无序列内光适应, 较为真实的反映光驯化下的光适应。因此可将其结果作为标准对正反序RLCs的结果进行比较。正序RLCs的NPQ由于连续光化光的刺激, 上升速度远高于非序RLCs。在非序RLCs已经达到光饱和或光抑制光强时, 正序RLCs由于已累积较高NPQ值, 使得rETR能够继续上升, 造成曲线的不饱和。反序RLCs的NPQ由于在高光强部分没有前序累积, 处于较低的数值, 比如在2 064 μmol photons/(m2·s)时为正序RLCs的1/3左右。因此曲线有光饱和或光抑制的体现, 并且在HL的30 s和60 s时几乎与非序RLCs重合。因此, 反序RLCs在控制RLCs序列内光适应和反映光背景驯化的光适应方面优于正序RLCs。
3.2 光合生理参数对光适应的反映
由光曲线获得光合作用参数已经在多种光合生物的野外和室内研究中用于反映短期或长期的光适应状态[15,23]。C. tropicalis在低于500 μmol photons/(m2·s)时的α和rETRmax基本维持不变甚至呈现上升趋势, 当光强超过500光强时, α和rETRmax均呈现下降趋势。α为光利用效率, 为光捕获系统向光反应中心PSII传递光能的比率; 而rETR和卡尔文循环有着密切的联系, rETRmax可反映卡尔文循环的最大能力[24]。Pniewski 等[25]利用RLCs技术在底栖微藻的调查中观察到长期适应低光环境的细胞在高光强下α和rETRmax均下降; 而长期接触高光环境的细胞在高光条件下rETRmax仍能够升高。比较本研究的结果, 说明了C. tropicalis在一定光强范围内能够提升卡尔文循环来加速电子的传递, 但过高的光强在1 h光驯化中超出最适范围, 甚至可能存在光抑制。在反序和非序RLCs步长30 s和60 s结果中, 当驯化光强低于500 μmol photons /(m2·s)时Ek维持不变或上升趋势, 其值在450~650 μmol photons/(m2·s)范围之间; 而超过500 μmol photons /(m2·s)之后呈现下降趋势。Ek反映细胞的最大最适光强, 这一趋势和数值均与上述的结论相一致。但在30 s和60 s正序RLCs中, Ek随驯化光强升高而升高, 且其值也远超反序和非序RLCs的结果, 存在严重的高估。
4 结论
普通正序RLCs在反映底栖甲藻C. tropicalis的光合状态时, 由于测定序列内NPQ的快速累积, 造成曲线的不饱和和光合参数Ek的高估。采用反序RLCs可减缓序列内NPQ的累积问题, 尤其在高光化光部分。曲线结果可观察到光饱和或光抑制, 反映光背景的光合参数趋势也与非序RLCs的结果基本一致。在反序RLCs中, 步长10 s时对α存在高估, 而对rETRmax和Ek的低估, 在步长30 s时各项参数基本达到稳定。在今后底栖甲藻的光合生理研究中, 如RLCs出现曲线不饱和现象, 可考虑采用30 s反序RLCs进行测定。

