大孔树脂纯化薜荔茎总黄酮的工艺研究
王晓华 韦汉燕 桂劲松 韦巧慧


【摘 要】 目的:研究AB-8大孔树脂纯化薜荔茎总黄酮的工艺条件。 方法:采用紫外分光光度法测定薜荔茎中总黄酮的含量。以静态吸附和动态解吸为考察指标,确定了薜荔茎中总黄酮纯化的最佳工艺参数。 结果: AB-8型大孔吸附树脂纯化薜荔茎总黄酮的优化工艺条件为:上样浓度为0.5g生药材/mL,样品溶液pH为7,上样量为14BV,上样速度为1mL/min,静态吸附4h。先用5BV的蒸馏水冲洗,然后用8BV 70%乙醇以1mL/min的速度洗脱大孔树脂。经AB-8树脂处理后的薜荔茎总黄酮质量分数达64.32%。 结论:优化的纯化工艺稳定可行,可以用于纯化薜荔茎中的总黄酮。
【关键词】 薜荔;总黄酮;大孔树脂;纯化
【中图分类号】R284.2 【文献标志码】 A【文章编号】1007-8517(2020)24-0034-05
Abstract:Objective To investigate the technology of purification of total flavonoids from the stem of Ficus pumila L.by AB-8 macroporous resin. Methods The content of total flavonoids in the stem of Ficus pumila L. was measured by UV , dynamic adsorption and static adsorption were took as index to optimize the technology of purification of total flavonoids. Results The optimal purification conditions were as follows: The concentration of sample was 0.5g/mL , sample pH value was 7, sample volume was 14 column volume, the flow rate was 1mL/min, statically adsorb 4h, rinse with 5 column volume distilled water for impurities, the macroporous resin was eluted with 8 column volume of 70% ethanol at a rate of 1mL/min. The purity of total flavonoids increased to 64.32%. Conclusions Optimal purification technology is stable and reliable, which is suitable for purification of the total flavonoids from the stem of Ficus pumila L.
Keywords:Ficus pumila L.; Total Flavonoids;Macroporous Resin; Purification
薜荔(Ficus pumila L.)来源于桑科榕属[1],主要分布在广西、湖南、四川等省区,其有相当膨大的成熟花托,像无花果,俗称“鬼球、鬼馒头”,最早于明朝的《本草纲目》中记载。薜荔在我国药用历史悠久,根、茎、叶和果实为药用部位,具有祛风除湿、固肾填精、活血通络、消炎解毒、抗菌、增强免疫力、抗肿瘤、抗感染、消炎镇痛、驱虫等作用[2]。近年研究结果显示,薜荔植株的各部位均含有黄酮类物质,尤以茎部含量丰富。黄酮类化合物是一类有抗氧化作用的化合物,其生理活性强,能抗动脉硬化,降低胆固醇,抗痉挛、抗辐射[3]。薜荔植株中的黄酮含量颇高,具有很高的开发利用价值,但目前缺乏对薜荔茎中黄酮类成分的研究。本实验选择AB-8大孔吸附树脂,通过静态吸附和动态解吸试验,筛选出薜荔茎总黄酮纯化的最佳工艺条件,为薜荔茎总黄酮的开发利用提供参考。
1 仪器与材料
1.1 材料 薜荔茎药材,购自广西桂林中草药批发市场,经桂林医学院王晓华副教授鉴定为桑科榕属薜荔Ficus pumila Linn的干燥茎;芦丁对照品(中国药品生物制品鉴定所);亚硝酸钠(AR 汕头市西陇化工股份有限公司,批号:130902);九水合硝酸铝(AR 汕头市西陇化工股份有限公司,批号:140304);氢氧化钠(AR 武汉宏大化学试剂厂);AB-8型大孔树脂(天津市海光化工有限公司)。
1.2 主要仪器 CP225D电子分析天平;SHZ-B水浴恒温振荡器(上海博迅实业有限公司医疗设备厂);UV-1600PC型紫外可见分光光度计(上海美谱达仪器有限公司);SHB-IIIT循环水式多用真空泵(郑州长城科工贸有限公司);RE-5203旋转蒸发仪(上海亚荣生化仪器厂)。
2 方法与结果
2.1 薜荔茎总黄酮的测定
2.1.1 对照品溶液的制备 精密称取芦丁对照品10.05mg干燥至恒重,置于50mL容量瓶中,用70%乙醇溶液溶解,稀释至刻度,摇匀,即浓度为0.201mg/mL溶液。
2.1.2 最大吸收波长的确定 准确吸取芦丁对照品溶液1.0mL,置于25mL容量瓶中,加入5%的亞硝酸钠溶液1.0mL将其振荡后静置6min,加入1.0mL的10%硝酸铝溶液,将其振荡放置6min后加入4.0mL的4%氢氧化钠溶液,最后用70%乙醇溶液调至刻度线[4],振匀放置15min显色。以不含对照品溶液的相应试剂作为空白对照,测定200~800nm 扫描波长范围内的吸光度,得到最大吸收波长为503nm。因此,以503nm作为测量波长。
2.1.3 线性关系的确定 准确吸取芦丁对照品溶液0、1.0、2.0、3.0、4.0、5.0、6.0mL,置于25mL容量瓶中,照“2.1.2”项下方法,以对照品溶液的浓度为横坐标,吸光度为纵坐标,测定503nm处的吸光度,得到标准曲线:A=10.382 C+0.0034(r=0.9993),结果如图1所示。芦丁浓度为0~0.0482mg/mL时线性关系较好。
2.1.4 薜荔茎提取液的制备 将薜荔茎药材粉碎,过80目筛。取100g薜荔茎粉末,置2000mL圆底烧瓶中,加入十倍量70%乙醇浸渍30min,装上冷凝回流装置,加热回流提取共3次,每次1h,趁热抽滤[5],最后用旋转蒸发仪减压浓缩至浓度为1g生药材/mL薜荔茎提取液,作为样品溶液。
2.1.5 薜荔茎总黄酮的含量测定 精密吸取1.0mL薜荔茎提取液,用70%乙醇稀释至10mL,摇匀,再从中吸取0.5mL放置于25mL容量瓶中。然后按“2.1.2”项下方法加入显色试剂,以70%乙醇和相应的显色剂为空白,测定503nm处的吸光度值,并根据回归方程计算总黄酮含量[6]。得薜荔茎总黄酮含量为6.25mg/mL。
2.2 大孔树脂的预处理 取适量的AB-8大孔树脂置于烧杯中,用适量95%酒精浸渍AB-8大孔树脂24h, 使其充分膨胀后采取湿法进行装柱,用95%酒精动态冲洗树脂,再用蒸馏水将树脂冲洗直到嗅不到酒精味;将5%盐酸加到柱子里浸泡树脂2h后用蒸馏水动态冲洗树脂使洗脱液的pH值呈中性, 然后将5% NaOH溶液加到柱子中浸泡树脂2h后用蒸馏水动态冲洗树脂至洗脱液呈中性;用95% 乙醇冲洗树脂使洗脱液与水混合(1∶5)至无白浊现象产生, 最后用蒸馏水冲洗树脂至洗脱液无酒精味, 留着备用[7]。
2.3 AB-8树脂吸附因素的考察
2.3.1 AB-8大孔吸附树脂静态吸附和静态解吸实验
2.3.1.1 静态吸附 准确称取经过处理的2.0g(湿质量) AB-8大孔树脂放入50mL具塞三角烧瓶中,加入30mL薜荔茎提取液(1g生药材/mL)。将塞子盖紧并于37℃水浴中振荡12h。取上清液测定吸光度。根据标准曲线方程计算总黄酮的浓度,得出静态吸附率和吸附容量。 吸附量Q=(C0-Cr)V/W。在公式中,Q是吸附量(mg·g-1树脂), C0是初始质量浓度 (mg/mL),Cr是吸附后的黄酮含量 (mg/mL),V是溶液的体积 (mL), W是树脂的质量(g)。吸附率=(吸附前黄酮含量/吸附后黄酮含量)/吸附前黄酮含量×100%。
由表1可知,树脂静态吸附量为50.03mg/g,吸附率为53.36%。
2.3.1.2 静态解吸 将已静态吸附的饱和大孔树脂用蒸馏水冲洗到洗脱液呈无色。然后加入70%乙醇30mL并在37℃水浴振荡器上摇动12h解吸。解吸后,通过吸取上清液测定吸光度。根据标准曲线方程计算总黄酮的浓度,得出静态解吸率。解吸率D(%)=(V×Cr)/(W×D)×%。式中:Q为吸附量(mg·g-树脂);Cr为解吸后溶液中黄酮的含量(mg/mL);V是溶液的体积(mL);W为树脂的质量(g)。由表2可知,静态解吸后的解吸率为84.61%。
2.3.1.3 静态吸附动力学研究 称量2.0g(湿质量)已处理过的树脂置于50mL的带塞三角瓶中,再加入30mL浓度为1g生药材/mL的薜荔茎提取液,在恒温器 37℃处晃动2h, 每1h吸收一次上清液, 并测定吸光度值。以标准曲线方程确定总黄酮浓度及吸附率, 将时间作为横向坐标, 吸附率为纵向坐标,绘制动力学曲线。从图2结果可以看出, AB-8大孔树脂对薜荔茎总黄酮的吸附是一种快速平衡型吸附,随着吸附时间的增加,吸附速率在3h内迅速下降,4h后吸附速率稳定,吸附平衡基本达到。因此,吸附时间被确定为4h。薜荔茎总黄酮的富集纯化使用AB-8大孔树脂适宜。
2.3.2 吸附条件的考察
2.3.2.1 样品液的质量浓度的影响 分别加入70%的乙醇溶液稀释已制得的薜荔茎1g生药材/mL浓度的提取液,得到质量浓度分别为0.25、0.50、0.75 g生药材/mL的样品液。称量4份已预处理过的 AB-8大孔树脂,每2.0g(湿质量)为一份于50mL的具塞三角瓶中,分别加入质量浓度为0.25、0.50、0.75g生药材/mL的样品液30mL,在恒温水浴振动筛上于37℃放置4h,然后取上清液测量吸光度,得出总黄酮的浓度与吸附率。由表3可以看出,当该样品液浓度为0.5g生药材/mL时,薜荔茎总黄酮的吸附率最佳,因此选择0.5g生药材/mL作为样品液的质量浓度。
2.3.2.2 pH值的影响 称取5份已预处理的AB-8大孔树脂,每2.0 g(湿质量)为1份,把它们分别放进一个50mL的锥形瓶里,将浓度为1g生药材/mL的提取液30mL加入瓶中, pH调节至3、4、5、6、7在37℃下振荡3h。测量吸光度,计算得出总黄酮的浓度与吸附率。从表4可以看出,当pH在3 ~ 6范围时,AB-8大孔树脂对薜荔茎总黄酮具有较好的吸附率,当吸附介质pH值为7时,吸附率明显提高, 因此,吸附剂的pH值调到7最优。
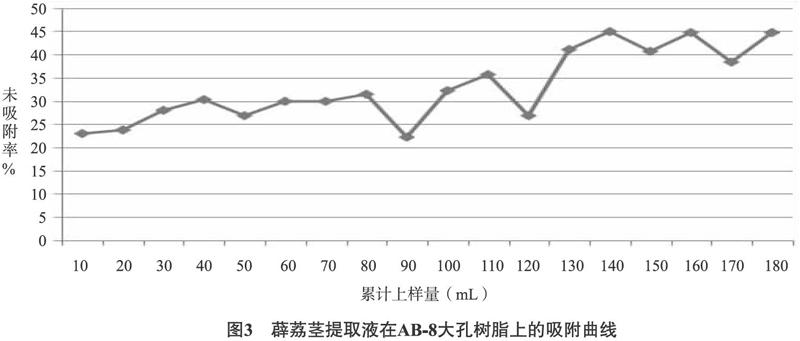
2.3.2.3 泄漏曲线的绘制与上样量的确定 准确称取5.0g经过预处理的AB-8大孔树脂,湿法装柱,取0.5g生药材/mL浓度(pH调为7)的薜荔莖提取液,样品流速为1mL/min, 每10mL收集1个样品, 收集18份样品,测定吸光度值并计算总黄酮的浓度, 将药物溶液体积作为横坐标,将未吸附率绘制在纵坐标上以确定样品上柱体积。未吸附率=流出液中成分含量/上柱前原液中流出物含量。图3结果显示,上样量达140mL时发生明显泄漏,树脂柱不能完全吸附药液中的黄酮成分,所以上样量为140mL时更合理,故确定140mL(14 BV)作为最大上样量。
2.3.3 洗脱条件的考察
2.3.3.1 洗脱剂体积分数的影响 取5份已预处理的AB-8大孔树脂,分别放到50mL的具塞三角瓶中,并加入0.5g生药材/mL(pH=7)薜荔茎提取液适量使其吸附达到饱和,再加入不同体积分数的洗脱剂30mL(50%、60%、70%、80%、90%乙醇),放置于37℃的恒溫水浴中于振荡器摇动4h,取其上清液,以吸光度值来计算解吸速率。从表5可以看出,当乙醇的体积分数小于70%时,解吸首先下降然后上升,然后缓慢上升。因此,选取的洗脱剂为70%乙醇。
2.3.3.2 确定洗脱剂的用量 准确称量5.0g的AB-8大孔树脂,湿法装柱。取140mL浓度为0.5 g生药材/mL(pH调至7)的薜荔茎提取液,流速为1mL/min上样。用5倍柱体积(5BV)的纯水冲洗树脂除去杂质,用70%乙醇以1.0mL/min的流速洗脱至洗脱液呈无色,收集10mL/份的洗脱液来测定吸光度。用于计算总黄酮含量。以总洗脱量为纵坐标 (mg) ,洗脱量 (mL)为横坐标,得到动态洗脱曲线。 总洗脱量(mg)=Cd2×Vd2。式中,流出物的总黄酮质量浓度为Cd2,洗脱剂体积为Vd2。从图4可以看出,当洗脱液为80mL(约8BV)时,茎中的总黄酮已被完全洗脱,因此选择8BV作为洗脱剂的量。
2.4 工艺验证试验 对上述所得到的最优工艺条件进行3次重复试验验证,计算大孔树脂富集纯化后薜荔中总黄酮的质量分数。经过3次验证试验,从表6可知大孔树脂富集纯化后的薜荔茎总黄酮的质量分数分别为65.04%、63.56%、64.37%,平均质量分数是64.32%,其结果表明,AB-8大孔树脂对薜荔茎总黄酮的富集纯化过程是稳定可行的。
根据上述实验的结果,确定了薜荔茎总黄酮的纯化工艺条件是:取薜荔茎提取液(0.5g生药材/mL),药液 pH=7,上样量14 BV,以1mL/mL的速度通过 AB-8大孔吸附树脂柱,静置4h,再用5 BV的蒸馏水来冲洗水溶性杂质,用8BV 70%乙醇以1mL/min的速度洗脱大孔树脂,将洗脱液减压浓缩。回收溶剂,烘干并干燥,得样品。
3 讨论
AB-8型大孔吸附树脂是一种具有极大比表面积、合适孔径的球形弱极性聚合物吸附树脂,它可通过表面吸附、氢键等作用于黄酮类化合物,是黄酮类化合物的优良吸附剂。本实验从静态吸附和动态解吸两个方面对AB-8大孔吸附树脂分离纯化薜荔茎总黄酮的工艺条件进行了研究。结果表明: 样品液的浓度、pH值、样品体积、静态吸附时间、乙醇体积分数、洗脱剂用量对薜荔茎总黄酮的吸附量和洗脱率影响较大。当乙醇的浓度小于70%时,解吸率呈先下降后上升再缓慢增长趋势。从实验结果可以看出,可选择70% ~ 90% 的乙醇体积分数来洗脱。由于考虑到实验室的经济效益方面,本实验以70%乙醇作为洗脱液浓度。实验结果显示,50.03mg/g为AB-8型大孔吸附树脂对薜荔茎总黄酮静态的吸附量,而84.61%是解吸附率,呈现出其具备较好的分离纯化能力。最优的吸附工艺条件是:取薜荔茎提取液(0.5 g生药材/mL),药液 pH=7,上样量14BV,以1mL/mL的速度通过 AB-8大孔吸附树脂柱,静置4h,再用5BV蒸馏水来冲洗水溶性杂质,用8BV 70%乙醇以1mL/min的速度洗脱大孔树脂,其洗脱液用旋转蒸发仪进行减压浓缩回收乙醇,干燥后得到红褐色膏状物。该工艺简单易操作,无污染,树脂可再生,生产效率高,具有一定的推广应用价值。
参考文献
[1]张恩景,孟军华,曾庆源.薜荔化学成分与药理活性研究进展[J].中国药师,2017,20(7): 1293-1295.
[2]吴文珊,纪小苹,王扬飞,等.薜荔叶及花序托中总黄酮的提取工艺[J].植物资源与环境学报,2000,9(2): 55-56.
[3]梁惠珍,门九章,李霞,等.芪元颗粒中总黄酮的提取纯化工艺研究[J]. 中药新药与临床药理,2016,27(1):130-134.
[4]刘爽,江蔚新,吴斌.黄蜀葵化学成分及药理活性研究进展[J].中国现代中药,2010,12(8): 5-9.
[5]黄爱华.积实中黄酮提取与纯化工艺研究[D].广州:广州中医药大学,2008.
[6]陈明珠,陈静,黄幼霞,等.AB-8型大孔吸附树脂分离纯化绿萼梅总黄酮[J].海峡药学, 2017,29(2):38-41.
[7]粟敏,汤婷,唐玮蔚,等.大孔树脂富集纯化黄蜀葵花总黄酮的工艺研究[J].中药材,2017, 40(6):1402-1405.
(收稿日期:2020-07-05 编辑:程鹏飞)

