冷却速率对酱卤肉制品中产气荚膜梭菌芽孢萌发的影响
马晓蕾 赵莉君 魏青英 朱瑶迪 赵改名 李苗云


摘 要:以烧鸡和酱牛肉为介质,研究不同冷却速率对酱卤肉制品中产气荚膜梭菌(Clostridium perfringens)芽孢生长特性的影响。结果表明:在不同的冷却速率下,总冷却时间4 h时,冷却前后C. perfringens的生长量小于1 (lg(CFU/g));降低冷却速率,C. perfringens芽孢会大量萌发、生长繁殖;总冷却时间为7、8、10、12、14 h时,烧鸡中C. perfringens的增长量分别为1.022、2.397、3.539、4.404、4.917 (lg(CFU/g)),酱牛肉中增长量分别为1.280、2.931、4.195、4.901、5.036 (lg(CFU/g)),均大于1 (lg(CFU/g))。因此对于熟制的酱卤肉制品应控制在4 h内快速冷却,最多不应超过7 h,且冷却前后C. perfringens的相对生长量控制在1 (lg(CFU/g))内,以提高肉类产品的食用安全性。
關键词:酱卤肉制品;产气荚膜梭菌;芽孢萌发;冷却速率;控制
Abstract: In this study, the effects of different cooling rates on the growth characteristics of Clostridium perfringens in roast chicken and sauced beef as representatives of soy sauce and pot-roast meat products were investigated. The results showed that the count of C. perfringens after cooling for 4 h at all rates tested increased by less than 1 (lg (CFU/g)). At lower cooling rate, C. perfringens spores germinated, grew and multiplied in larger numbers. When the total cooling time was 7, 8, 10, 12, and 14 h, the count of C. perfringens in roast chicken and sauced beef increased by 1.022 and 1.280 (lg (CFU/g)), 2.397 and 2.931 (lg (CFU/g)), 3.539 and 4.195 (lg (CFU/g)), 4.404 and 4.901 (lg (CFU/g)), 4.917 and 5.036 (lg (CFU/g)), respectively. Therefore, the cooling time should be controlled within 4 h and should not exceed 7 h at most, and the increase in the count of C. perfringens during cooling should be controlled within 1 (lg (CFU/g)) to improve the product safety. Keywords: sauce and pot-roast meat products; Clostridium perfringens; spore germination; cooling rate; control
DOI:10.7506/rlyj1001-8123-20200914-223
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2020)11-0009-05
产气荚膜梭菌(Clostridium perfringens)为革兰氏阳性厌氧芽胞菌,在环境胁迫(低温、干燥或营养缺乏等)下形成芽孢,其芽孢对高温、高压、强酸及强碱等环境均具有极强的抗逆性,很难杀灭[1-2]。在环境适宜时,C. perfringens芽孢能够萌发、生长并产生毒素[3-5],是引起食源性胃肠炎最常见的病原菌之一[6-7],会导致腹泻、腹痛等食源性疾病[8-9]。据美国疾病控制和预防中心估计,美国平均每年有约10 万例胃肠道疾病由C. perfringens引起,并将其列为第三常见食源性疾病致病菌[10]。
肉制品烹饪后不恰当的冷却工艺[11-12]和不合适的贮存温度[13-15]是导致C. perfringens大量生长的主要原因。提高热处理温度不但不能杀灭高热抗性芽孢,反而能激活残存芽孢[16-17],在后续冷却过程中可使芽孢萌发、生长并产生毒素[18-20],对食品安全和公众健康造成严重威胁。因此,热处理后的肉制品在冷却过程促使C. perfringens芽孢萌发并产生毒素,由此引发的食品安全问题不容忽视。
为了保障公众健康,美国农业部食品安全检验局对西式肉制品的冷却工艺制定了严格的标准[21]。如果食品加工者未按标准冷却产品,则必须提供验证措施,以证明该产品在冷却前后的C. perfringens相对生长量不超过1 (lg(CFU/g))[22],若冷却不当,微生物即会大量繁殖。食用含菌量达5 (lg(CFU/g))以上的受污染食品时可能会引起食物中毒[23-24]。Jaloustre等[25]在动态加热条件下,对牛肉酱产品中C. perfringens芽孢的灭活进行研究,并提出考虑潜在变异源的控制措施,在不改变产品味道的基础上,先提高温度刺激芽孢,使芽孢萌发生长,后灭菌处理,杀死营养细胞。我国传统的酱卤肉制品香气浓郁、肥而不腻,但是产品微生物污染严重[26]。王小慧等[27]调研发现,在河南省郑州市熟鸡肉市场中C. perfringens的污染率为17.3%,其中烧鸡的污染率为12.7%,且C. perfringens菌落数达5.2 (lg(CFU/g))。传统酱卤肉制品卤煮后基本处于无菌状态,但是后续的冷却过程是芽孢萌发和生长的关键,如何调控冷却降温程序,控制酱卤肉制品中C. perfringens的生长是目前面临的重要问题。
因此,本研究以我国传统酱卤肉制品的典型代表烧鸡和酱牛肉为介质,研究不同冷却降温程序对烧鸡和酱牛肉中C. perfringens芽孢萌发和生长的影响,为有效控制C. perfringens芽孢生长、规范酱卤肉制品的生产加工规程、保障产品安全提供科学依据。
1 材料与方法
1.1 材料与试剂
菌株:C. perfringens由河南农业大学食品科学技术学院从真空胀袋的盐焗鸡中分离并鉴定得到,且经过国标法鉴定、VITEK鉴定及分子测序鉴定;菌株采用-80 ℃磁珠保存。
烧鸡:购于河南省郑州市某烧鸡品牌店,选取当日卤制的新鲜烧鸡样品(从出锅到采样时间控制在12 h以内);酱牛肉:当日卤制的新鲜酱牛肉,购于河南省郑州市某超市;购买后立即运回实验室,在无菌操作台中处理。
液体硫乙醇酸盐(fluid thioglycollate,FTG)培養基、庖肉培养基、产芽孢培养基 北京陆桥技术股份有限公司;胰胨-亚硫酸盐-环丝氨酸琼脂基础(tryptose sulfite cycloserine agar base,TSC)培养基、0.1 g/100 mL无菌蛋白胨水溶液 青岛高科技工业园海博生物技术有限公司;一次性无菌培养皿 江苏省泰州市利康医疗器具有限公司。
1.2 仪器与设备
HVE-50高压灭菌锅 日本Hirayama公司;AW200SG厌氧工作站 英国Electrotek公司;DZ-260PD真空包装机 温州市大江真空包装机械有限公司;ALLEGRA-64A高速冷冻离心机 美国Beckman Coulter公司;Easy Mix均质机 法国AES公司;MIR-254低温培养箱 日本Sanyo公司;HH-501数显超级恒温水浴 金坛市杰瑞尔电器有限公司;SW-CJ-2F洁净工作台 苏州安泰空气技术有限公司。
1.3 方法
1.3.1 芽孢悬浮液的制备
无菌条件下,将冷冻保存的菌株在TSC培养基上37 ℃活化2 次。挑取活化后的TSC平板上典型的黑色单一菌落接种到10 mL庖肉培养基中,37 ℃厌氧培养48 h。按照Juneja等[28]的方法制备芽孢:吸取0.1 mL庖肉培养基样液接种到10 mL新制备的FTG培养基中,75 ℃热激20 min,并在37 ℃条件下厌氧培养18 h;取该培养液1 mL接种到9 mL FTG培养基中,37 ℃厌氧培养4 h;将0.1 mL培养液转移到10 mL产芽孢培养基中,37 ℃培养24 h,并进行芽孢染色,显微镜观察芽孢的形态和数量。当芽孢数量达到95%时收集芽孢。将所得的芽孢悬浮液在4 ℃、7 000×g条件下离心20 min收集芽孢,并用无菌水洗涤2 次,悬浮保存在0.1 g/100 mL无菌蛋白胨水溶液中(约107 CFU/mL),备用。
1.3.2 样品处理
取新鲜的烧鸡(水分活度(water activity,aw)0.987 3、pH 6.34、水分含量61.04%、盐含量1.59%)和酱牛肉(aw 0.989 6、pH 6.12、水分含量66.4%、盐含量1.74%),无菌条件下将鸡肉去骨,酱牛肉去牛筋,然后处理成大小均匀、约1 cm见方的肉块,在绞肉机中搅碎,蒸锅中蒸汽灭菌15 min,待自然冷却后分装。每袋称取25 g肉样并进行真空包装(抽真空时间18 s,相对真空度-0.1 MPa),置于-25 ℃贮藏。使用前在4 ℃解冻。
将芽孢悬浮液稀释至3~4 (lg(CFU/mL)),吸取2.5 mL接种到25 g肉样中,手动混匀,并将样品压平(约1 mm厚),以确保受热均匀,采用双层袋真空包装,袋中间添加除氧剂。将接种悬浮液的样品放置在水浴锅中75 ℃热激20 min后在冰上迅速冷却至55 ℃。
1.3.3 冷却降温模式
55 ℃是芽孢的萌发温度,27 ℃是大多数食源性病原菌快速增长至缓慢增长的过渡温度[29],故冷却程序分为两段式,即55~27 ℃和27~4 ℃。利用可编程精密培养箱,在55 ℃维持5 min,然后进入冷却降温模式。共设计6 个降温模式,分别为降温模式1~6,总降温时间分别为4、7、8、10、12、14 h。定期(每隔1 h)取出样品测定C. perfringens菌落数,同时记录培养箱中的温度变化。
1.3.4 菌落计数
冷却降温模式下,每隔1 h将样品从培养箱中取出,在冰水中迅速冷却,无菌条件下打开样品袋(25 g/袋),添加225 mL 0.1 g/100 mL无菌蛋白胨水,在Easy Mix均质机上均质120 s。将混合液用0.1 g/100 mL无菌蛋白胨水稀释,二者体积比1∶10,制备10-2~10-6系列稀释液,吸取稀释后的菌液0.1 mL至新制备的TSC培养基上,待凝固后再次均匀覆盖上TSC培养基,正置于培养箱中,37 ℃厌氧培养24 h,记录典型菌落数。各个冷却降温程序在每个时间点测定3 个平行样。
1.4 数据处理
采用SPSS 16.0软件中的单因素方差分析和独立样本t检验比较数据差异性,用Origin 8.0软件制图。
2 结果与分析
2.1 烧鸡冷却过程中C. perfringens的生长情况
采用两段式冷却,烧鸡和酱牛肉分别在4、7、8、10、12、14 h内从55 ℃降温至4 ℃,降温模式如图1所示。
由表1可知,烧鸡冷却时间较短时,C. perfringens的总体变化趋势较小。在冷却初期,C. perfringens芽孢萌发生长缓慢,生长量变化不大,随后C. perfringens芽孢快速萌发并出现一定增长。降温模式1、2在第1阶段(55~27 ℃)冷却过程中C. perfringens的相对生长量差异不显著,降温模式3、4、5、6相对生长量差异显著,表明第1阶段的冷却时间对C. perfringens芽孢萌发生长影响显著。对冷却前后烧鸡中C. perfringens的相对生长量进行比较发现,不同降温模式下,C. perfringens相对生长量差异显著,表明不同冷却时间对C. perfringens芽孢萌发生长的影响显著。
用独立样本t检验比较冷却前后烧鸡中C. perfringens菌落数差异。由表2可知,不同降温模式下,冷却前C. perfringens的菌落数之间差异不显著,同一降温模式下,冷却前后菌落数差异极显著(P<0.01)。降温模式1、2在冷却过程中C. perfringens芽孢萌发数量不超过5 (lg(CFU/g)),国际认可的食用C. perfringens含菌量达到5 (lg(CFU/g))的食物时可致病[23-24],因此,结合企业实际生产,采用降温模式1快速冷却对控制烧鸡中C. perfringens生长是有效的。
2.2 酱牛肉冷却过程中C. perfringens的生长情况
由表3可知,降温模式1、2在第1阶段(55~27 ℃)降温时间相同(图1),C. perfringens的相对生长量差异不显著,其他降温模式对C. perfringens相对生长量影响显著,表明第1阶段的冷却时间对C. perfringens芽孢萌发生长影响显著。从55 ℃降温至4 ℃,降温模式5、6时,C. perfringens的相对生长量差异不显著,其他降温模式间差异显著,表明不同降温模式对C. perfringens芽孢萌发生长影响显著。从55 ℃降温至4 ℃,采用降温模式1(总冷却时间4 h)时,C. perfringens相对生长量为0.601 (lg(CFU/g)),采用降温模式2时C. perfringens相对生长量为1.208 (lg(CFU/g)),C. perfringens相对生长量差异显著,表明不同降温模式对C. perfringens芽孢萌发生长的影响显著。
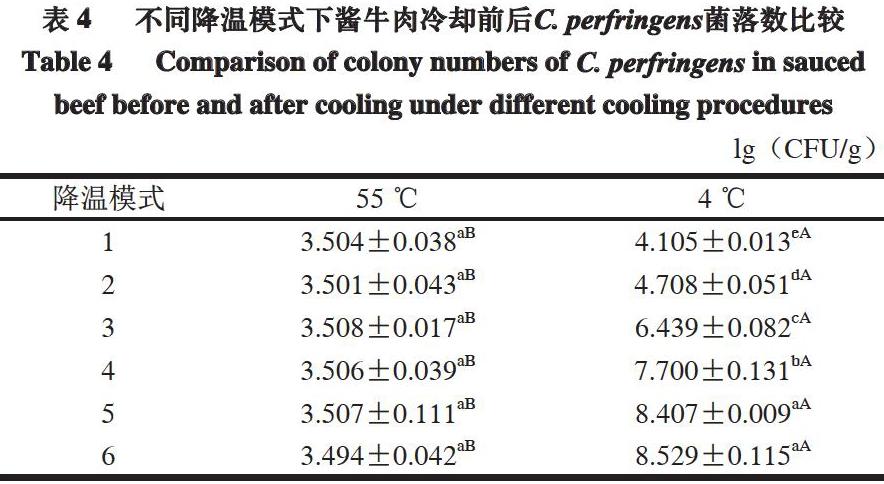
由表4可知,不同降温模式下,冷却前C. perfringens的菌落数间差异不显著,同一降温模式下,冷却前后菌落数差异极显著(P<0.01),表明降温模式對酱牛肉中C. perfringens的生长有显著影响。降温模式1、2在冷却过程中C. perfringens的数量不超过5 (lg(CFU/g))。结合企业实际生产,采用降温模式1快速冷却对控制酱牛肉中C. perfringens生长是有效的。
2.3 不同介质中C. perfringens冷却降温过程中相对生长量的比较
由表5可知,降温模式1、2下,烧鸡和酱牛肉中C. perfringens相对生长量差异显著(P<0.05),降温模式3、4、5下,差异极显著(P<0.01),表明C. perfringens的生长与介质有关。由此得出,降低冷却速率(除模式6),烧鸡和酱牛肉中C. perfringens相对生长量差异变大,这可能与2 种肉制品的自身特性有关。
3 讨 论
6 个降温模式中,烧鸡和酱牛肉的冷却时间为4 h(降温模式1)时,冷却前后C. perfringens的相对生长量小于1 (lg(CFU/g));降低冷却速率,C. perfringens快速增长,相对生长量大于1 (lg(CFU/g));在整个冷却过程中,降温模式2下冷却过程中C. perfringens数量可能超过致病限值,因此,烧鸡和酱牛肉的冷却时间不应超过7 h;冷却时间4 h(降温模式1)时,冷却前后C. perfringens的相对生长量小于1 (lg(CFU/g)),因此采用降温模式1快速冷却对控制烧鸡和酱牛肉中C. perfringens的生长是安全有效的。
Juneja等[28]将约3 (lg(CFU/g))C. perfringens芽孢接种到猪肉中,在12 h内从54.4 ℃指数降温到7.2 ℃,结果发现,C. perfringens数量增加3.43 (lg(CFU/g))。本研究中烧鸡和酱牛肉在12 h内从55 ℃降温至4 ℃,C. perfringens相对生长量分别为4.404、4.901 (lg(CFU/g))。Kalinowski等[30]研究冷却对未腌制和腌制火鸡中C. perfringens的生长和存活的影响,结果表明,未腌制的熟火鸡在6 h内从48.9 ℃冷却到12.8 ℃时,菌落数增加2.44 (lg(CFU/g)),腌制的熟火鸡在冷却时间大于6 h时,C. perfringens呈指数型增长,经24 h循环冷却后C. perfringens相对生长量为3.07 (lg(CFU/g))。与本研究结果相似,烧鸡和酱牛肉在冷却时间大于6 h时,C. perfringens相对生长量大于1 (lg(CFU/g))。因此在4 h内快速冷却对控制熟肉制品中C. perfringens的生长是安全有效的。
4 结 论
综合本研究结果和企业实际生产情况,对于酱卤肉制品的冷却降温来说,应确保熟制后4 h内快速冷却,冷却时间不应超过7 h,且冷却前后的C. perfringens相对生长量应控制在1 (lg(CFU/g))内。
参考文献:
[1] RYAN K, RAY C. Sherris medical microbiology[M]. 5th ed. New York: McGraw Hill, 2010: 520-521.
[2] DOYLE M P, BUCHANAN R L. Food microbiology: fundamentals and frontiers[M]. 4th ed. Washington DC: ASM Press, 2013. DOI:10.1128/9781555815912.ch33.
[3] HIGGINS D, DWORKIN J. Recent progress in Bacillus subtilis sporulation[J]. FEMS Microbiology Reviews, 2012, 36(1): 131-148. DOI:10.1111/j.1574-6976.2011.00310.x.
[4] 梁栋, 陈芳, 胡小松. 芽孢萌发研究进展[J]. 中国食品学报, 2018, 18(6): 221-228. DOI:10.16429/j.1009-7848.2018.06.029.
[5] LI Jihong, FREEDMAN J C, EVANS D R, et al. CodY promotes sporulation and enterotoxin production by Clostridium perfringens type A strain SM101[J]. Infection and Immunity, 2017, 85(3): e00855-16. DOI:10.1128/IAI.00855-16.
[6] TALUKDAR P K, UDOMPIJITKUL P, HOSSAIN A, et al. Inactivation strategies for Clostridium perfringens spores and vegetative cells[J]. Applied and Environmental Microbiology, 2017, 83(1): e02731-16. DOI:10.1128/AEM.02731-16.
[7] YONOGI S, MATSUDA S, KAWAI T, et al. BEC, a novel enterotoxin of Clostridium perfringens found in human clinical isolates from acute gastroenteritis outbreaks[J]. Infection and Immunity, 2014, 82(6): 2390-2399. DOI:10.1128/IAI.01759-14.
[8] 張玲. 产气荚膜梭菌微生物学质控考核分析[J]. 中国城乡企业卫生, 2020(1): 98-100.
[9] 吴阳博, 王超, 牛彦麟, 等. 2016年北京市食源性疾病暴发事件流行病学特征分析[J]. 中国预防医学杂志, 2018, 19(8): 561-563. DOI:10.16506/j.1009-6639.2018.08.001.
[10] GRASS J E, GOULD L H, MAHON B E. Epidemiology of foodborne disease outbreaks caused by Clostridium perfringens, United States, 1998-2010[J]. Foodborne Pathogens and Disease, 2013, 10(2): 131-136. DOI:10.1089/fpd.2012.1316.
[11] WILLARDSEN R R, BUSTA F F, ALLEN C E, et al. Growth and survival of Clostridium perfringens during constantly rising temperatures[J]. Journal of Food Science, 2010, 43(2): 470-475. DOI:10.1111/j.1365-2621.1978.tb02333.x.
[12] 张爽, 贾巧玲, 李颖, 等. 北京市顺义区2 起产气荚膜梭菌食物中毒病原学分析[J]. 中国食品卫生杂志, 2020(4): 456-460. DOI:10.13590/j.cjfh.2020..04.020.
[13] NIETO-LOZANO J C, REGUERA-USEROS J. The effect of the pediocin PA-1 produced by Pediococcus acidilactici against Listeria monocytogenes and Clostridium perfringens in Spanish dry-fermented sausages and frankfurters[J]. Food Control, 2010, 21(5): 679-685. DOI:10.1016/j.foodcont.2009.10.007.
[14] SHIN W S, MOON G S, PARK J H. Growth of Clostridium perfringens spores inoculated in sous-vide processed Korean traditional Galbijjim under different storage conditions[J]. Food Science and Biotechnology, 2014, 23(2): 505-509. DOI:10.1007/s10068-014-0069-5.
[15] XIAO Y H, WAGENDORP A, ABEE T, et al. Differential outgrowth potential of Clostridium perfringens food-borne isolates with various cpe-genotypes in vacuum-packed ground beef during storage at 12 ℃[J]. International Journal of Food Microbiology, 2015, 194: 40-45. DOI:10.1016/j.ijfoodmicro.2014.11.008.
[16] STRINGER S C, WEBB M D, PECK M W. Contrasting effects of heat treatment and incubation temperature on germination and outgrowth of individual spores of nonproteolytic Clostridium botulinum bacteria[J]. Applied and Environmental Microbiology, 2009, 75(9): 2712-2719. DOI:10.1128/AEM.02572-08.
[17] LIN L, CAROL V M, REDONDO M, et al. Inhibition of Clostridium perfringens spore germination and outgrowth by lemon juice and vinegar product in reduced NaCl roast beef[J]. Journal of Food Science, 2012, 77(11): 598-603. DOI:10.1111/j.1750-3841.2012.02922.x.
[18] BLACKBURN C W, MCCLURE P J. Foodborne pathogens, hazards, risks analysis and control[M]. Abington: Woodhead Publishing Ltd., 2002: 416-435. DOI:10.1016/S0168-1605(02)00487-7.
[19] 王瑩莹. 产气荚膜梭菌全菌蛋白免疫学分析[C]//中国畜牧兽医学会兽医病理学分会第21次学术研讨会暨中国病理生理学会动物病理生理专业委员会第20次学术研讨会论文集. 北京: 中国畜牧兽医学会兽医病理学分会, 2015: 173.
[20] United States Department of Agriculture, Food Safety Inspection Service. Performance standards for the production of certain meat and poultry products[S]. United States: Federal Register, 1999: 732-749.
[21] United States Department of Agriculture, Food Safety Inspection Service. Lethality, stabilization and multiple hurdles[J]. Inspection Methods, 2016, 34: 1-39.
[22] OSTERBAUER K J, KING A M, SEMAN D L, et al. Effects of nitrite and erythorbate on Clostridium perfringens growth during extended cooling of cured ham[J]. Journal of Food Protection, 2017, 80(10): 1697-1704. DOI:10.4315/0362-028X.JFP-17-096.
[23] 郭玉梅, 秦丽云, 徐保红, 等. 中毒食品中首次检出产气荚膜梭菌的检测报告[J]. 中国卫生检验杂志, 2010, 20(3): 669-670.
[24] 李红新, 卢迎瑞, 张爽, 等. 北京市顺义区87 名健康人中产气荚膜梭菌携带特征研究[J]. 中国食品卫生杂志, 2019(1): 13-16. DOI:10.13590/j.cjfh.2019.01.004.
[25] JALOUSTRE S, GUILLIER L, MORELLI E, et al. Modeling of Clostridium perfringens vegetative cell inactivation in beef-in-sauce products: a meta-analysis using mixed linear models[J]. International Journal of Food Microbiology, 2012, 154(1): 44-51. DOI:10.1016/j.ijfoodmicro.2011.12.013.
[26] 王捷. 从变质肉罐头中检出产气荚膜梭菌[J]. 应用预防医学, 2001, 7(2): 125. DOI:10.3969/j.issn.1673-758X.2001.02.030.
[27] 王小慧, 魏法山, 赵莉君, 等. 郑州市熟肉制品中产气荚膜梭菌污染状况调查[J]. 中国食品卫生杂志, 2017, 29(2): 194-197. DOI:10.13590/j.cjfh.2017.02.017.
[28] JUNEJA V K, CALL J E, MILLER A J. Evaluation of methylxanthines and related compounds to enhance Clostridium perfringens sporulation using a modified Duncan and Strong medium[J]. Journal of Rapid Methods and Automation in Microbiology, 1993, 2(3): 203-218. DOI:10.1111/j.1745-4581.1993.tb00290.x.
[29] ANDO Y, TSUZUKI T, SUNAGAWA H, et al. Heat resistance, spore germination, and enterotoxigenicity of Clostridium perfringens[J]. Microbiology and Immunology, 2013, 29(4): 317-326. DOI:10.1111/j.1348-0421.1985.tb00830.x.
[30] KALINOWSKI R M, TOMPKIN R B, BODNARUK P W, et al. Impact of cooking, cooling, and subsequent refrigeration on the growth or survival of Clostridium perfringens in cooked meat and poultry products[J]. Journal of Food Protection, 2003, 66(7): 1227-1232. DOI:10.4315/0362-028X-66.7.1227.

