肺部立体定向放疗对外周血淋巴细胞的影响
郑州大学附属肿瘤医院放疗科,河南 郑州 450000
如果说免疫治疗是近几年肿瘤治疗领域的一颗新星,那么立体定向放疗(stereotactic body radiotherapy,SBRT)已成为放疗领域的一把利刃,对肿瘤予以高剂量、快速、精确、无创的照射,已是早期肺癌放射治疗的趋势,是有手术禁忌的早期肺癌患者的首选治疗方式。2016年张玉蛟教授团队首创免疫治疗联合立体定向消融放疗概念(immunotherapy and stereotactic ablative radiotherapy,ISABR),将这两种治疗方案系统地连接起来。肿瘤免疫主要是通过调动宿主的天然防御机制或给予天然产生的靶向性物质来获得抗肿瘤的效应[1],而肿瘤细胞主要通过抑制T细胞的激活来逃逸机体的免疫杀伤。目前研究显示放疗对免疫效应是把双刃剑,一方面,辐射诱导的免疫原性细胞死亡可促使肿瘤相关抗原的递呈和抗肿瘤T细胞的活化,促进免疫反应;另一方面,淋巴细胞对辐射比较敏感,骨髓、淋巴组织或血液循环受到辐射后会导致淋巴细胞显著减少,降低免疫检查点抑制剂依赖T淋巴细胞来执行免疫治疗功能。目前体外研究显示,SBRT中不同分割剂量及次数,对淋巴细胞的影响不同,但具体临床实践中相关数据较少。本研究主要通过回顾性分析肺部SBRT前后,不同分割剂量、分割次数及总剂量等参数,对外周血淋巴细胞计数的影响,间接分析SBRT对免疫效应的抑制或激活效应。
1 资料和方法
1.1 一般临床资料
回顾性分析2016年1月—2018年6月在郑州大学附属肿瘤医院接受肺部SBRT的64例患者的相关临床资料。患者年龄为30~84岁(中位数66岁),肺癌原发者44例,肺部转移者20例,肿瘤直径1.1~4.2 cm(中位数2.5 cm)。放疗前后3个月内无化疗,具体资料见表1。
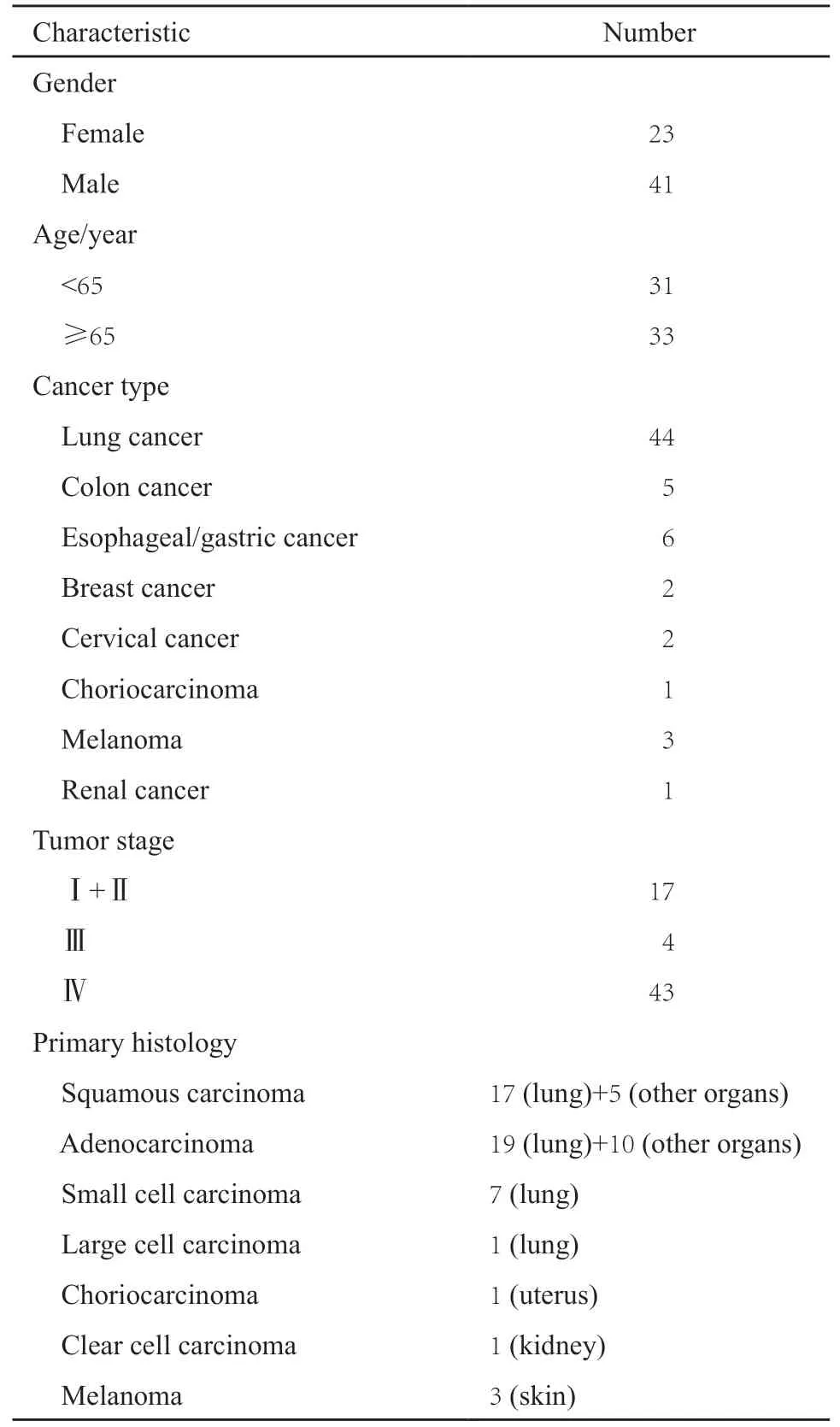
表1 64例患者的基本临床特征Tab.1 Basic clinical characteristics of 64 patients(n)
1.2 治疗方法及数据的采集
64例患者均采用SBRT,使用3 mm层厚的增强CT对患者定位,并在Multiplan TPS系统下勾画靶区,SBRT的剂量分布:周围型48 Gy/4次(20例)、40 Gy/4次(2例)、50 Gy/5次(18例)、40 Gy/5次(2例)、55 Gy/5次(3例)、48 Gy/6次(2例)、60 Gy/8次(5例)、40 Gy/8次(1例)、50 Gy/10次(5例)、55 Gy/11次(2例)、65 Gy/13次(4例),计划靶体积(planning target volume,PTV)的95%受到与处方剂量相同的照射,大体肿瘤体积(gross tumor volume,GTV)的100%体积受到与处方剂量相同的照射。分别记录SBRT治疗前1周内、治疗后1周、治疗后1个月、治疗后3个月患者外周血中淋巴细胞计数(absolute lymphocyte count,ALC)(正常范围1.1×109~3.2×109个/L)。
1.3 统计学处理
2 结果
相比于放疗前1周内,本研究中64例肺部SBRT患者的外周血淋巴细胞计数在放疗后1周、1个月,均出现不同程度的下降(P<0.05,图1),放疗后3个月基本恢复到放疗前水平(P>0.05,图1)。在SBRT各参数分组分析中,淋巴细胞计数在放疗前和放疗后3个月各参数分组间差异无统计学意义(P>0.05);淋巴细胞计数在放疗后1周和放疗后1个月,分割次数≤5次组对比分割次数>5次组分别为:(1.68±0.63 vs 0.93±0.34,P=0.021)和(1.60±0.68 vs 0.95±0.41,P=0.004);而在单次剂量>10 Gy组对比≤10 Gy组、总剂量>50 Gy组对比≤50 Gy组、BED>100组对比BED≤100组的分析中淋巴细胞计数差异无统计学意义(P>0.05,表2)。

表2 外周血淋巴细胞计数(均数±标准差)Tab.2 Peripheral blood lymphocyte count (mean ± SD)
3 讨 论
淋巴细胞是抗肿瘤的天然免疫应答的主要效应细胞之一,目前引人瞩目的免疫检查点抑制剂(PD-1抑制剂)的作用也是由淋巴细胞介导的,免疫治疗的疗效直接取决于免疫细胞,尤其是淋巴细胞的活性和数量。放疗作为抗肿瘤治疗的重要手段之一,其对机体免疫细胞具有两面性,淋巴细胞对射线十分敏感,过量照射可破坏机体免疫,而过低的剂量又无法启动有效的抗肿瘤免疫。Brown等[2]研究显示,长疗程的常规放疗会消耗免疫效应细胞CD8+、CD4+T细胞和NK细胞,并影响免疫细胞的生存、启动和转运;而短疗程的大分割高剂量(大于5 Gy)放疗对免疫细胞的活性影响甚小。同时大分割高剂量照射可更大程度地诱导肿瘤血管内皮细胞凋亡,增加血管通透性,促使肿瘤微环境中抗肿瘤T淋巴细胞浸润增多,使缺乏淋巴细胞浸润的肿瘤对免疫抗体敏感,免疫抑制细胞减少,改善肿瘤微环境,“冷肿瘤”转变为“热肿瘤”。淋巴细胞减少可缩短肿瘤患者的生存期,放疗是免疫治疗相关的淋巴细胞减少的重要危险因素,多疗程、多部位照射和高总剂量可增加放疗相关淋巴细胞减少的风险。大分割照射对比常规放疗可更加有效地活化T细胞,带来更为显著的抗肿瘤免疫效应,但所激发的免疫效应依赖于具体的照射剂量和分割模式[3]。
近期研究显示放疗可诱导肿瘤微环境释放一系列趋化因子,促进肿瘤新抗原释放,并上调PD-1和PD-L1的表达,激活并促进细胞毒性T淋巴细胞增殖[4]。临床前小鼠实验显示,单次的消融式放疗[(15~25 Gy)×1次]可引起淋巴结引流区T细胞的激活,产生CD8+T细胞依赖的肿瘤免疫应答,促使肿瘤负荷缩小,减少肿瘤复发,并根治远处转移病灶,而这一现象在常规分割中未能体现[5-6]。同样Lugade等[7]研究显示,表达卵清蛋白(OVA)的B16-F10恶性黑色素瘤经过单次分割(15 Gy)或多次分割照射(3 Gy×5次)后都会加快抗原提呈以及T细胞在引流淋巴结区域的集聚。不同的是使用15 Gy单次照射与使用3 Gy×5次照射方案相比,浸润肿瘤的宿主免疫细胞更多。
大分割照射可以显著降低放射性淋巴细胞减少的风险和严重程度。Wild等[8]在分析胰腺癌患者接受SBRT(6.6 Gy×5次)和常规放疗(1.8 Gy×28次)对淋巴细胞计数的影响时发现,放疗后1个月71.7%的常规放疗患者出现严重淋巴细胞减少(与13.8%的大分割患者相比,ALC<500个/mm3),在放疗后2个月,46.0%的常规放疗患者仍处于显著的淋巴细胞减少状态,而大分割患者只有13.6%(P<0.007)。同样,Crocenzi等[9]在胰腺癌的研究中也发现,相比常规放疗,大分割照射可显著提高放疗后ALC及随访近1年内主要淋巴细胞亚群(CD4、CD8、CD20和CD56阳性细胞)的数量。Pike等[10]的回顾性分析也显示分割次数大于5次的放疗可增加严重淋巴细胞减少症的发生,而在联合免疫治疗前接受分割次数大于5次放疗者出现严重淋巴细胞减少症的比例更高。
本研究也发现,在放疗后1周和1个月的时间点,外周血淋巴细胞计数均出现不同程度的降低,放疗后3个月才基本恢复到放疗前水平。SBRT各参数中分割次数是影响淋巴细胞计数的重要因素,在放疗后1周和1个月后,外周血淋巴细胞计数在分割次数小于5次组显著高于大于5次组(放疗后1周:1.68±10.63 vs0.93±0.34,P=0.021;放疗后1个月:1.60±0.68 vs 0.95±0.41,P=0.004)。因此我们大胆推测在分割次数小于5次的肺部SBRT照射后所致淋巴细胞激活大于射线对淋巴细胞的消耗,但这还需后续研究进一步证实。
放疗所诱发的免疫活化时间短暂,且放疗可能破坏已存在和正在进行的细胞免疫反应,SBRT联合免疫治疗的最佳时机尚不明确,且不同作用机制的免疫疗法与SBRT联合的最佳时间点不同。Young等[11]的体外研究显示,荷瘤小鼠瘤体接受单次20 Gy的SBRT照射,并联合抗CTLA-4抗体或抗OX-40激动剂,结果显示抗CTLA-4抗体联合SBRT的最佳时机在放疗前,因为抗CTLA-4抗体能促进调节性T细胞耗竭,放疗同步或之后消耗调节性T细胞都可改善肿瘤控制;抗OX-40激动剂的最佳时机是放疗后1 d,因为高剂量照射后会出现48 h的抗原呈递窗口期。
同时不同部位的SBRT治疗对免疫细胞的影响并不相同,McGee等[12]研究显示在实体肿瘤(肺和肝脏)的SBRT中,可诱导全身免疫改变,包括总NK细胞和细胞毒性NK细胞的减少,激活Tim 3+NK细胞,记忆性CD4+和CD8+T细胞增加。非实质性部位的SBRT中并没有上述变化。
综合当前研究及本回顾性分析,在肺部SBRT治疗中,分割次数小于5次的SBRT可能更有利于减少放射线所致的 淋巴细胞减少,使放疗和免疫疗法的协同作用最大化,但这还需要更大的样本量进一步分析和证实。

