外源H2S对渗透胁迫下裸燕麦种子萌发和幼苗生长的影响
刘建新,刘瑞瑞,贾海燕,卜 婷,李 娜
(甘肃省高校陇东生物资源保护与利用省级重点实验室/陇东学院生命科学与技术学院, 甘肃 庆阳 745000)
干旱和土壤盐碱化是世界公认的两大环境问题,并成为限制农作物生长发育和产量提高的重要非生物胁迫因素。种子萌发是植物完成生活史的起始阶段,也是农业上保证播种出苗和后期生长发育的前提。裸燕麦(AvenanudaL.)为起源于中国的一种禾本科燕麦属一年生杂粮作物,其籽粒蛋白质和油脂含量高,氨基酸组成均衡[1],且富含膳食纤维β-葡聚糖及总酚、黄酮、矿物质和维生素等功能性营养成分,因而其被誉为“全价营养食品”[2],在我国内蒙古、山西、河北、陕西和甘肃等地广泛种植,播种面积仅次于小麦(Triticumaestivum)、玉米(Zeamays)和水稻(Oryzasativa)[3]。裸燕麦虽然具有较强抗旱和耐盐碱特性,但干旱和盐碱造成的渗透胁迫成为裸燕麦种植成苗率低、缺苗断垄进而影响产量的重要因素[4]。进行播前种子预处理是农业上经常采用的提高种子抗逆性的技术手段,其中浸种是一种操作简单、便于实施的有效方法[5]。因此,研究渗透胁迫下提高裸燕麦种子活力的适宜浸种剂及其使用浓度对裸燕麦生产具有重要实际意义。
硫化氢(Hydrogen sulfide, H2S)是近年来在植物体内发现的第3种气体信号分子,它参与植物生长发育和生理代谢过程调控,能够增强植物对干旱[6]、低温[7]和盐胁迫[8-10]等多种逆境的抗性。研究表明,H2S在植物种子萌发响应逆境的过程中也发挥着重要的调控作用。如外源H2S能够激活小麦β-淀粉酶活性,促进其种子萌发[11];通过增强抗氧化防御能力减轻干旱胁迫对水稻[12]和盐胁迫对苜蓿(Medicagosativa)[13]种子萌发的抑制;缓解NaCl胁迫下番茄(Lycopersiconesculentum)种子活力的下降[14];能够通过诱导抗氧化系统和渗透剂生物合成来提高高温下玉米种子的萌发和幼苗生长[15];且能激活贮藏蛋白促进绿豆(Vignaradiata)种子萌发[16];用H2S供体NaHS处理可提高小麦种子中H2S的含量,并以NaHS剂量依赖方式缓解铜胁迫对小麦种子萌发的抑制[17]等。这些研究证实,外源H2S能够促进逆境下作物种子的萌发,但不同强度渗透胁迫下外源H2S对作物种子萌发影响的研究迄今尚未见报道。本研究以裸燕麦为试验材料,以不同浓度聚乙二醇(PEG-6000)模拟渗透胁迫,研究不同浓度NaHS浸种对渗透胁迫下种子萌发和幼苗生长的影响,旨在了解外源 H2S对渗透胁迫下裸燕麦种子活力的影响效应,筛选缓解渗透胁迫适宜的NaHS浸种浓度,以期为利用H2S增强作物在种子萌发期的抗逆性提供理论依据和实践指导。
1 方 法
1.1 供试材料
试验于2019年4—7月在甘肃省高校陇东生物资源保护与利用省级重点实验室进行。供试裸燕麦品种‘定莜9号’种子2017年购自甘肃省定西市农业科学研究院。H2S供体硫氢化钠(NaHS)购自Sigma-Aldrich公司,PEG购自上海生物工程有限公司。
1.2 试验设计
采用NaHS浓度和渗透胁迫两因素试验设计。NaHS浓度共设4个水平,分别为0、0.2、1.0 mmol·L-1和5.0 mmol·L-1;渗透胁迫共设5个水平,渗透势分别为0、-0.2、-0.3、-0.4 MPa和-0.5 MPa,对应的PEG质量浓度分别为0、119、149、178 g·L-1和202 g·L-1[18]。两个因素的不同水平进行完全组合,共计20个处理。试验前,精选饱满、大小一致的裸燕麦种子,用体积分数为2%的NaClO表面消毒5 min,用蒸馏水反复冲洗后吸干表面水分,在室温下分别用浓度为0、0.2、1.0 mmol·L-1和5.0 mmol·L-1NaHS溶液在暗处浸种8 h,然后用蒸馏水洗净,将各浸种处理的种子均匀播于铺有两层滤纸的培养皿(直径12 cm)中,每皿播种100粒,分别向培养皿中加入预先配制好的上述不同质量浓度的PEG溶液10 mL模拟渗透胁迫。每个培养皿作为1个处理,每个处理重复3次。置于培养箱(LPGZ-250A,无锡莱浦仪器设置有限公司)中20℃、16 h/8 h光/暗培养,光照强度200 μmol·m-2·s-1,每天更换1次处理液。
1.3 测定指标和方法
从种子播种后每12 h观察1次,以胚根突破种皮2 mm作为发芽标准,记录种子发芽数,共观察记录7 d。第7天结束发芽试验后,从每个培养皿中随机选取代表性萌发苗10株用直尺测量胚根和胚芽长,分别计算平均长度;将每个培养皿中胚根、胚芽和籽粒剩余部分各自分开,在电热恒温干燥箱中105℃杀青30 min后70℃烘干至恒重,用电子天平分别称量干重。然后按下列公式计算种子发芽势、发芽率、发芽指数、活力指数、平均发芽时间、贮藏物质转运率。
发芽势=萌发第3天时总的种子发芽数/供试种子数×100%
发芽率=萌发第7天时种子的发芽总数/供试种子数×100%
发芽指数=∑(Gt/Dt)
式中,Gt为第t天的种子发芽数;Dt为相应发芽天数。
活力指数=发芽指数×(胚根+胚芽)干重
平均发芽时间=∑(Dn×n)/∑n
式中,Dn是发芽天数;n为相应各天新发芽的种子数,本试验最大值为58。
贮藏物质转运率=[(胚根+胚芽)干重/(胚根+胚芽+籽粒剩余部分)干重]×100%
1.4 数据统计分析
应用Microsoft Excel 2007和SPSS 20.0软件计算各指标和方差分析,并运用Duncan’s法检验差异显著性(P<0.05),其中百分数数据先用反正弦平方根转换(y=arcsin[sqrt(x/100)])后再进行分析,结果以平均值±标准误差表示。
采用隶属函数分析方法综合评价NaHS浸种对渗透胁迫下种子萌发的影响。不同处理平均发芽时间的隶属函数值计算公式为:
U(Xi)=1-(Xi-Ximin)/(Ximax-Ximin)
发芽势、发芽率、发芽指数、活力指数、贮藏物质转运率、胚根长、胚芽长和幼苗干重的隶属函数值计算公式为:
U(Xi)=(Xi-Ximin)/(Ximax-Ximin)
式中,U(Xi)表示指标Xi的隶属函数值;Ximin和Ximax分别为第i个指标的最小值和最大值。
每个指标采用客观赋权法:
Ii=Si/C0i
式中,Si为第i个指标的U(Xi),C0i是对照组第i个指标隶属函数值的平均值;每一指标按公式Wi=Ii/∑Ii计算权重;最后计算综合评价值D=[U(Xi)×Wi][19]。
2 结果与分析
2.1 PEG浓度和NaHS浓度对裸燕麦种子萌发和幼苗生长的双因素方差分析
表1表明,PEG浓度和NaHS浓度对裸燕麦种子发芽势、发芽率、发芽指数、活力指数、平均发芽时间、贮藏物质转运率、胚根长、胚芽长、幼苗干重和综合评价值D均有显著影响(P<0.05);PEG浓度和NaHS浓度的交互作用对发芽指数、活力指数、平均发芽时间和胚根长的影响显著,对发芽势、发芽率、贮藏物质转运率、胚芽长、幼苗干重和D值无显著影响。
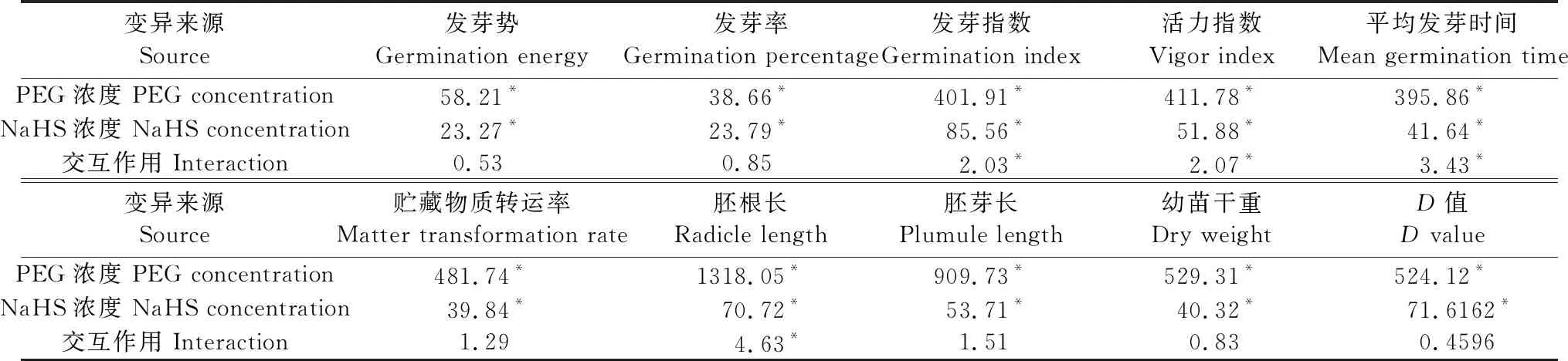
表1 PEG浓度和NaHS浓度对裸燕麦种子萌发和幼苗生长的双因素方差分析
2.2 外源H2S对PEG渗透胁迫下裸燕麦种子发芽势的影响
由表2可见,在不同NaHS浓度处理下,随着PEG浓度提高,裸燕麦种子发芽势均呈显著下降趋势。在PEG浓度为0即H2O培养条件下,与NaHS浓度为0的对照相比,0.2 mmol·L-1和5.0 mmol·L-1NaHS处理的发芽势差异不显著,1 mmol·L-1NaHS处理的发芽势显著提高;在PEG浓度为119 g·L-1时,0.2 mmol·L-1NaHS处理的发芽势与对照差异不显著,1.0 mmol·L-1NaHS处理的发芽势显著提高了5.9%,5.0 mmol·L-1NaHS处理的发芽势则显著降低了9.8%;在PEG浓度为149 g·L-1时,0.2 mmol·L-1和1.0 mmol·L-1NaHS处理的发芽势与对照的差异不显著,5.0 mmol·L-1NaHS处理的发芽势较对照降低8.3%,差异显著;在PEG浓度分别为178 g·L-1和202 g·L-1条件下,0.2 mmol·L-1、1.0 mmol·L-1和5.0 mmol·L-1NaHS处理的发芽势均与对照无显著差异。
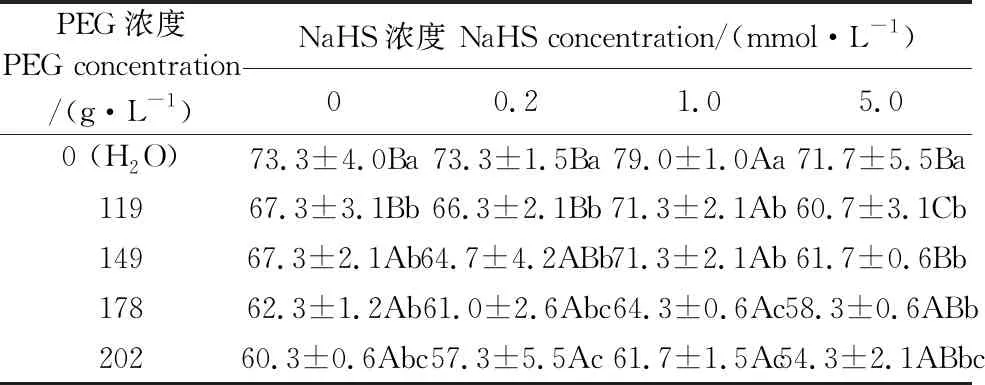
表2 NaHS浸种对PEG渗透胁迫下裸燕麦种子发芽势的影响/%
2.3 外源H2S对PEG渗透胁迫下裸燕麦种子发芽率的影响
从表3可知,随着PEG浓度升高,不同NaHS浓度浸种的裸燕麦种子发芽率均显著下降。在PEG浓度为0 g·L-1条件下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1和5.0 mmol·L-1NaHS浸种的发芽率无显著差异,1.0 mmol·L-1NaHS处理的发芽率显著提高了7.1%。在PEG浓度为119~202 g·L-1条件下,0.2 mmol·L-1和1.0 mmol·L-1NaHS浸种的发芽率变化不大,5.0 mmol·L-1NaHS浸种的发芽率显著低于0 mmol·L-1NaHS处理。

表3 NaHS浸种对PEG渗透胁迫下裸燕麦种子发芽率的影响/%
2.4 外源H2S对PEG渗透胁迫下裸燕麦种子发芽指数的影响
表4表明,在不同浓度NaHS浸种下,随着PEG浓度升高,裸燕麦种子发芽指数均呈显著下降变化趋势。在PEG浓度为0~202 g·L-1条件下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1NaHS浸种的发芽指数无显著变化;1.0 mmol·L-1NaHS浸种的发芽指数不同程度提高,其中在0~178 g·L-1PEG浓度下的发芽指数差异显著;5.0 mmol·L-1NaHS浸种的发芽指数明显降低。

表4 NaHS浸种对PEG渗透胁迫下裸燕麦种子发芽指数的影响
2.5 外源H2S对PEG渗透胁迫下裸燕麦种子活力指数的影响
随着PEG浓度升高,不同NaHS浓度浸种的裸燕麦种子活力指数均显著下降(表5)。在0~202 g·L-1PEG条件下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1NaHS浸种的活力指数差异不显著;1.0 mmol·L-1NaHS浸种的活力指数不同程度提高,其中在0~149 g·L-1PEG条件下的活力指数差异显著;5.0 mmol·L-1NaHS浸种的活力指数呈下降变化趋势,其中在0~149 g·L-1PEG条件下的下降达到显著水平。

表5 NaHS浸种对PEG渗透胁迫下裸燕麦种子活力指数的影响
2.6 外源H2S对PEG渗透胁迫下裸燕麦种子平均发芽时间的影响
由表6可见,随着PEG浓度升高,不同浓度NaHS浸种的裸燕麦种子平均发芽时间均显著提高。在PEG浓度为0~149 g·L-1时,与0 mmol·L-1NaHS浸种相比,0.2mmol·L-1和1.0 mmol·L-1NaHS浸种的平均发芽时间无显著差异,5.0 mmol·L-1NaHS浸种显著提高了平均发芽时间;在PEG浓度为178 g·L-1时,0.2 mmol·L-1NaHS浸种的平均发芽时间与0 mmol·L-1NaHS浸种的差异不显著,1.0 mmol·L-1NaHS浸种的平均发芽时间显著降低,5.0 mmol·L-1NaHS浸种的平均发芽时间显著提高;在PEG浓度为202 g·L-1时,0.2 mmol·L-1和5.0 mmol·L-1NaHS浸种的平均发芽时间与0 mmol·L-1NaHS浸种的差异不显著,1.0 mmol·L-1NaHS浸种的平均发芽时间显著降低。
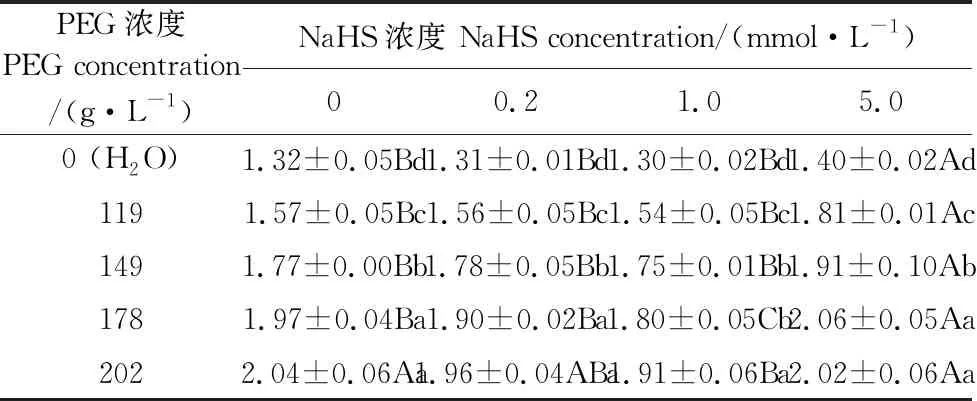
表6 NaHS浸种对PEG渗透胁迫下裸燕麦种子平均发芽时间的影响/d
2.7 外源H2S对PEG渗透胁迫下裸燕麦种子贮藏物质转运率的影响
随着PEG浓度升高,不同浓度NaHS浸种的裸燕麦种子贮藏物质转运率均显著下降(表7)。在不同PEG浓度下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1NaHS浸种的贮藏物质转运率差异不显著;1.0 mmol·L-1NaHS浸种显著提高了0、149 g·L-1和178 g·L-1PEG条件下的贮藏物质转运率,而119 g·L-1和202 g·L-1PEG条件下的贮藏物质转运率变化不大;5.0 mmol·L-1NaHS浸种显著降低了0、149 g·L-1和202 g·L-1PEG条件下的贮藏物质转运率,而119 g·L-1和178 g·L-1PEG条件下的贮藏物质转运率变化不显著。

表7 NaHS浸种对PEG渗透胁迫下裸燕麦种子贮藏物质转运率的影响/%
2.8 外源H2S对PEG渗透胁迫下裸燕麦幼苗胚根和胚芽长度的影响
随着PEG浓度升高,不同NaHS浓度浸种的裸燕麦幼苗胚根和胚芽长度基本均呈显著下降变化趋势(表8,表9)。在不同PEG浓度下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1NaHS浸种的裸燕麦幼苗胚根和胚芽长度无显著差异;1.0 mmol·L-1NaHS浸种提高了幼苗胚根和胚芽长度;5.0 mmol·L-1NaHS浸种对0、119 g·L-1和149 g·L-1PEG条件下的胚根长度及0、119 g·L-1PEG条件下的胚芽长度影响不显著,而显著降低了178 g·L-1和202 g·L-1PEG条件下的胚根长度及149 g·L-1、178 g·L-1和202 g·L-1PEG条件下的胚芽长度。
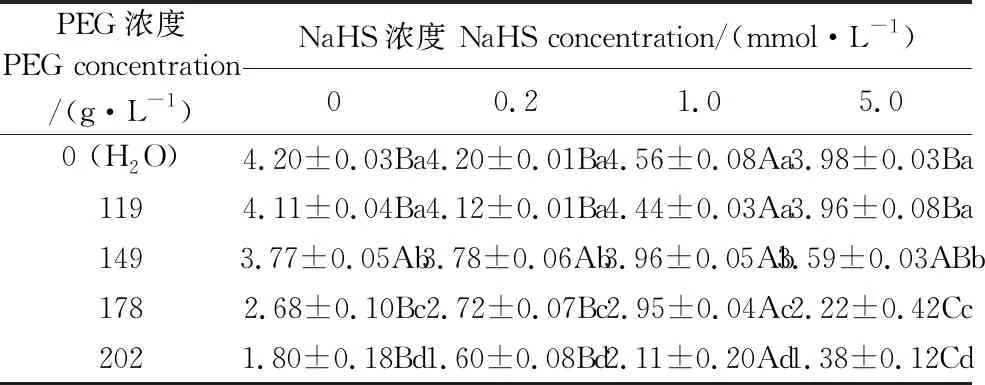
表8 NaHS浸种对PEG渗透胁迫下裸燕麦幼苗胚根长度的影响/cm

表9 NaHS浸种对PEG渗透胁迫下裸燕麦幼苗胚芽长度的影响/cm
2.9 外源H2S对PEG渗透胁迫下裸燕麦幼苗干重的影响
从表10可见,随着PEG浓度升高,不同NaHS浓度浸种的裸燕麦幼苗(胚根+胚芽)干重均呈显著下降变化趋势。在不同PEG浓度下,与0 mmol·L-1NaHS浸种相比,0.2 mmol·L-1NaHS浸种对裸燕麦幼苗干重无显著影响;1.0 mmol·L-1NaHS浸种显著提高了0 g·L-1和119 g·L-1PEG条件下的幼苗干重,但对149、178 g·L-1和202 g·L-1PEG条件下的幼苗干重无显著影响;5.0 mmol·L-1NaHS浸种总体上降低了幼苗干重,其中对0、149 g·L-1和178 g·L-1PEG条件下的幼苗干重影响显著。

表10 NaHS浸种对PEG渗透胁迫下裸燕麦幼苗干重的影响/g
2.10 外源H2S对PEG渗透胁迫下裸燕麦种子萌发综合评价值D的影响
从表11可知,随着PEG浓度升高,不同浓度NaHS浸种的D值显著下降。在不同PEG浓度下,用0.2 mmol·L-1NaHS浸种的D值与0 mmol·L-1NaHS浸种相比无显著差异;1.0 mmol·L-1NaHS浸种不同程度提高了D值,增幅分别为16.9%、17.0%、18.0%、25.9%和46.7%,其中对0、119、149 g·L-1和178 g·L-1PEG条件下D值的提升作用显著;5.0 mmol·L-1NaHS浸种显著降低了D值,降幅达10.4%~73.3%。

表11 NaHS浸种对PEG渗透胁迫下裸燕麦种子萌发综合评价值D的影响
3 讨 论
种子生理学认为,萌发是起始于吸胀、结束于胚伸出周围结构的细胞事件[20],而幼苗生长不属于种子萌发内容的种子萌发后事件[21]。种子能否成功萌发和正常成苗直接影响着作物的产量,种子萌发期也是作物生活周期中对环境最为敏感和脆弱的阶段[22]。在干旱和土壤盐碱化环境中,渗透胁迫是影响种子萌发和成苗的关键因素[4,12-14]。诸多研究表明,随着渗透胁迫增强,植物种子萌发和幼苗生长受抑程度显著增强[23-24]。发芽势、发芽率、发芽指数、平均发芽时间和活力指数等常作为评价种子发芽速度、发芽整齐度和幼苗健壮程度的指标[25]。从种子萌发到幼苗生长主要依靠种子贮藏物质提供能量和合成原料,种子贮藏物质转运率在一定程度上决定胚根(芽)的生长[26]。本试验结果表明,PEG浓度对裸燕麦种子发芽势、发芽率、发芽指数、活力指数、平均发芽时间和贮藏物质转运率的影响显著,也对裸燕麦幼苗胚根长、胚芽长和幼苗干重存在显著影响(表1)。随着PEG浓度提高,裸燕麦种子发芽势、发芽率、发芽指数、活力指数和贮藏物质转运率及幼苗胚根长、胚芽长和幼苗干重均显著下降,而平均发芽时间表现为显著增加趋势(表2-10)。这与陈文荣等[19]在高丛蓝莓(Vacciniumcorymbosum)、魏波等[23]在红花(Carthamustinctorius)和金宁等[24]在黄瓜(Cucumissativus)上的研究结果一致。由此可知,裸燕麦同其他植物一样,随着渗透胁迫强度增大,种子萌发和幼苗生长受抑程度显著增强。这可能与渗透势降低迅速使种子体内抗氧化酶活性下降[26],引起活性氧清除能力减弱,细胞膜脂过氧化损伤增强[27]有密切关系。
H2S作为新型气体信号在植物种子萌发和生长发育逆境响应中发挥着重要作用[11-17]。外施H2S可减轻干旱胁迫下水稻[12]及盐胁迫下紫花苜蓿[13]和番茄[14]种子的萌发和幼苗生长抑制。但前人的研究主要针对H2S供体浓度对单一浓度胁迫下植物种子活力的影响,而未见H2S对不同强度渗透胁迫下作物种子萌发和成苗影响的研究报道。本试验发现,外源H2S及其与PEG渗透胁迫的交互作用对裸燕麦种子萌发和幼苗生长产生了不同的影响。H2S供体NaHS浓度对裸燕麦种子发芽势、发芽率、发芽指数、活力指数、平均发芽时间、贮藏物质转运率及胚根长、胚芽长和幼苗干重影响显著;而NaHS浓度和PEG浓度的交互作用对发芽指数、活力指数、平均发芽时间和胚根长存在显著影响,对发芽势、发芽率、贮藏物质转运率、胚芽长和幼苗干重的影响不显著(表1)。本研究中,在同一PEG渗透胁迫下,用低浓度NaHS (0.2 mmol·L-1)浸种对裸燕麦种子的发芽势、发芽率、发芽指数、活力指数、平均发芽时间、贮藏物质转运率、胚根长、胚芽长和幼苗干重无显著影响(表2-10)。当用1.0 mmol·L-1NaHS浸种时,119~178 g·L-1PEG渗透胁迫下的发芽势和发芽率虽无显著改变,但0~178 g·L-1PEG渗透胁迫下的发芽指数、活力指数显著提高,并不同程度降低了平均发芽时间,提高了贮藏物质转运率,促进了幼苗生长;而202 g·L-1PEG胁迫下除胚根和胚芽显著增长及贮藏物质转运率明显下降外其余指标均无显著变化。当用5.0 mmol·L-1NaHS浸种时,同一PEG渗透胁迫下的平均发芽时间显著增加,而其余各萌发参数和幼苗生长参数均呈下降趋势。这说明适宜浓度的外源H2S浸种能够有效提高裸燕麦的种子活力,促进其在渗透胁迫下的种子萌发和幼苗生长。这可能是H2S在种子萌发过程中参与了渗透胁迫信号的转导,促使相关基因表达[28]或诱导抗氧化系统建立和渗透剂生物合成[12-15]等有关。过高浓度NaHS可能加重渗透胁迫[14]或H2S积累使细胞氧化还原平衡遭受破坏,从而造成氧化损伤[9],使种子萌发和幼苗生长受抑。这与Zhang等[29]对小麦和李永生等[30]对玉米种子萌发的研究结果类似。
不同发芽指标对渗透胁迫和H2S的响应存在差异,为综合评价NaHS浸种对渗透胁迫下裸燕麦种子萌发和幼苗生长的影响,采用隶属函数分析结果显示,PEG浓度和NaHS浓度均对综合评价D值有显著影响,但二者交互作用对D值的影响不显著(表1)。多重比较结果进一步表明:随着PEG浓度增大,不同浓度NaHS浸种裸燕麦种子的D值显著降低(表11)。在同一PEG浓度下,0.2 mmol·L-1NaHS浸种对D值的影响不显著;1.0 mmol·L-1NaHS浸种显著提高了0~178 g·L-1PEG (对应渗透势为0~-0.4 MPa)胁迫下的D值;5.0 mmol·L-1NaHS浸种则使D值降低(表11)。这说明外源H2S对渗透胁迫抑制裸燕麦种子萌发和幼苗生长的缓解作用具有剂量依赖效应,以1.0 mmol·L-1NaHS溶液浸种较为适宜。研究结果可为进一步应用H2S开发新型作物抗渗透剂提供一定参考,而H2S缓解渗透胁迫的作用机制尚需进一步探究。
4 结 论
用不同浓度的外源H2S供体NaHS浸种显著影响渗透胁迫下裸燕麦种子的活力水平,且这种影响与NaHS浓度、渗透胁迫强度及两者的交互作用有关。渗透胁迫强度越大、NaHS浓度过高(≥5.0 mmol·L-1),裸燕麦种子活力下降越明显;NaHS浓度过低(≤0.2 mmol·L-1)对渗透胁迫下裸燕麦种子活力无显著影响。用1.0 mmol·L-1NaHS浸种可显著提高0~-0.4 MPa渗透势下裸燕麦种子的活力水平,而对-0.5 MPa渗透势下裸燕麦种子活力的影响不显著。由此可见,用1. 0 mmol·L-1NaHS浸种可缓解-0.4 MPa以上渗透势对裸燕麦种子萌发和成苗造成的渗透胁迫抑制,虽不能提高发芽势和发芽率,但可提高发芽指数和活力指数,通过提高种子贮藏物质转运促进幼苗生长,并可一定程度缩短发芽时间。因此,在干旱区和盐碱地裸燕麦生产中用适宜浓度NaHS浸种可加快种子萌发和促进壮苗形成。
致谢:郭婉婷同学在试验观察和数据分析中做了大量工作,在此表示感谢。

