烟草青枯病菌噬菌体分离及其生物学特性研究
胡蓉花,余成鹏,任敏华,李小勇,刘琼光 ,4
(1.江西省吉安烟草公司,江西 吉安 343000;2.华南农业大学农学院,广东 广州 510642;3.江西省峡江烟草公司,江西 峡江 331400;4.广东省微生物信号与作物病害防控重点实验室,广东 广州 510642)
【研究意义】烟草青枯病又称“烟瘟”,是烟草生产上的毁灭性病害,在我国广东、广西、云南、湖南、江西、福建、浙江等南方烟草种植区普遍发生[1]。目前,防治烟草青枯病的主要措施包括种植抗性品种、化学药剂、合理轮作、拮抗菌剂、栽培管理等[2-5]。但在烟叶生产中,这些措施有时并不能有效地控制烟草青枯病的发生,而且化学农药和抗生素的使用会导致环境污染和病菌抗药性的产生。研究和开发烟草青枯病防控策略和防治方法的新途径显得非常重要,筛选青枯病菌噬菌体,为将来作物青枯病的防治提供噬菌体资源。【前人研究进展】作物青枯病的生物防治,受到国内外广泛关注,并有大量的文献报道。其主要利用无致病力青枯菌株、芽孢杆菌(Bacillusspp.)、假单胞菌(Pseudomonasspp.)、链霉菌(Streptomycesspp.)等细菌、某些有益真菌、植物分泌物等[4-7],但在烟叶生产中,实际应用的较少,并且防治效果不稳定。随着人们对环境和农产品安全要求的提高,青枯病的防控迫切需要一种有效和安全的方法和措施。噬菌体是侵染细菌的病毒,只要有细菌存在的地方就可能出现噬菌体的身影。尤其是作为微生物大本营的土壤,蕴藏着丰富的噬菌体资源[8]。由于噬菌体能有效地感染对其敏感的宿主(或寄主),具有高度的特异性及快速裂解宿主(或寄主)的能力,而对其他菌群不会有破坏作用,因此噬菌体疗法有望替代传统药物疗法[9],可用于动物和人体细菌疾病的治疗[10-13]。此外,利用噬菌体防治植物细菌性病害,也已受到国内外广泛关注,且有相关文献报道,例如,在国外利用噬菌体防治由Pseudomonas syringaepv.tomato引起的番茄细菌性叶斑病[14],利用噬菌体防治由Xanthomonas citrisubsp.citri引起的柑橘溃疡病[15]和由Pectobacterium carotovorasubsp.carotovora引起的马铃薯软腐病[16]以及由Ralstonia solanacearum引起的番茄青枯病[17-18]等。尽管如此,生产上利用噬菌体防治烟草青枯病尚未有成熟产品。关于使用噬菌体控制烟草青枯菌的报道仍然较少,仅有几个可以感染烟草青枯菌的噬菌体被分离鉴定的研究[19-21]。
【本研究切入点】由于青枯菌种群多样性丰富,分离和筛选适合当地青枯病防治的噬菌体,将为利用噬菌体防控烟草青枯病提供噬菌体资源。此外,明确不同温度、不同酸碱度和不同化学物质对噬菌体的影响,对于进一步开发噬菌体剂型及噬菌体施用方法和技术,具有重要的参考价值和指导意义。【拟解决的关键问题】从种植烟草的土壤环境中,通过双层平板分离,获得高效价和裂解能力强的噬菌体。
1 材料与方法
1.1 试验材料
供试培养基:三倍浓缩液培养基:牛肉膏9 g,酵母膏9 g,蛋白胨9 g,硫酸镁0.75 g,磷酸氢二钾6 g,磷酸二氢钾0.15 g,蔗糖60 g,蒸馏水1000 mL。固体培养基:牛肉膏3 g,酵母膏3 g,蛋白胨3 g,硫酸镁0.25 g,磷酸氢二钾2 g,磷酸二氢钾0.5 g,蔗糖15 g,琼脂18 g,蒸馏水1 000 mL。
半固体培养基:牛肉膏3 g,酵母膏3 g,蛋白胨3 g,硫酸镁0.25 g,磷酸氢二钾2 g,磷酸二氢钾0.5 g,蔗糖15 g,琼脂8 g,蒸馏水1 000 mL。LB液体培养基:酵母提取物5 g,氯化钠10 g,胰蛋白胨10 g,加水至1 000 mL。
宿主菌为烟草青枯菌Tb574、Tb7-1、Tb1521、Tb1553、Tb1556,菌株分离自江西省烟区各地,保存于华南农业大学植物细菌研究室。2017年5月,采集江西省吉安市烟区土壤。2017年5月~2018年12月,在华南农业大学植物细菌实验室完成噬菌体分离、纯化和生物学特性研究。
1.2 土壤噬菌体分离
称取100 g土壤于锥形瓶中,加250 mL水制成土壤悬浮液,静置30 min,取50 mL上清液,5 000 r/min离心5 min,取上清液与三倍浓缩液培养基以2∶1混合,加入烟草青枯菌(宿主菌),30℃ 180 r/min摇床培养24 h,10 000 r/min离心10 min,上清液经细菌过滤器(25 μm)过滤后,取800 μL与400 μL宿主菌混匀, 随即加入10 mL约50 ℃的半固体培养基,迅速混匀,倒入固体培养基平板上,制成双层平板,30 ℃培养24 h。
1.3 噬菌体纯化
噬菌体培养:在15 mL LB液体培养基中,加入500 μL宿主菌,接种单个噬菌斑,混匀,30 ℃180 r/min培养过夜。
双层平板制备:取噬菌体培养液10 000 r/min离心10 min,上清液用LB液体培养基进行连续10倍梯度稀释,取800 μL稀释液与400 μL宿主菌液混匀,并加入50 ℃半固体培养基,迅速混匀倒入固体培养基平板上,制成双层平板,30 ℃培养24 h。
重复上述步骤4~5次,获得纯噬菌体。
1.4 温度对噬菌体的影响
将噬菌体进行10倍梯度稀释,在30~80 ℃下,每5 ℃设置温度梯度,处理30 min,重复3次,将处理后的噬菌体稀释液制成双层平板,30 ℃培养24 h。对各双层平板噬菌斑进行计数,计算每毫升有效噬菌体数量(PFU/mL),计算公式为:PFU/mL=5/4×噬菌斑平均数×稀释倍数。
1.5 pH对噬菌体的影响
取100 μL噬菌体,分别加入pH为3、4、5、6、7、8、9、10、11、12等 不 同 pH 各 900 μL LB处理1 h,3次重复。用连续10倍梯度稀释对处理液进行稀释,制成双层平板于30 ℃培养箱培养24 h。
1.6 紫外光对噬菌体的影响
将噬菌体置于敞开玻璃皿中,用18 W紫外灯于皿上方约30 cm处直射,分别处理0、1、2、3、6、9、12、15、18、21 min,收集处理液,制成双层平板,于30 ℃培养24 h,3次重复。
1.7 乙醚、氯仿对噬菌体的影响
参照刘斌等[22]的方法并改进。取100 μL噬菌体,加入850 μL LB液体培养基,并加入50 μL乙醚制成终浓度为5 %的乙醚溶液,取100 μL上清液加900 μL LB液体培养基作为对照。在4 ℃下放置24 h,3 000 r/min离心15 min,取下层液抽打,挥发乙醚,进行10倍梯度稀释,制作双层平板,30 ℃培养24 h。3次重复。计算相对存活率:
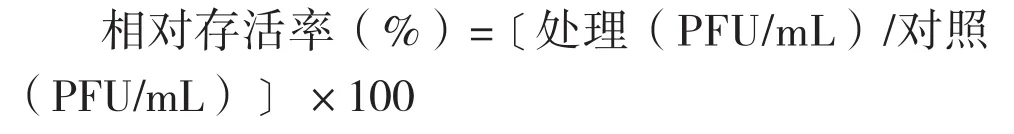
用上述同样方法测定氯仿对噬菌体的影响。
2 结果与分析
2.1 噬菌体的分离纯化
从4份来自不同地区的土壤样品中共分离到6种噬菌体,每份土壤中均可分离到至少1种噬菌体,有的土壤中还可分离到噬菌斑大小明显不同的噬菌体,分别将其编号为PTb7-1、PTb1521、PTb1553、P1Tb1556、P2Tb1556、PTb574。6种噬菌体在双层平板上的噬菌斑见图1。

图1 6个噬菌体在各自宿主菌培养平板上的噬菌斑Fig.1 Bacteriophage plaques of 6 phages in their respective host plate
2.2 温度对噬菌体的影响
各噬菌体在不同温度处理下,其有效噬菌体数量变化见表1。从表1可以看出,6个噬菌体随着温度升高其有效数量逐渐下降,各噬菌体最适温度在35 ℃左右。噬菌体PTb7-1、PTb1574 、PTb1521致死温度为 55~60 ℃,噬菌体PTb1553、P1Tb1556、P2Tb1556在55 ℃基本失去活性。
2.3 pH对噬菌体的影响
对噬菌体在不同pH培养基中的生长量进行计量,结果(表2)表明,噬菌体PTb7-1随着pH的升高,有效数量减少,噬菌体PTb574、PTb1521、PTb1553、P1Tb1556、P2Tb1556在 pH 5~9范围内有较好活性,说明弱酸和弱碱环境对6个噬菌体活性的影响不显著。
2.4 紫外光对噬菌体的影响
噬菌体经紫外光照射后,观察记录在双层平板上噬菌斑个数,并计算每毫升有效数量。结果(表3)表明,噬菌体在紫外光照射过程中有微弱的数量波动现象,其中噬菌体PTb7-1在紫外光照射21 min后失去活性,其他噬菌体在紫外光照射21 min后均还有一定的活性。噬菌体PTb1553、P2Tb1556随紫外光照射的时间增长,有效数量下降较慢,对紫外光较为不敏感。

表1 不同温度处理对6个噬菌体活性的影响Table 1 Effects of different temperature treatments on the activity of 6 phages
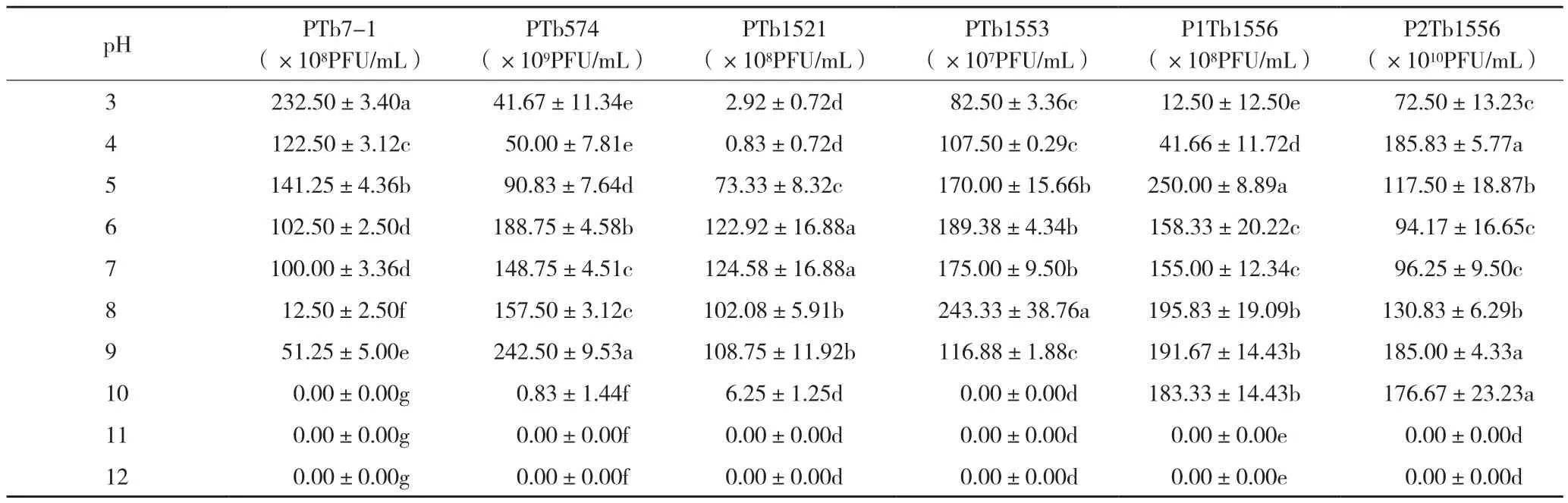
表2 不同pH处理对6个噬菌体活性的影响Table 2 Effects of different pH treatments on the activity of 6 phages

表3 紫外光照射对6个噬菌体活性的影响Table 3 Effect of ultraviolet light on the activity of 6 phages
2.5 乙醚、氯仿对噬菌体的影响
对记录的噬菌斑数进行有效噬菌体数量计算,分别计算乙醚、氯仿处理后的相对存活率。结果(表4)表明,除噬菌体P2Tb1556外,均受乙醚抑制作用,而噬菌体P2Tb1556对乙醚不敏感,甚至还有促进活性的作用。6个噬菌体对氯仿的敏感程度由强到弱为:PTb7-1>PTb1521>PTb1553> P1Tb1556 > PTb574 > P2Tb1556。用氯仿处理后,噬菌体P2Tb1556最敏感,噬菌体PTb574、PTb152表现不太敏感,6个噬菌体对氯仿的敏感程度由强到弱为:P2Tb1556>P1Tb1556>PTb1553> PTb7-1>PTb574>PTb1521。

表4 6个噬菌体经氯仿、乙醚处理后的相对存活率Table 4 The relative survival rates of 6 phages treated with chloroform and ether (%)
3 讨论
从烟草青枯病发病的土壤中,采用双层平板法分离出6个青枯菌噬菌体,说明烟田土壤中有丰富的青枯菌噬菌体资源[23]。青枯菌是一种土壤习居菌,可长时间存活于土壤中,特别是在发病土壤中存活数量更大,因此,筛选防治作物青枯病的噬菌体资源可以直接从土壤中分离获得。此外,本研究还发现,同一土壤样品中可分离得到两种噬菌斑大小完全不同的青枯菌噬菌体,表明同一土壤中可存在多种青枯菌噬菌体,土壤中蕴藏着丰富的噬菌体资源[8],这为大量筛选不同青枯菌噬菌体提供了可能。
不同噬菌体生物学特性不同,研究噬菌体的生物学特性是应用噬菌体治疗细菌病害的基础。本试验通过物理、化学因素对噬菌体生长影响的比较研究,发现不同噬菌体受其影响程度不同。
在温度试验中,多个噬菌体的最适温度为35 ℃左右,致死温度为55~60 ℃,这与Cai等[21]结果相似,而与Bae等[24]报道的噬菌体PE204在温度15~60 ℃范围内稳定有区别。通常烟草青枯菌最适温度为30~35 ℃,致死温度为52℃[5],在实际应用中可以利用噬菌体活性温度和青枯菌的致死温度来处理噬菌体培养液,以消除青枯菌的污染,为噬菌体制剂的研制提供有价值的参考。
在不同pH值条件下,噬菌体PTb7-1数量随着pH的上升而下降,说明该噬菌体可能更适合在酸性条件下生存。所有噬菌体在不同pH下有数量波动现象,可能与蛋白质的结构有关,还需进一步研究。大多数噬菌体在pH 5~9条件下能较好生长,由此说明利用这些噬菌体防治作物青枯病,其田间应用不会受到环境酸碱度的影响,这与高苗等[19]研究结果有差异,原因可能是由于噬菌体的种类不同或者不同地域环境因素导致不同噬菌体的生物学特性存在差异。
克雷伯氏菌(Klebsiellasp.)噬菌体在紫外光下产生波动的现象,是由噬菌体蛋白质对紫外光产生抗性的结果[22]。本研究结果发现,噬菌体随着紫外光处理时间的延长,其数量出现波动现象,紫外光照射21 min后,噬菌体PTb7-1存活率极低,而其他5个噬菌体还保留有较好的活性。高苗等[19]测定的青枯菌噬菌体在紫外光照射21 min后,失去活性,推测不同噬菌体对紫外光的敏感性不同。在本研究中,噬菌体PTb1553、P2Tb1556对紫外光抗性较好,该特性在噬菌体制剂的研发和使用技术上,将具有实际意义。
乙醚、氯仿敏感性试验结果表明,噬菌体PTb7-1、PTb574、PTb1521、PTb1553、P1Tb1556对乙醚、氯仿敏感,其敏感程度有差异。噬菌体P2Tb1556对乙醚不敏感,乙醚处理后相对存活率高于100%,但对氯仿敏感,这对指导噬菌体制剂与有机无机化合物的混配具有参考价值。
4 结论
利用噬菌体防控烟草青枯病必需获得噬菌体资源。从发生有青枯病的烟草土壤中可以直接分离到青枯菌噬菌体,土壤中具有丰富的噬菌体资源。从江西省吉安市烟田土壤中分离得到的6个青枯菌噬菌体的最适生长温度约为35 ℃,致死温度为55~60 ℃,适宜酸碱度为pH 5~9,且对紫外光、乙醚和氯仿敏感。噬菌体PTb7-1只适合于酸性环境,噬菌体P2Tb1556对紫外光和乙醚不敏感,但对氯仿敏感。

