虎杖苷对牛卵母细胞体外成熟的影响
李小凤,伏彭辉,黄永军,邓 凯,陆凤花,石德顺
(广西大学动物科学技术学院,亚热带农业资源保护与利用国家重点实验室,广西南宁 530004)
卵母细胞体外成熟是充分利用未成熟卵母细胞生产胚胎的重要过程,在动物繁殖中有重要价值且已得到广泛应用。然而,卵母细胞体外成熟的质量不如体内成熟[1-2],原因之一是体外环境与体内环境的氧浓度不同,氧气在参与新陈代谢、线粒体呼吸和氧化磷酸化产生能量的同时也会产生副产物——活性氧(Reactive Oxygen Species,ROS),这是ROS 产生的内在因素,外源性因素则包括氧浓度、金属离子(如铁离子、铜离子)、光照诱导、胺氧化酶(加到培养液中的血清中含有大量胺氧化酶)。大气中的氧浓度远远大于输卵管的氧浓度,这可能是造成氧化应激的主要原因[3-6]。虎杖苷(Polydatin,PD)的化学结构为3,4'-5-三羟基芪-3-β-D-葡糖苷,也称白藜芦醇苷[7],是白藜芦醇与葡萄糖的结合物,均属于中草药虎杖成分中的芪类化合物,具有多种生物活性。据报道,虎杖苷对受到氧化应激的细胞具有抗氧化作用,从而起到保护作用[8-10]。目前,关于虎杖苷对卵母细胞体外成熟的影响报道不多。本研究通过探究虎杖苷对牛卵母细胞体外成熟的影响,为改善卵母细胞体外成熟培养体系,提高卵母细胞体外成熟效率提供参考。
1 材料与方法
1.1 实验材料与试剂 牛卵巢由南宁市某特定的屠宰场每天定时提供。
卵母细胞成熟、胚胎培养基所用试剂无特别说明均购自美国Sigma 公司。TCM199 试剂、胎牛血清(Fetal boving serum,FBS)购自美国Gibico 公司。细胞裂解液(cellysis)购于美国Ambion 公司。二氯荧光素二乙酸(2´,7´-Dichlorodihydrofluorescein diacetate,DCFH-DA)购于美国Sigma 公司。DNase I 购于美国Thermo scientific公 司,Mixture dNTP、Random Primer、RNase inhibitor购于日本TaKaRa 公司,ChamQ Universal SYBR qPCR Master Mix 购于南京Vazyme 公司。其中,成熟培养液(M液)由TCM-199 为基础添加激素、FBS 等组成。虎杖苷购于美国Sigma 公司,纯度95%(HLPC),以二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶解,再以M液配置成终浓度为(0.5、1.0、2.0 μmol/L)的工作液。牛精液购于购于广西畜禽品种改良站。
1.2 引物合成 根据NCBI 上找到中已公布的牛的相关基因和内参基因的 RNA 序列,用 Oligo6.71 软件设计适用于qPCR 反应的2 对特异性上、下游引物。引物由生工生物工程(上海)股份有限公司合成。基因引物序列及反应条件见表1。

表1 用于qPCR 反应的引物序列和反应条件
1.3 牛卵母细胞的采集 将从屠宰场获得的卵巢置于盛有37℃ 0.9%的灭菌生理盐水(90 g NaCl,2 g KCl,2 g 无水CaCl2,1 g MgCl2,定容到10 L,不加抗生素)的保温瓶中,4 h 内运回实验室。先用75%的酒精浸泡清洗卵巢30 s,后用37℃生理盐水清洗3 遍,并用剪刀减去卵巢所附带的组织,后将卵巢置于灭菌纱布上,用10 mL 注射器抽取卵巢表面2~8 mm 的卵泡,并将卵泡液与洗卵液混匀后置于35 mm 皿中,在体视显微镜下捡选出具有2 层或以上颗粒层包裹,且胞质均匀的卵丘-卵母细胞复合体(Cumulus Oocyte Complexes,COCs)。
1.4 牛卵母细胞的体外成熟 COCs 经过洗卵液CCM(以TCM-199 为基础,1 L 需补充0.9 g NaCl,1.2 g Hepes,0.4 g NaHCO3,0.1 g 链霉素,0.06 g 青霉素,用NaOH 调pH 至7.2~7.4)清洗3 遍,再过1 遍M 液,后将COCs 随机分为4 组,分别移到含不同浓度(0、0.5、1.0、2.0 mol/L)PD 的M 液的四孔板中,750 μL/孔。轻轻晃动四孔板,以便卵母细胞聚在皿的中央。放入38.5℃,5%CO2饱和湿度培养箱中培养22~24 h。统计牛卵母细胞第一极体排出情况,计算成熟率。备用于相关的实验操作。
1.5 精子获能 取出保存在液氮罐中牛的冻精细管,每管0.25 mL,于装有2 mL 受精液(F 液:TALP 基础液+2.5 mmol/L 咖啡因+0.6% BSA+50 mg/L 肝素)的5 mL尖底离心管中,于38.5℃,5%CO2饱和湿度培养箱中上游获能30 min。
1.6 体外受精(IVF) 成熟培养22~24 h 的牛COCs 用移液枪轻轻吹掉卵丘细胞后,挑选有第一极体排出且胞质均匀的卵母细胞放入受精盘中,每滴15~20 枚细胞。待精子获能完成后,取上清液,1 500 r/min 离心5 min,弃上清液,取活力好的精液注入受精滴中,使两者受精24 h 后再转盘。
1.7 胚胎培养 将受精卵取出,用移液枪轻轻吹掉受精卵表面的精子,再转到事先准备好的胚胎培养盘中培养,每个20 μL 滴放入15 枚胚胎。每隔24 h 半量换液。胚胎培养48 h 记录统计卵裂情况,第8 天记录统计囊胚数。
1.8 囊胚细胞数检测 收集各组第8 天囊胚,在PBS 中清洗3 遍,再在含 10μg/L Hoechst 33342 的胚胎培养液中室温避光孵育20 min,然后用PBS 清洗3 遍,在载玻片中央滴加抗猝灭剂和四周涂上凡士林,每个盖玻片放入3~5 枚囊胚进行压片,荧光显微镜下观察,最后用ImageJ 软件进行统计细胞数。
1.9 ROS 检测 试验之前用胚胎培养液将DCFH-DA 稀释到10 μmol/L 的工作液,在培养箱中平衡30 min。用移液枪轻轻掉卵丘细胞,挑选有第一极体排出且胞质均匀的卵母细胞放入平衡好的微滴中,在培养箱避光孵育30 min。孵育完成用PBS 洗3 遍。再将其放到平衡好的由PBS 做成的微滴里,在多光子激光共聚焦扫描显微镜下观察,最后用ImageJ 软件分析每个卵母细胞的荧光密度值。
1.10 微量反转及荧光定量 PCR 收集好成熟的卵母细胞,每一组20 枚,加入裂解液。置于PCR 仪中75℃、15 min,使RNase 灭活,瞬离,置于冰上。加入DNase Ⅰ1.0 μL、DNase Ⅰ Buffer 1.2 μL、RNase Inhibitor 0.1 μL,瞬离,37℃、30 min 去除DNA。瞬离置于冰上,各加入EDTA、Random Primer、Mixture dNTP 1.0 μL,瞬离,65 ℃、15 min。加 入5×Buffer 4 μL、DTT 2 μL、RNase Inhibitor 0.5 μL、Fast 酶SS Ⅱ0.25 μL,瞬 离 后,PCR条 件:25 ℃、10 min,42 ℃、90 min,95 ℃、15 min,注意以上操作均在冰上进行。将得到的产物进行荧光定量PCR,体系与反应程序按照说明书进行。
1.11 成熟后卵母细胞内总谷胱甘肽的检测 实验方法参照说明书推荐与实际条件进行。按上述做体外受精用的卵母细胞原则,每组挑选30 枚卵母细胞,加入3 倍体积的蛋白去除试剂S,混匀后用液氮和37℃快速冻融细胞,冰浴5 min,4℃,10 000 r/min 离心10 min,取上清用于测定总谷胱甘肽。按比例加入各试剂后,避光室温反应25 min,酶标仪A412 测定OD 值,样品中的结果总谷胱甘肽按照标准曲线算出。
1.12 统计分析 用IMageJ 软件对囊胚细胞数,卵母细胞的ROS 水平进行统计,采用SPSS 21 进行单因素ANOVA 分析后作图。每个实验至少重复3 次,P<0.05表示差异显著,P>0.05 表示差异不显著,P<0.01 表示差异极显著。
2 结果
2.1 不同浓度的PD 对体外成熟牛卵母细胞第一极体排出的影响 由表2 可知,牛卵母细胞经不同浓度PD 处理22~24 h 后极体排出率均显著高于对照组(0 μmol/L PD),其中1.0 μmol/L PD 处理组最高,提示在成熟液添加一定量PD 对牛卵母细胞体外成熟有积极影响。

表2 PD 对牛COCs 第一极体排出率的影响
2.2 成熟液添加不同浓度PD 对牛IVF 胚胎发育的影响如表3 所示,不同浓度PD 处理组卵裂率与对照组均无显著差异,但1.0 µmol/L PD 处理组IVF 胚胎的囊胚率显著高于对照组。

表3 成熟培养中添加PD 对牛早期胚胎发育的影响
2.3 成熟液添加不同浓度PD 对牛IVF 囊胚细胞数的影响 将IVF 所得的第8 天囊胚进行Hoechst 33342 染色,结果显示成熟液中添加PD 有利于提高囊胚的细胞数,尤其是1.0、2.0 μmol/L 组较对照组有显著提高,提示一定量成熟液有助于胚胎发育(图1,表4)。
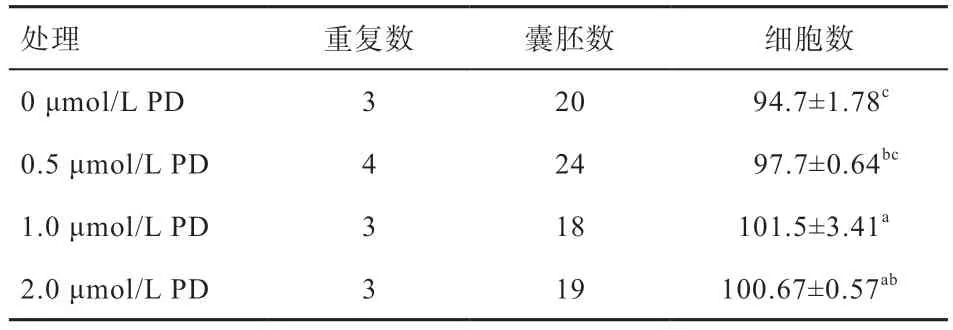
表4 成熟液添加PD 对牛囊胚细胞数的影响
2.4 成熟液添加PD 对牛卵母细胞中ROS 水平的影响由以上结果可知,1.0 μmol/L PD 为最佳处理浓度。由图2 可知,1.0 μmol/L PD 处理组ROS 水平较对照组显著降低,说明PD 能显著降低细胞内的ROS 水平。
2.5 成熟液中添加 PD 对牛卵母细胞抗氧化基因表达水平的影响 如图3 所示,1.0 μmol/L PD 处理的卵母细胞可以显著提高GPX4、SOD1的mRNA 表达水平。
2.6 成熟液添加PD 对牛卵母细胞总谷胱甘肽(GSH)含量的影响 如图4 所示,PD 处理组卵母细胞内的总谷胱甘肽水平极显著高于对照组。
3 讨 论
近年来,随着胚胎移植的发展不断商业化,卵母细胞的体外成熟作为体外获取胚胎的主要来源备受关注。然而体外成熟的卵母细胞质量与体内自然成熟的卵母细胞质量有很大差距,原因之一是体外培养产生的ROS没有得到及时清除,培养条件也影响卵母细胞质量和胚胎发育能力[11]。
本实验结果显示,与对照组相比,在成熟液中添加PD 处理牛卵母细胞22~24 h 的第一极体排出率显著提高。Dominko 等[12]报道,排出第一极体的卵母细胞与未排出极体的卵母细胞相比,发育到囊胚的潜力更高,第一极体的排出说明卵母细胞已经完成核成熟,添加PD 提高了牛卵母细胞第一极体率的排出,可能是PD的抗氧化能力使卵母细胞在一个ROS 含量更低的环境下成熟。
胚胎质量(囊胚细胞数、囊胚细胞凋亡率)对于牛胚胎成功植入非常重要。研究发现,最高质量(I 级)胚胎的妊娠率约为53%,而II 级囊胚的妊娠率仅为36%[13-14]。本实验结果表明,PD 提高牛卵母细胞囊胚率与囊胚细胞数,与最近Khan 等[15]的研究结果相似,其结论为在成熟液中添加1.0 µmol/L PD 可提高囊胚率和囊胚细胞数。本实验表明,在体外成熟液中添加1.0 µmol/L PD有利于促进囊胚的形成和通过提高囊胚细胞数来提高囊胚质量。
Qiao[16]将PD 加到由H2O2诱导氧化损伤的人脐静脉内皮细胞,细胞存活率黏附性和迁移能力被提高,乳酸脱氢酶(LDH)和ROS 的释放被抑制,GSH-Px 和SOD 含量提高。也有研究表明,PD 通过提高抗氧化酶基因的表达、抑制氧化产物的产生,保护由疾病引起的细胞损伤[10,17-20],说明PD 具有强的抗氧化性。本研究发现,与对照组相比,1.0 µmol/L PD 处理组显著提高成熟后的卵母细胞抗氧化酶基因GPX4、SOD1的表达水平,同时降低细胞内的ROS 含量。这与PD 在保护氧化损伤的细胞的效果一致。因此,猜测1.0 µmol/L PD处理组的ROS 水平降低,可能与上调内源性抗氧化酶的表达水平有关,也可能与PD 本身的羟基化学结构有关。
卵母细胞内ROS 和GSH 水平是影响其体外成熟质量及随后的胚胎发育重要因素[21]。许多学者认为GSH含量是卵母细胞胞质成熟的一项有效指标[22-24]。此外,GSH 可以与自由基、氧化型的中间产物反应,使细胞免受氧化损伤[24],如GSH 作为辅酶,通过调节氧化还原反应,调节蛋白和DNA 合成。在猪[25]、牛[23-24]等哺乳动物中,卵母细胞成熟过程中合成GSH。卵母细胞在卵巢的成熟过程中,GSH 会随排卵临近而升高,卵母细胞成熟质量在高浓度GSH 下得到改善,同时会为后续的胚胎发育“保驾护航”。总谷胱甘肽包括还原型谷胱甘肽和氧化性谷胱甘肽2 种,但在哺乳动物细胞中,约90%的GSH 以还原型存在。还原型和氧化型谷胱甘肽可以在谷胱甘肽过氧化物酶类和还原酶的作用能相互转化。本实验分析了1.0 µmol/L PD 处理组与对照组成熟后的卵母细胞内总谷胱甘肽含量,发现实验组显著提高了总谷胱肽含量,换言之,实验组的还原型谷胱甘肽比对照组高。与对照组相比,虎杖苷处理组卵母细胞内GSH 得到提高,原因可能是卵母细胞在PD 处理下,抗氧化酶基因的表达水平提高,卵母细胞的抗氧化能力增强,从而提高了卵母细胞成熟质量。
4 结 论
在牛卵母细胞成熟液中添加1.0 μmol/L PD 可提高卵母细胞的抗氧化能力,有助于卵母细胞的体外成熟。

