FHL2与PBX3在宫颈癌组织中表达与临床病理特征及预后的相关性
周伟平
(湖南省脑科医院/湖南省第二人民医院病理科,湖南长沙 410007)
宫颈癌是我国妇科常见的一种恶性肿瘤,患者年龄主要集中于40~60岁,但近年来其发病人群逐渐年轻化,发病率以及病死率较高[1]。宫颈癌的发病与病毒感染、性行为、分娩等相关因素相关,严重危害患者的生命健康[2]。为了能够使宫颈癌患者早期确诊与治疗,以降低患者病死率,进行的相关研究显示,宫颈癌组织中的相关蛋白变化能够反映疾病的严重程度,但尚需进一步研究[3]。四个半LIM结构域蛋白2( FHL2)是属于LIM蛋白家族的一员,最早发现于成肌细胞与横肌肉瘤细胞中,能够参与基因转录调节、细胞分化、信号转导以及肿瘤发生发展的过程[4-5]。前B细胞白血病同源盒基因3(PBX3)是属于PBX家族的成员,能够参与机体细胞的发育以及进化[6]。既往研究显示,FHL与PBX同属同源异型盒基因(HOX)的转录因子,在肿瘤的发生发展过程中起到了一定的作用[7-8]。而HOX基因高表达在宫颈癌的发生发展中的作用已得到证实[9]。但是目前尚未见其中的FHL2与PBX3在宫颈癌中的表达研究。因此,本次研究主要是探讨FHL2与PBX3在宫颈癌组织中的表达与临床特征及预后的相关性。
1 资料与方法
1.1一般资料 选取本院2013年12月至2015年12月收治的55例宫颈癌患者作为研究对象,采用回顾性分析法分析患者的临床资料将患者癌组织标本分为研究组(55例),将患者癌旁组织标本(距肿瘤边缘4 cm处)作为对照组。患者年龄30~74岁,平均(47.66±11.32)岁。纳入标准:(1)符合宫颈癌诊断标准[10];(2)获得患者及家属的知情同意,并签署知情同意书;(3)经病理检查已确诊为宫颈癌,并适合手术者;(4)所有患者术前均未进行放疗、化疗。排除标准:(1)合并其他恶性肿瘤者;(2)严重肝肾心功能不全者;(3)代谢异常者;(4)既往精神病史者。本次研究已获得本院医学伦理委员会批准。
1.2方法
1.2.1仪器与试剂 兔抗人FHL2单克隆抗体为美国HBT公司产品;兔抗人PBX3购于上海亿欣生物科技公司;免疫组化试剂盒和DAB显色试剂盒产于北京中山生物技术有限公式。
1.2.2免疫组化法 严格按照试剂盒说明进行SP法免疫组织化学检测,FHL2与PBX3均按照说明书进行稀释。所有标本均进行常规固定、包埋、切片,脱蜡后,使用3%过氧化氢阻断内源性过氧化物酶,抗原修复后,加入一抗4 ℃过夜,二抗孵育,DAB显色、复染、脱水、透明以及封片,最后用PBS代替一抗作为空白组对照,一切操作均严格按照SP试剂盒说明书进行。
1.2.3结果判定[11]每张切片随机选取5个高倍镜视野,计数500个肿瘤细胞,FHL2蛋白定位于细胞核中,PBX3蛋白定位于细胞质,染色阳性为均匀棕黄色颗粒。并根据细胞染色强度与阳性细胞百分比进行综合评分。(1)根据阳性细胞染色强度:无着色为0分;黄色为1分;棕色为2分;棕褐色为3分。(2)根据阳性细胞百分比:<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。(3)将阳性细胞比例与着色强度相乘:≥6分均为阳性表达,<6分为阴性表达。免疫组织化学结果判定由高年资的病理医师完成。
1.3随访 采用电话或者上门进行随访,随访截止时间为2018年12月30日,随访时间为2~36个月,以患者发生转移、死亡或随访时间结束为终点。
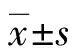
2 结 果
2.1两组FHL2、PBX3蛋白表达水平比较 研究组FHL2、PBX3蛋白阳性表达率明显高于对照组,差异有统计学意义(P<0.05),见表1。免疫组化法检测显示,FHL2在宫颈癌组织主要表达在细胞质或细胞膜(棕色染色),而在癌旁组织细胞质中少有表达,见图1;PBX3在宫颈癌组织中主要表达在细胞质(棕色染色),而在癌旁组织细胞质中少有表达,见图2。
2.2宫颈癌组织FHL2、PBX3蛋白表达和临床病理特征的关系 FHL2、PBX3蛋白表达与宫颈癌患者的年龄、病理类型等临床特征不相关(P>0.05),但与宫颈癌患者的肿瘤分化程度、淋巴结转移、浸润深度以及病理分级相关,当肿瘤分化程度越低、有淋巴转移、浸润深度越深以及病理程度越高时,FHL2、PBX3蛋白阳性表达率越高,差异有统计学意义(P<0.05),见表2。
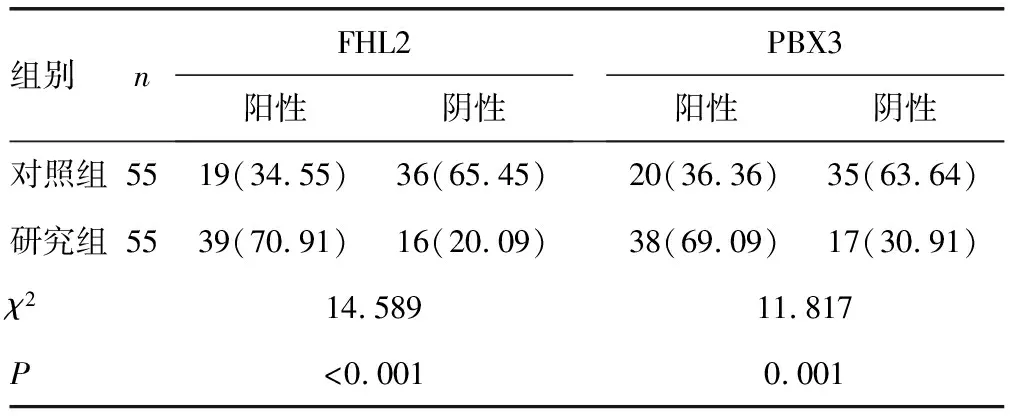
表1 两组组织标本间FHL2、PBX3蛋白表达率的比较[n(%)]
2.3宫颈癌患者的预后生存情况 所有研究对象从出院至随访结束时存活2~36个月。宫颈癌患者中位生存期为20个月,其中FHL2阳性表达和阴性表达患者的中位生存期分别为18、30个月,PBX3阳性表达和阴性表达患者的中位生存期分别为17和32个月,比较差异有统计学意义(P<0.05)。

注:A表示癌组织;B表示癌旁组织。
图1FHL2在宫颈癌组织及癌旁组织中的表达(×400)
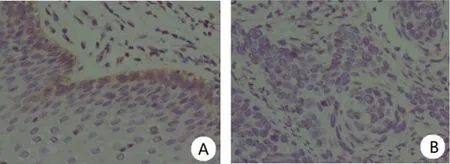
注:A表示癌组织;B表示癌旁组织。
图2PBX3在宫颈癌组织及癌旁组织中的表达(×400)

表2 55例患者宫颈癌组织FHL2、PBX3蛋白表达情况与临床病理特征的相关分析
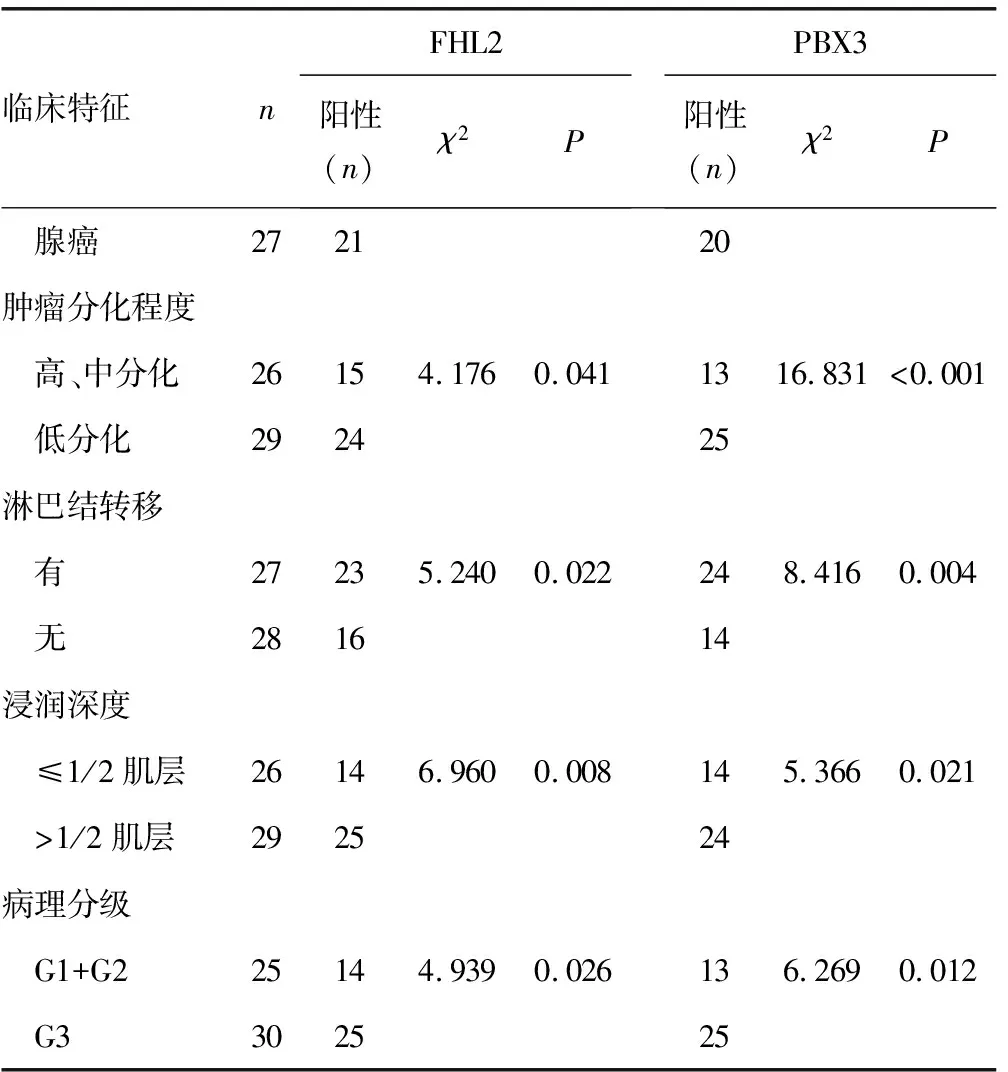
续表2 55例患者宫颈癌组织FHL2、PBX3蛋白表达情况与临床病理特征的相关分析
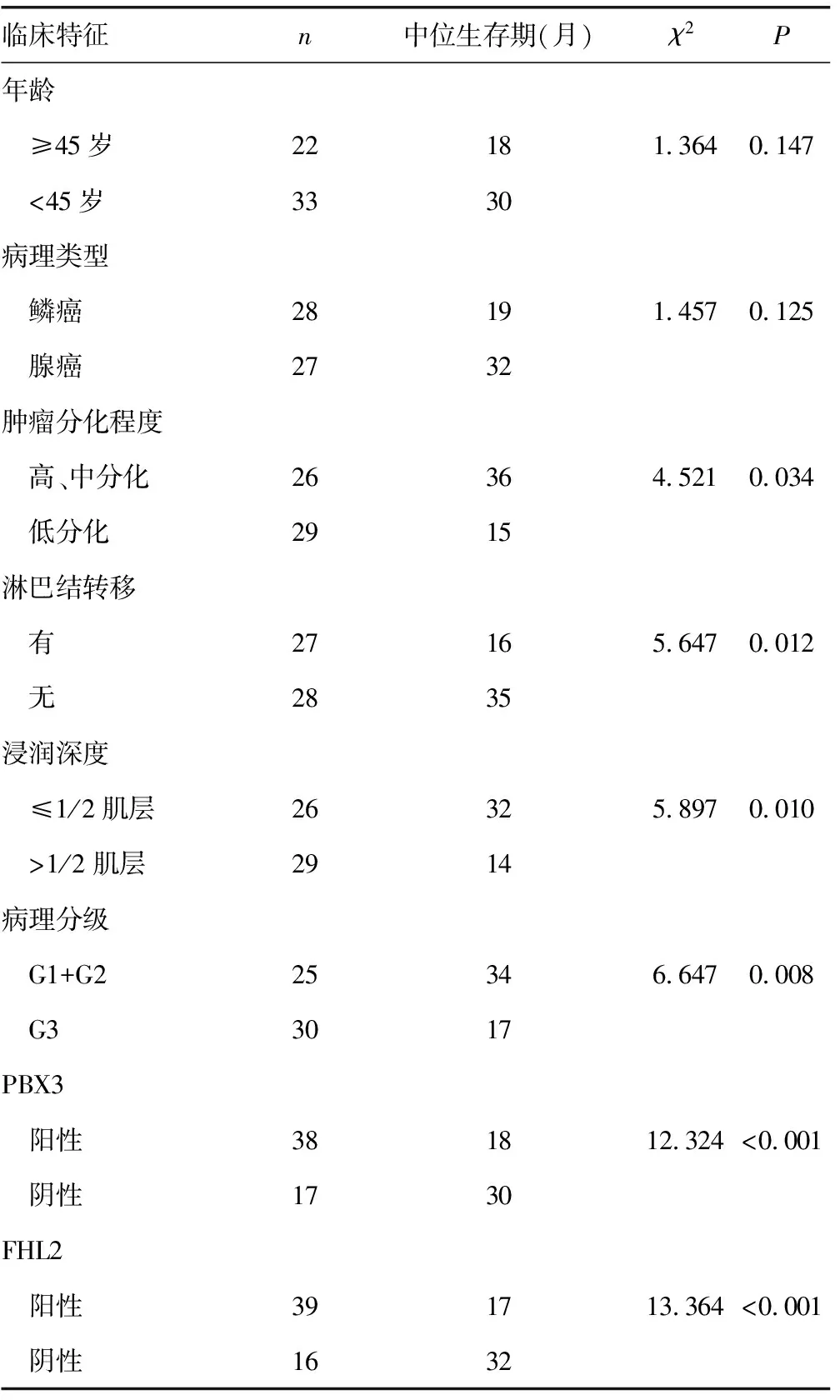
表3 影响宫颈癌癌患者预后的单因素分析(n)
2.4宫颈癌患者预后的单因素分析 经单因素分析得出:肿瘤低分化、淋巴结转移、浸润深度>1/2、病理分级G3、FHL2、PBX3阳性表达的患者生存时间均显著缩短,差异有统计学意义(P<0.05),见表3。
2.5宫颈癌患者预后的Cox多因素分析 经多因素Cox比例风险回归模型分析得出:肿瘤低分化、淋巴结转移、浸润深度>1/2、病理分级G3、FHL2、PBX3阳性表达均为影响宫颈癌患者预后的独立因素(P<0.05),见表4。
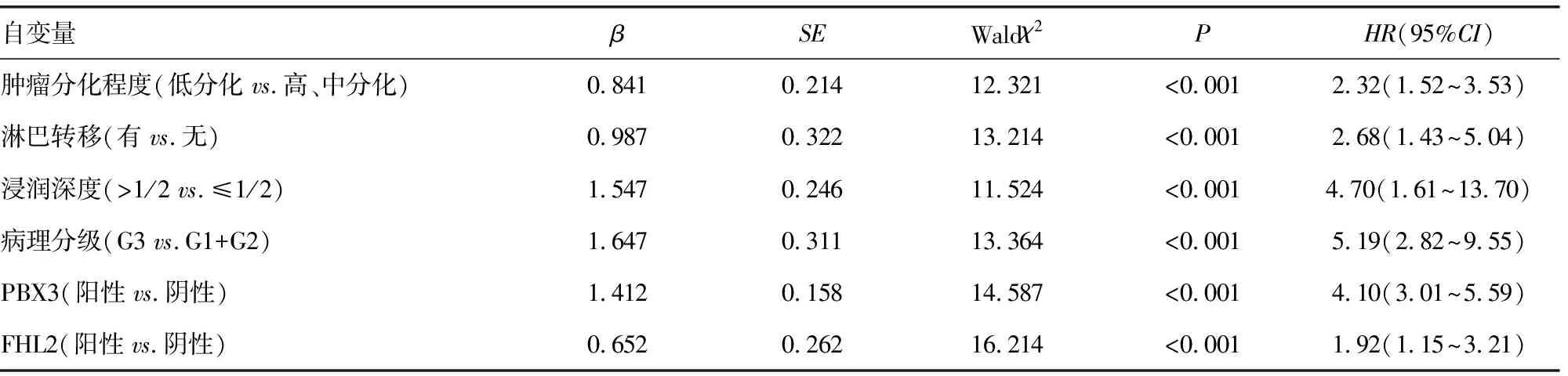
表4 影响宫颈癌患者预后Cox多因素分析
3 讨 论
FHL2是属于FHL蛋白家族一员,富含279个氨基酸,主要是由四个半富含半胱氨酸的FHL结构域组成[12]。主要是位于细胞核并在细胞质与细胞核之间穿梭,并且在大脑以及骨骼肌、心脏中特异性表达,同时能够在不同组织中作为转录因子激活或抑制转录以及诱导组织细胞的凋亡[13],并有经过研究证明,FHL2能够影响肿瘤的发展以及转移侵袭的能力[14]。PBX3是属于PBX蛋白家族成员之一,主要是作为细胞内的转录因子,主要是对于哺乳动物细胞的发育、进化有着重要功能,既往主要是研究PBX3表达在白血病患者中作用,但随着深入研究发现,PBX3在肿瘤的发生发展方面有着重要作用[15-16]。
宫颈癌是女性生殖系统疾病中发病率仅低于乳腺癌的一种妇科肿瘤疾病,在我国,发病年龄主要集中在40~50岁,但近年来发病年龄逐渐年轻化,且发病率有着明显的地区差异[17],临床主要出现阴道流血、排液、发热,严重时出现全身衰竭等症状[18]。目前临床上为了能够降低发病率以及病死率,常采用宫颈细胞学筛查,虽能够降低患者的发病率,但宫颈癌患者的发病率和病死率仍较高[19]。有相关研究报道,FHL2表达上调能够导致患者肿瘤逐渐恶化[20]。研究发现,PBX3表达能够促进肿瘤细胞的增殖,同时对于评估患者的预后有一定的作用[21]。但对于FHL2与PBX3蛋白是否能够评估宫颈癌患者的严重程度以及预后尚未有具体研究结果。因此,本次研究主要是探讨FHL2与PBX3在宫颈癌组织中表达与临床特征及预后的相关性。
本次研究结果显示,研究组FHL2、PBX3蛋白阳性表达明显高于对照组,表明FHL2、PBX3在宫颈癌患者中表达水平增高;FHL2、PBX3蛋白表达与宫颈癌患者的年龄、病理类型等,但与宫颈癌患者的肿瘤分化程度、淋巴结转移、浸润深度以及病理分级相关,当肿瘤分化程度越低、有淋巴转移、浸润深度越深以及病理程度越高时,FHL2、PBX3蛋白阳性表达率越高,表明FHL2、PBX3表达能够反应疾病的严重程度;宫颈癌患者平均中位生存期20个月,其中FHL2阳性表达和阴性表达患者的中位生存期分别为18个月、30个月,PBX3阳性表达和阴性表达患者的中位生存期分别为17个月、32个月中位生存期;经单因素分析得出:肿瘤低分化、淋巴结转移、浸润深度>1/2、病理分级G3、FHL2、PBX3阳性表达的患者生存时间均显著缩短;经多因素Cox比例风险回归模型分析得出:肿瘤低分化、淋巴结转移、浸润深度>1/2、病理分级G3、FHL2、PBX3阳性表达均为影响宫颈癌患者预后的独立因素,由此可见,当宫颈癌患者病情逐渐加重时,FHL2、PBX3表达水平增高,能够作为评估患者严重程度以及预后的有效指标。
4 结 论
FHL2与PBX3蛋白在宫颈癌组织中的表达水平升高,且表达水平与宫颈癌患者的临床特征显著相关,对于宫颈癌患者的发生、发展以及预后均有着重要的临床意义,可作为评估宫颈癌的严重程度以及预后的有效指标。但本组研究选取样本量较少,研究时间过短,尚需进一步深入研究。

