标本混匀方式对血清生化检测结果的影响
余 超,李明伊,车翔林
(1.华中科技大学同济医学院附属协和医院检验科,湖北武汉 430022;2.华中科技大学同济医学院,湖北武汉 430030)
临床实验室中的错误主要来源于分析前误差,分析前误差可能导致结果不准确甚至系统性偏倚。分析前阶段包含样本的处理和保存相关作用。为保持样本的最佳性能,冷冻样本最好解冻1次。解冻循环次数、保存温度已有研究[1-2],近来也有报道了混匀对保存温度的影响[3],但解冻时间及解冻后的充分混匀描述模糊。HAWKER等[4]研究了自动解冻与混匀装置对生化检测结果的影响,而常规混匀方式的研究主要用于血液混匀[5]。不同混匀方式对抗凝血样本的影响也有报道[6]。在我国,手动颠倒混匀是实验室的主要方式,目前没有相关的研究。尽管分析前阶段无法形成标准化,但能同质化[7]。因此,本文通过对冻存样本解冻时间、混匀方式、手动颠倒混匀次数进行研究,为同质化提供研究基础。
1 材料与方法
1.1标本来源 收集同日100例已检测后无肉眼可见溶血、脂血、黄疸门诊患者血清样本,充分混合混匀后按每个EP管0.5 mL进行分装,共400个EP管。
1.2仪器与试剂 漩涡混匀器(海门其林贝尔),滚筒式混匀器(江苏康健),分析仪器采用美国雅培(Abbott)公司的c16000全自动生化分析仪。试剂:清蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、胆固醇(CHOL)、肌酐(CREA)、葡萄糖(GLU)、钾(K+)、钠(Na+)、总胆红素(TBIL)、三酰甘油(TG)、超敏C-反应蛋白(hs-CRP)的检测试剂均为雅培原装配套试剂。校准品:雅培原装配套校准品。质控品:伯乐公司提供。
1.3方法 生化分析仪每日质控在控后,随机选取5个已分装的EP管上机检测上述项目,检测结果均值作为基线。将余下EP管放置于塑料泡沫板上,于-20 ℃冰箱冷冻过夜保存。次日,取出10个EP管悬置于架子上,静置于室温(24 ℃)无明显空气流动下,以冰晶消失为终点,观察融解所需时间。取20个EP管平均分成4份,1份垂直放置,余3份水平放置,解冻1 h后,取水平放置中的1份用漩涡混匀器混匀30s,1份用滚筒式混匀器以50 r/min混匀5 min,余两份不混匀上机检测,并重复检测一次。取240个EP管水平放置解冻1 h后,由20名实验人员手动颠倒混匀2、4、6、8、10、20次后检测,并重复一次。取60个EP管垂直放置解冻1 h后,由5名实验人员手动颠倒混匀2、4、6、8、10、20次后检测,并重复一次。取12个EP管以观察解冻所需最少时间按水平和垂直放置后由1名实验人员手动颠倒混匀2、4、6、8、10、20次后检测,并重复一次。
1.4统计学处理 数据采用SPSS19.0统计软件处理,采用配对t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1以冰晶消失为终点,0.5 mL冰冻血清解冻所需时间约17~23 min。因此,选择25 min能确保解冻完全。
2.2不同混匀方式的比较 以临床检测项目允许总误差TEa的1/3作为判断标准[8],计算偏倚Bias。漩涡与滚筒混匀除ALT差异有统计学意义(P<0.05)但无临床差异外其他项目差异均无统计学意义(P>0.05)及临床差异;未混匀临床差异不可接受。见表1。
2.3水平放置下不同人员间手动颠倒混匀的比较 不同人员在颠倒混匀2次后,仅ALB有统计学差异(P=0.049)。此组内ALB的生物学变异偏倚范围是-2.3%~1.2%,又因|-2.3%|>2%[8],故有临床差异。混匀4次及以上无统计学(P>0.05)及临床差异。见表2。
2.4垂直放置下不同人员间手动颠倒混匀的比较 不同人员颠倒混匀2次后,ALB(P=0.007)、CHOL(P=0.019)、K+(P=0.029)、Na+(P=0.023)、TRIG(P=0.006)检测结果差异有统计学意义;混匀8次后,hsCRP差异有统计学意义(P=0.015);混匀10次后,AST差异有统计学意义(P=0.030);令人吃惊的是,TRIG除了在混匀10次时无统计学意义外,其他差异均有统计学意义(P<0.05)。见表3。

表1 不同混匀方式偏倚的比较(%)
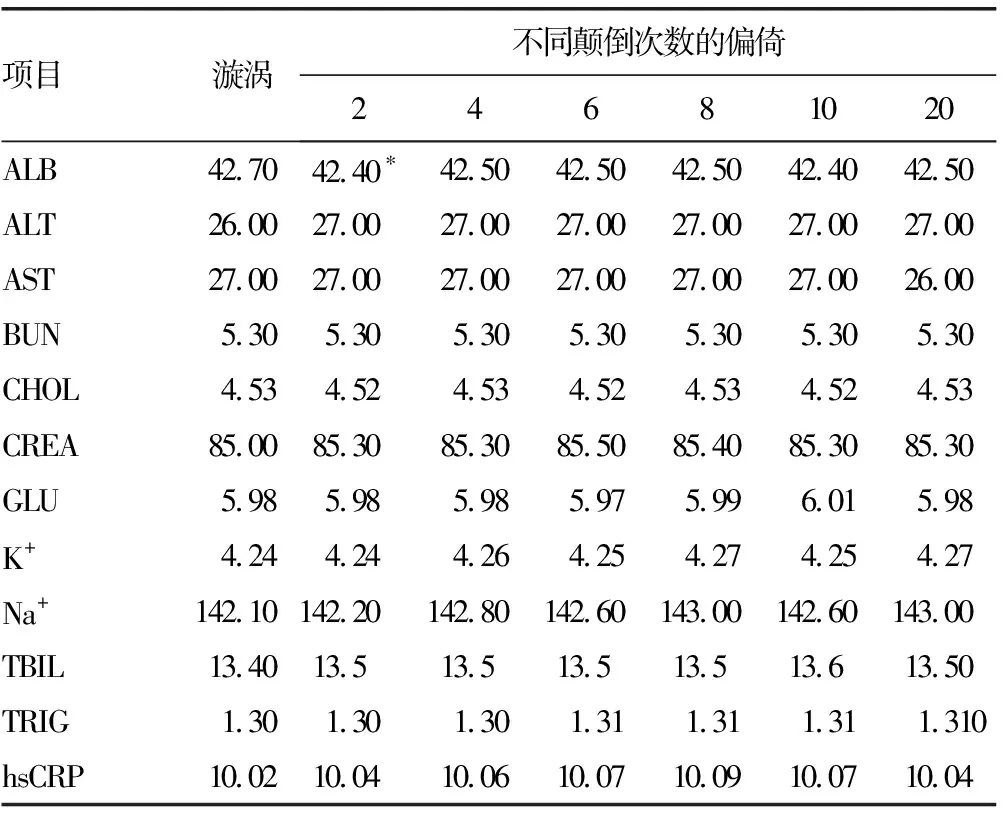
表2 水平放置颠倒混匀次数与漩涡混匀的偏倚比较(%)
注:配对t检验,以*表示P<0.05。
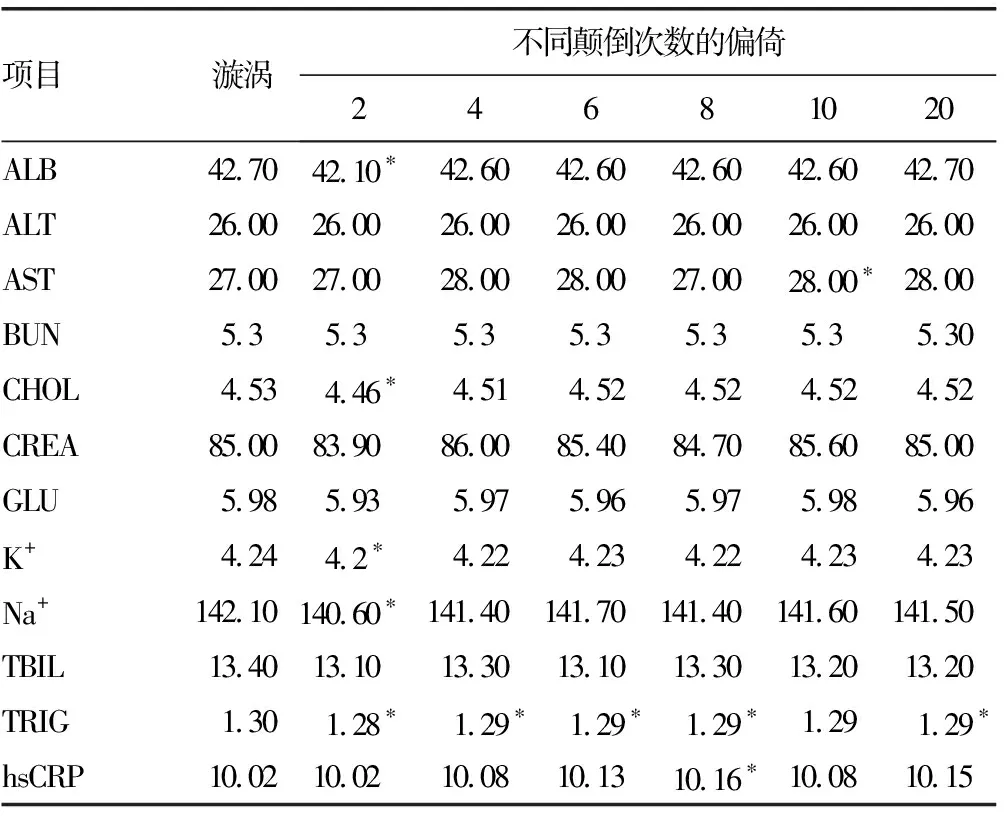
表3 垂直放置颠倒混匀次数与漩涡混匀的比较(%)
注:配对t检验,以*表示P<0.05。
2.5垂直放置下不同人员间手动颠倒混匀的临床差异偏倚比较 对上述有统计学差异的项目进行临床差异偏倚比较的结果表明:混匀2次,ALB(|-2.80%|>2.00%)、CHOL(|-3.10%|>3.00%)、Na+(|-2.00%|>1.33%)的临床差异仍然存在,而K+(|-1.70%|<2.00%)及TRIG(|-3.10%|<4.67%)的临床差异可接受。混匀2次以上,hsCRP(2.40%<10.00%)、AST(3.70%<5.00%)、TRIG(|-1.50%|<4.67%)的临床差异均可接受。见表4。
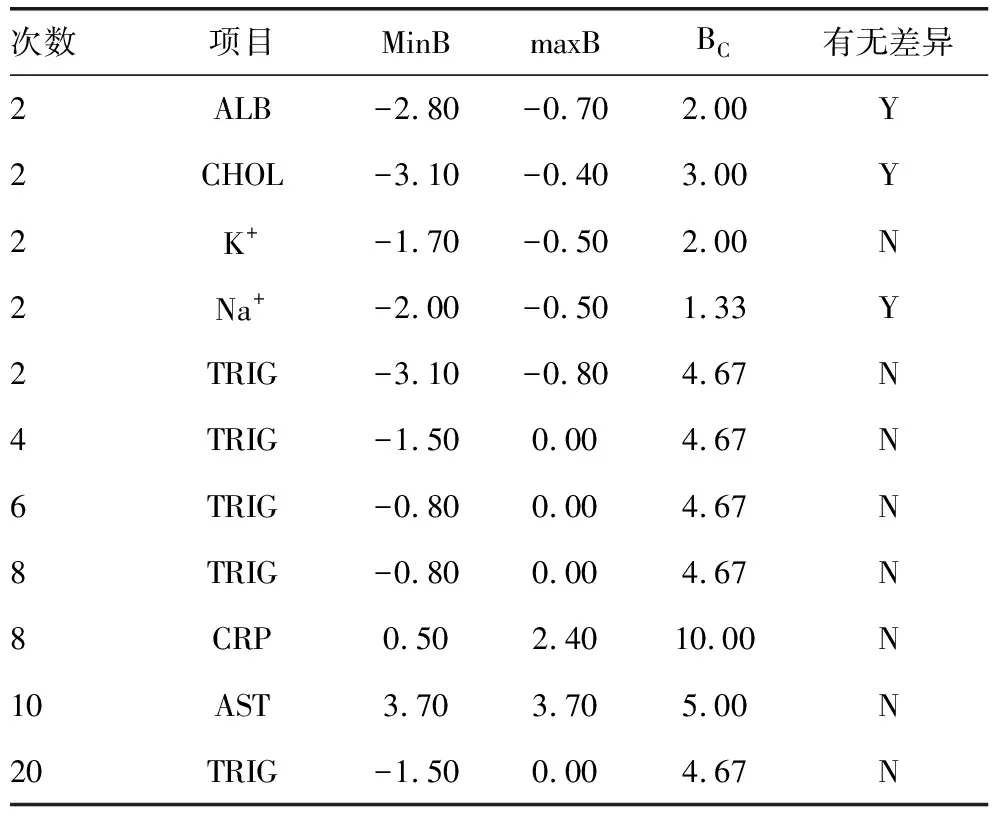
表4 临床差异偏倚比较(%)
注:minB为批内最小值的偏倚;maxB为批内最大值的偏倚;BC为偏倚判断标准;Y表示有差异,N表示无差异。
2.6解冻25 min对生化结果影响的比较 解冻时间从1小时缩短至25 min,水平放置样本颠倒混匀2次后,仅发现TRIG(P=0.013)差异有统计学意义但无临床差异TG(0.8%<4.67%);垂直放置时,AST(P=0.043)和TRIG(P=0.022)有统计学差异但无临床差异AST(3.70%<5.00%)和TRIG(0.80%<4.67%)。见表5、6。
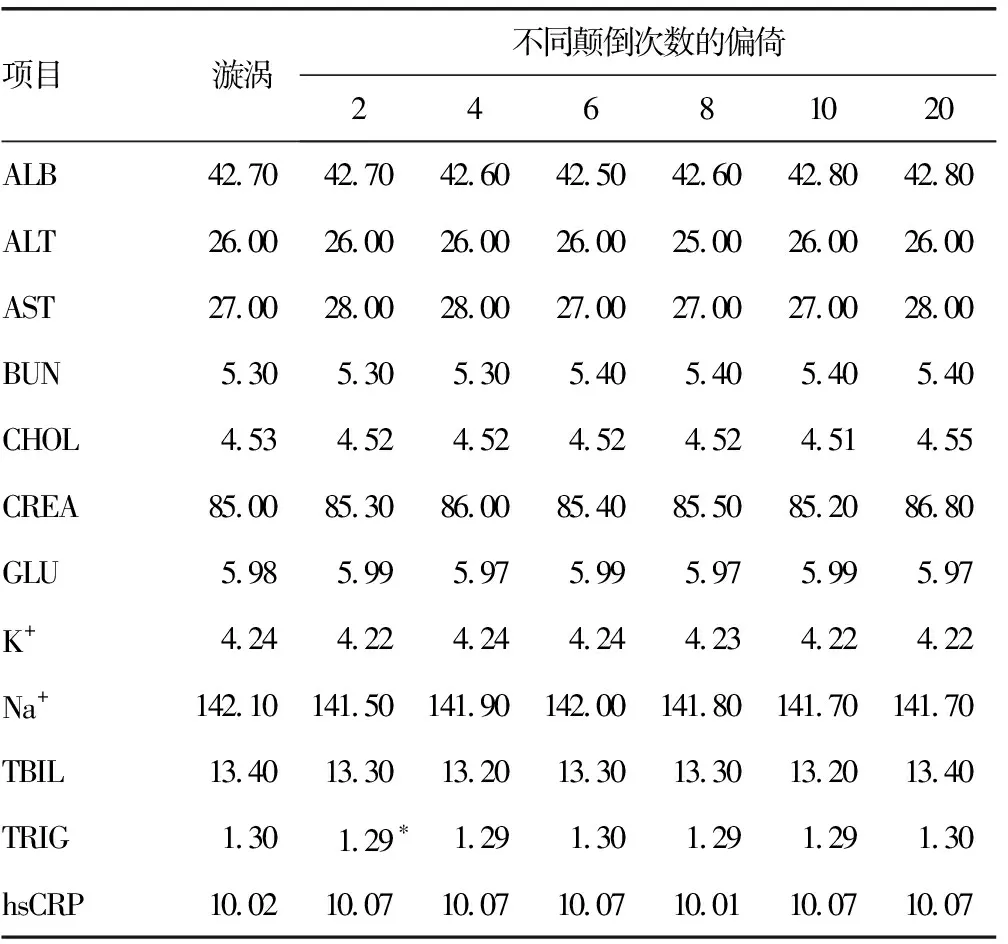
表5 水平放置解冻25 min颠倒混匀次数与漩涡混匀的比较(%)
注:配对t检验,以*表示P<0.05。
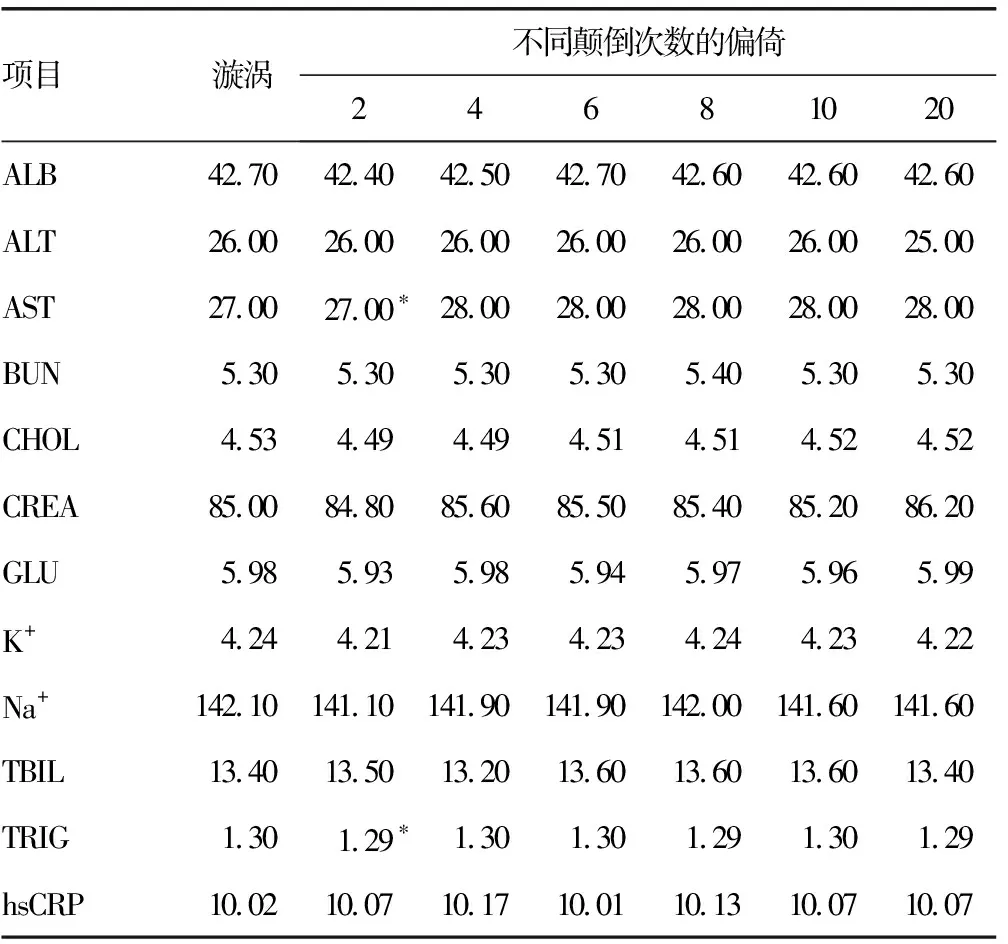
表6 垂直放置解冻25 min颠倒混匀与漩涡混匀的偏倚均值比较(%)
注:配对t检验,以*表示P<0.05。
3 讨 论
混匀是分析前的一个重要环节,如标本采集后的混匀对溶血和检测的影响[9],解冻血浆混匀不充分可能导致VWD或血友病的误诊[10]。冻存样本检测前均需要充分混匀,质控品解冻后也需充分混匀[11],但均未说明混匀方式。漩涡混匀[3]常用于科学研究长期冰冻保存的样本,滚筒混匀[5]在血液混匀更常见。表1结果表明这两种混匀方式都能达到充分混匀的目的。而无论是水平或是垂直放置未混匀样本结果偏差大,临床不可接受。水平放置的差异小于垂直的差异在于从水平到垂直过程使血清的流动而部分混合,也由于解冻后的血清会形成自上而下逐渐增加的一系列的浓度梯度。出现此种现象的机制尚不明确,可能是由于冰冻时水将最先冻结且密度变低,导致血清中其他成分如蛋白质以及盐类等沉积在容器的底部[2]。也可能是来自冷冻材料的血清成分是选择性可溶的,留下冰粒,使血清上部组分稀释而血清下部成分的浓缩。尽管机制仍不明朗,但说明冰冻血清解冻后呈不均一状态,检测前务必充分混匀。
然而,与上述两种机械混匀方式相比,手动颠倒混匀在全国的临床实验室更为常见。LIPPI[12]报道了不同操作人员对手动移液器使用间的差异,同样不同检验员混匀的手法和力度及颠倒次数不同,也存在人员间的差异。表2结果可知,不同人员在颠倒混匀2次后,部分项目的统计学差异和临床允许范围不可接受。这与HAWKER等[4]对自动机械化混匀装置的研究结果混匀2次即可充分混匀不相符。因自动化混匀装置能精确控制颠倒的弧度和力量,而人则不能。但不同人员混匀4次及以上,临床可接受且接近2次,说明颠倒与机械混匀差异不明显。选择漩涡混匀值而非基线作为标准,是避免解冻标本影响检测结果[2]及批间差异。
样本冷冻保存时通常是垂直放置,解冻时也可能是垂直放置。与水平放置相比,垂直放置时有统计学差异的项目明显增多且颠倒次数增加时也有存在。可能是因为前述水平到垂直的部分混合,也可能是漩涡等方式混匀比手动混匀更充分具有较高的精密度,从而存在有统计学意义但无临床差异。因此,不同人员间手动颠倒混匀2次有差异,4次及以上则没有差异。
样本解冻时间至少大于1 h[4],但实际工作中通常少于1 h。观察0.5 mL冷冻标本以冰晶消失为终点表示完全融解所需时间约17~23 min,这与HAWKER[4]的研究最多需要23 min解冻并达到室温吻合。不同的是,该作者的研究利用的吹风等设备使血清复温到室温,而本研究只解冻并没有复温。因为样本加样量是微量且远小于试剂的加样量,同时机上试剂保存低于8 ℃,样本温度与试剂温度接近,不影响样本性质。在解冻25 min条件下,对水平或垂直放置手动颠倒混匀次数研究发现,颠倒混匀4次及以上,可达到充分混匀状态。因此,解冻时间缩短至25 min并不影响检测性能,但能提高工作,优化效率。
本文研究的特色在于用患者血清样本代替质控品,不仅节约了实验成本,还适用于科研样本及未及时检测保存样本的解冻及混匀,更具有代表性和实用性,可用于实验室混匀的规范。其次,选择检测项目包含蛋白质类、酶类、代谢物类、脂类、电解质类,覆盖范围广,且基本覆盖了生化检测的方法学类别[13]。再次,用临床可接受范围比统计学差异更符合生理特点。第四,考虑到了人员之间的差异,手动颠倒混匀4次可消除这种差异。最后是缩短解冻经验时间,提前完成质控,保证工作质量同时提早工作进程,优化工作效率。然而本研究仅在解冻1 h水平放置状态时做了人员间的比对,垂直放置及25 min条件下并未检测,是因为前一实验为后续实验提供人员间差异消除的基础。
4 结 论
冻存样本解冻后必须充分混匀,解冻时间不少于25 min,不同的实验人员对不同放置方式(水平或垂直)的冷冻样本颠倒混匀4次可达到完全混匀的状态。本实验建立了冻存样本解冻及混匀的一个统一方案,并为形成一套规范化操作规程提供研究基础。

