副溶血性弧菌MALDI-TOF-MS检测方法的建立与应用
韩 笑 刘 莉 王紫薇 汪 琦 赵晓娟 曾 静
(北京海关技术中心 北京 100026)
副溶血性弧菌(Vibrio parahaemolyticus,简称VP),隶属弧菌科弧菌属,是一种革兰氏阴性致病菌。该菌广泛分布在近海岸的海水、海底沉积物、海产品及腌制食品中[1]。人类主要因食用被污染的食品而感染副溶血性弧菌。患者往往会出现腹痛、腹泻、恶心、呕吐、发热等症状[2]。在我国,由副溶血性弧菌引起的腹泻或食物中毒,其暴发规模呈明显上升趋势[3]。目前,副溶血性弧菌检测手段主要以传统方法为主[4-5],以及基于核酸扩增的检测方法,例如:普通PCR方法[6]、实时荧光PCR方法[7-8]、LAMP方法等。传统方法以生化鉴定结果为依据,操作繁琐,耗时长;基于核酸扩增的检测方法虽然具有较好灵敏度,但是易于产生假阳性结果,PCR结果往往需要传统检测方法验证。
基质辅助激光解吸电离飞行时间质谱(Matrix-assisted laser desorption ionization time-offlight mass spectrometry,MALDI-TOF-MS)是近年来发展起来的一种全新的微生物检测技术[9]。其具体原理是细菌样品与基质溶液形成的共晶体在激光照射下发生电荷转移,使得样品分子电离,同质荷比(m/z)的离子在电场作用下加速飞过飞行管道,根据到达飞行时间检测器(TOF)时所用时间的不同而被分离和检测,测得的蛋白质及多肽质量指纹图谱与标准数据库比对,得到鉴定结果[10-11]。获得良好的质谱图是进行正确鉴定的前提[12],培养基、培养时间、样品处理方法等对微生物质谱图的峰型分布都有一定影响[13-14]。优化影响质谱图的各种因素,是得到正确鉴定结果的关键[15-16]。
本文利用MALDI-TOF-MS来检测副溶血性弧菌,并以2株副溶血性弧菌标准菌株为参考菌株,对菌株培养时间、温度及所用的培养基、前处理方法等影响谱图质量的主要因素进行研究[17-18]。建立副溶血性弧菌MALDI-TOF-MS检测方法,用461株副溶血性弧菌分离株对此方法的准确性进行验证。
1 材料与方法
1.1 材料
1.1.1 试验菌株 副溶血性弧菌参考菌株ATCC 17802,美国模式培养物集存库(American type culture collection,ATCC);CGMCC 1.1997,中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)。461株实验室自分离的副溶血性弧菌,经VITEK2Compact全自动微生物分析系统鉴定均为副溶血性弧菌。
1.1.2 试剂 甲酸(formicacid,FA)、乙腈(acetonitrile,ACN)、无水乙醇(色谱纯),美国Fisher公司;三氟乙酸(trifluoracetic acid,TFA)(色谱纯),德国Merck公司;校准蛋白干粉(protein calibration standard)、基质α-氰基-4-羟基肉桂酸(αcyano-4-hydroxy-cinnamic acid,HCCA),德 国Bruker公司;TCBS 琼脂(TCBS agar)、2%氯化钠-胰蛋白胨大豆琼脂(2%NaCl-tryptic soy agar,2%NaCl-TSA)、T1N1 琼脂(T1N1 agar),北京陆桥技术责任有限公司;科玛嘉弧菌显色培养基(CHRO MagarTMVibrio),法国科玛嘉公司。
1.2 仪器与设备
Friocell 222L培养箱,德国MMM公司;Centrifuge 5424型台式离心机,德国Eppendorf公司;基质辅助激光解吸电离飞行时间质谱仪(MicroflexTMMALDI-TOF-MS),德国Bruker公司。
1.3 试验方法
1.3.1 培养条件的确定 将副溶血性弧菌ATCC17802和CGMCC1.1997分别接种于2%NaCl-TSA、TCBS、T1N1和CHRO MagarTMVibrio 4种培养基,30℃和37℃培养 4,8,18,24 h。将不同培养条件下采集的两株参考菌株质谱图与MALDI Biotyper数据库相比对,获得最高匹配度鉴定结果,谱图基线平滑,信噪比高,蛋白质峰多的条件为最佳培养条件。
1.3.2 处理方法的确定 直接涂抹法:用无菌棉棒直接挑取单菌落,涂布于样品靶板上,同时点1 μL标准品溶液(校准),室温条件下晾干,再覆盖1μL HCCA溶液,晾干后进行质谱分析。
扩展直接涂抹法:用无菌棉棒直接挑取单菌落,涂于样品靶板上,室温条件下晾干,在上述样品点上覆盖1μL 70%甲酸水溶液,同时点1μL标准品溶液(校准),在室温下自然晾干,再覆盖1 μL HCCA溶液,晾干后进行质谱分析。
甲酸-乙腈提取法:挑取适量(约 5~10mg)菌落样品于1.5mL离心管中,加入300μL纯水,混匀,再加入900μL无水乙醇,混匀;12 000 r/min离心2min,弃去上清液;加入50μL 70%甲酸,仔细混匀,再加入50μL乙腈,仔细混匀,12 000 r/min离心2min,吸取1μL上清液点在靶板上,同时点1μL标准品溶液(校准),自然晾干后再点1 μL基质覆盖,晾干后进行质谱分析。
1.3.3 培养基对MALDI-TOF-MS质谱图背景信号的影响 选取4种培养基,在无微生物生长的区域,用无菌棉拭子接触培养基表面进行取样,后续处理方法相同,然后进行质谱分析。
1.3.4 MALDI-TOF-MS数据采集对样品进行数据采集并保存,每次试验前都要在采集数据的质量范围内使用肽蛋白标准品进行校准,校正后进行质谱数据采集。
仪器参数:选择线性操作模式,正离子模式;检测范围m/z 2 000~20 000 u;激光点击数:每张图谱240次;离子源加速电压:20 kV;激光频率:60.0Hz。
1.3.5 副溶血性弧菌MALDI-TOF-MS检测方法的稳定性试验 将副溶血性弧菌ATCC17802、CGMCC1.1997按照1.3.1和1.3.2节中确定的最适培养条件和样品处理方法,每个菌株重复测定10次,以考察最优条件下鉴定结果的稳定性。
1.3.6 副溶血性弧菌MALDI-TOF-MS检测方法的验证 用MALDI-TOF-MS检测方法对461株副溶血性弧菌分离菌株进行质谱分析,每株分离株做2个平行靶点。用Biotyper数据库获得鉴定分值,鉴定结果以对数值0~3作为评判分数,分值在2.000~3.000之间,表示可确认菌种鉴定结果;分值在1.700~1.999之间,表示可能的菌属鉴定或该菌种鉴定为不确定结果;分值在0.000~1.699之间,表示不可信的鉴定结果。对鉴定结果不是副溶血性弧菌或鉴定分值低于2.000的分离菌株进行实时荧光PCR方法鉴定,具体方法引用自《出口食品中食源性致病菌检测方法——实时荧光PCR法》(SN/T 1870-2016),并对鉴定结果进行对比。
2 结果与分析
2.1 最适培养条件的确定
2.1.1 不同培养基对副溶血性弧菌鉴定结果的影响 将参考菌株ATCC17802和CGMCC1.1997分别接种于T1N1、CHRO MagarTMVibrio、2%NaCl-TSA和TCBS 4种培养基,37℃培养24 h后进行MALDI-TOF-MS检测,比较不同培养基对检测结果的影响。结果表明,2株参考菌株经MALDITOF-MS鉴定全部为副溶血性弧菌(V.parahaemolyticus),ATCC17802鉴定分值分别为2.379,2.327,2.446,2.022,CGMCC1.1997鉴定分值分别为2.346,2.321,2.416,2.100。
TCBS培养基培养的副溶血性弧菌所得的MALDI-TOF-MS蛋白质指纹图谱和其它3种培养基有所差异,出峰数位点有所变化,并且鉴定分值略低于其它3种培养基。2%NaCl-TSA、T1N1和CHRO MagarTMVibrio这3种培养基培养的副溶血性弧菌经MALDI-TOF-MS检测得到的蛋白质谱图基本一致,图谱类型基本相同(图1),并且均能达到可完全确认菌株的鉴定结果。经2%NaCl-TSA培养的副溶血性弧菌MALDI-TOF-MS蛋白质谱图信噪比高,峰强度远高于T1N1和CHRO MagarTMVibrio培养的副溶血性弧菌,质谱图与数据库中的特征性质谱图匹配效果更好。
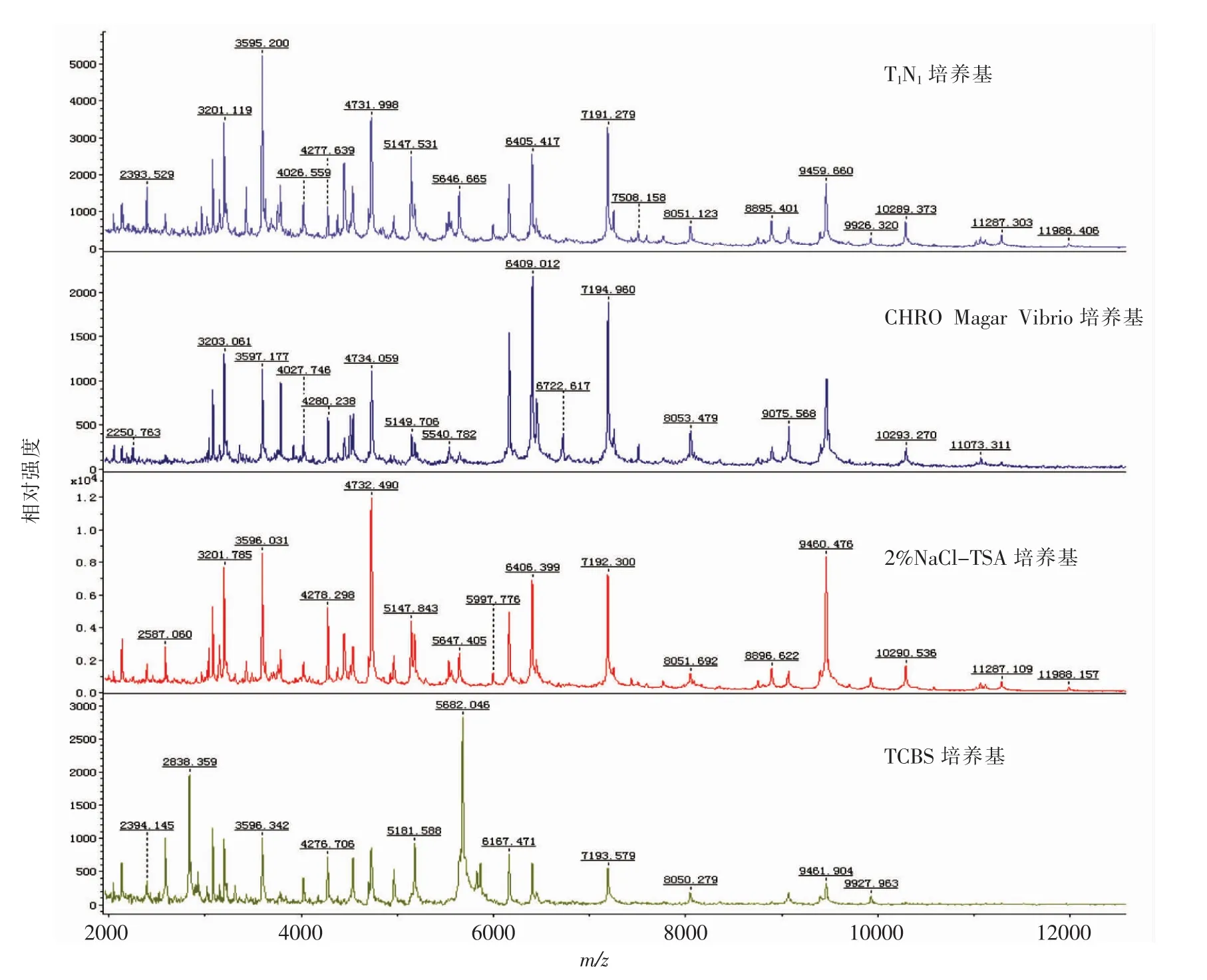
图1 不同培养基培养的副溶血性弧菌(ATCC17802)质谱图Fig.1 Mass spectrum of V.parahaemolyticus(ATCC17802)strains in different culture medium
2.1.2 不同培养温度对副溶血性弧菌鉴定结果的影响 将参考菌株ATCC17802、CGMCC1.1997接种于2%NaCl-TSA培养基,分别于30,37℃培养24 h后进行MALDI-TOF-MS检测,比较不同培养温度对检测结果的影响。结果表明,2株参考菌株经MALDI-TOF-MS鉴定全部为副溶血性弧菌(V.parahaemolyticus),ATCC17802 鉴定分值分别为2.210和2.475。CGMCC1.1997鉴定分值分别为2.259和2.432。30℃和37℃温度条件对副溶血性弧菌的鉴定结果没有影响。MALDI-TOF-MS蛋白质谱图基本保持不变,图谱类型基本相同(图2),经37℃培养的副溶血性弧菌MALDI-TOF-MS蛋白质谱图信噪比高,峰强度高于30℃培养的副溶血性弧菌,且质谱图与数据库中的特征性质谱图匹配效果更好。
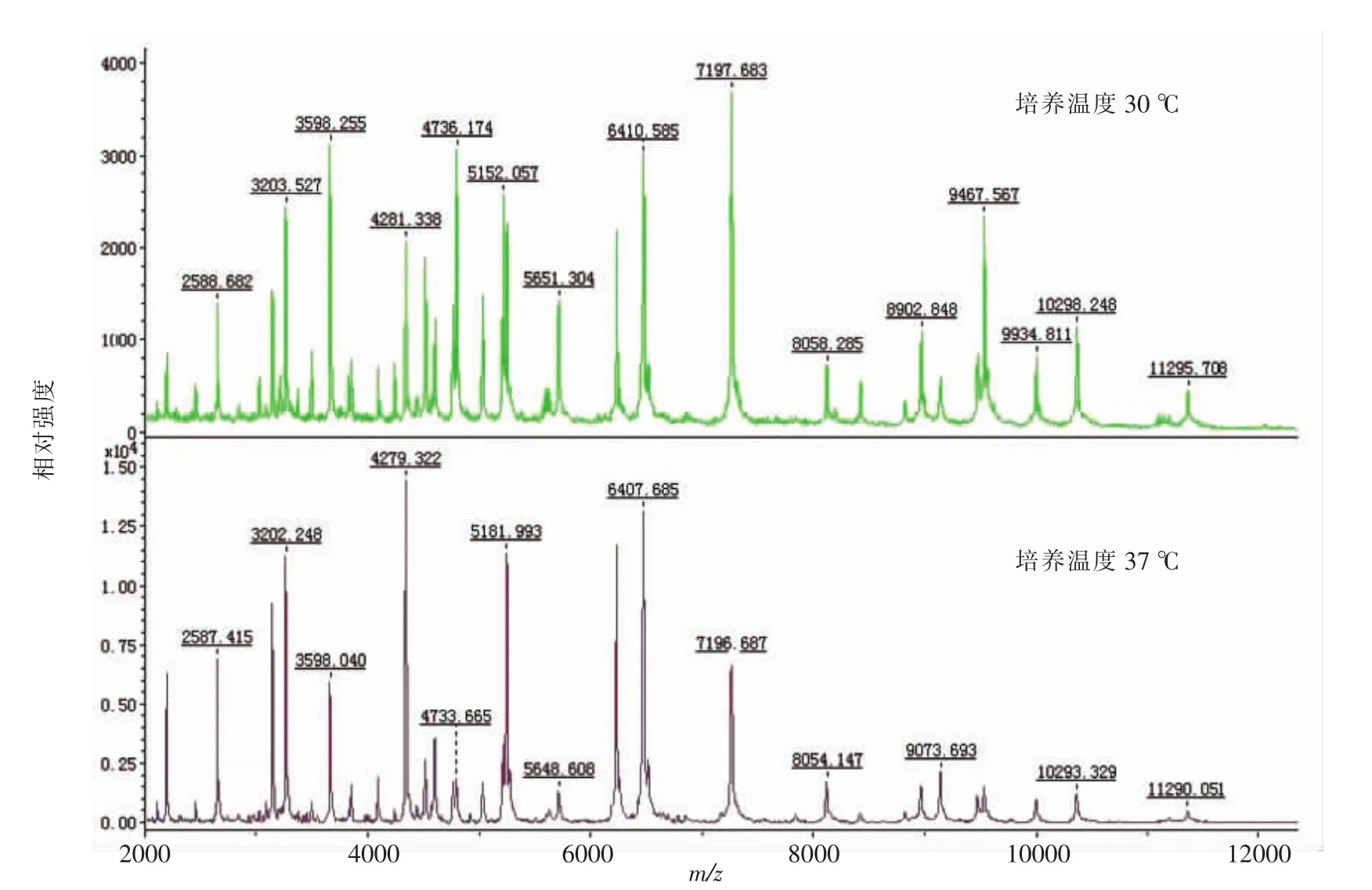
图2 不同培养温度的副溶血性弧菌(ATCC17802)鉴定质谱图Fig.2 Mass spectrum of V.parahaemolyticus(ATCC17802)strains in different temperature
2.1.3 不同培养时间对副溶血性弧菌鉴定结果的影响 将参考菌株ATCC17802、CGMCC1.1997于2%NaCl-TSA 培养基 37℃分别培养 4,8,18,24 h,对菌株进行MALDI-TOF-MS鉴定,比较培养时间对蛋白质谱图的影响。结果表明,2株参考菌株经MALDI-TOF-MS鉴定全部为副溶血性弧菌(V.parahaemolyticus),ATCC17802 鉴定分值分别为2.395,2.412,2.408和2.497,CGMCC1.1997 鉴定分值分别为2.365,2.398,2.402和2.481。在不同生长阶段的副溶血性弧菌经MALDI-TOF-MS检测得到的蛋白质谱图基本保持不变,图谱类型基本相同,都可以得到完全确认菌种的鉴定结果(图3)。随着培养时间的延长,峰强度逐渐升高、出峰数量有所增加。在培养24 h后的副溶血性弧菌MALDI-TOF-MS蛋白质谱图信噪比最高,出峰数量最多,且质谱图与数据库中的特征性质谱图匹配效果最好。
2.2 最适前处理方法的确定
以 ATCC17802、CGMCC1.1997作为参考菌株,在2%NaCl-TSA培养基上37℃培养24 h之后分别用直接涂抹法、扩展直接涂抹法和甲酸-乙腈提取法对副溶血性弧菌进行处理,然后对菌株进行MALDI-TOF-MS检测,比较不同处理方法对蛋白质谱图的影响。结果表明,2株参考菌株经MALDI-TOF-MS鉴定都为副溶血性弧菌(V.parahaemolyticus),ATCC17802 鉴定分值分别为2.074,1.903和2.394。CGMCC1.1997鉴定分值分别为2.186,1.899和2.408。这3种方法处理后的副溶血性弧菌经MALDI-TOF-MS检测得到的蛋白质谱图基本保持不变,图谱类型基本相同(图4),而甲酸-乙腈提取法处理的副溶血性弧菌MALDI-TOF-MS蛋白质谱图信噪比高,峰强度远高于直接涂抹法、扩展直接涂抹法处理的副溶血性弧菌,且质谱图与数据库中的特征性质谱图匹配效果更好,并达到可完全确认菌种的鉴定结果。
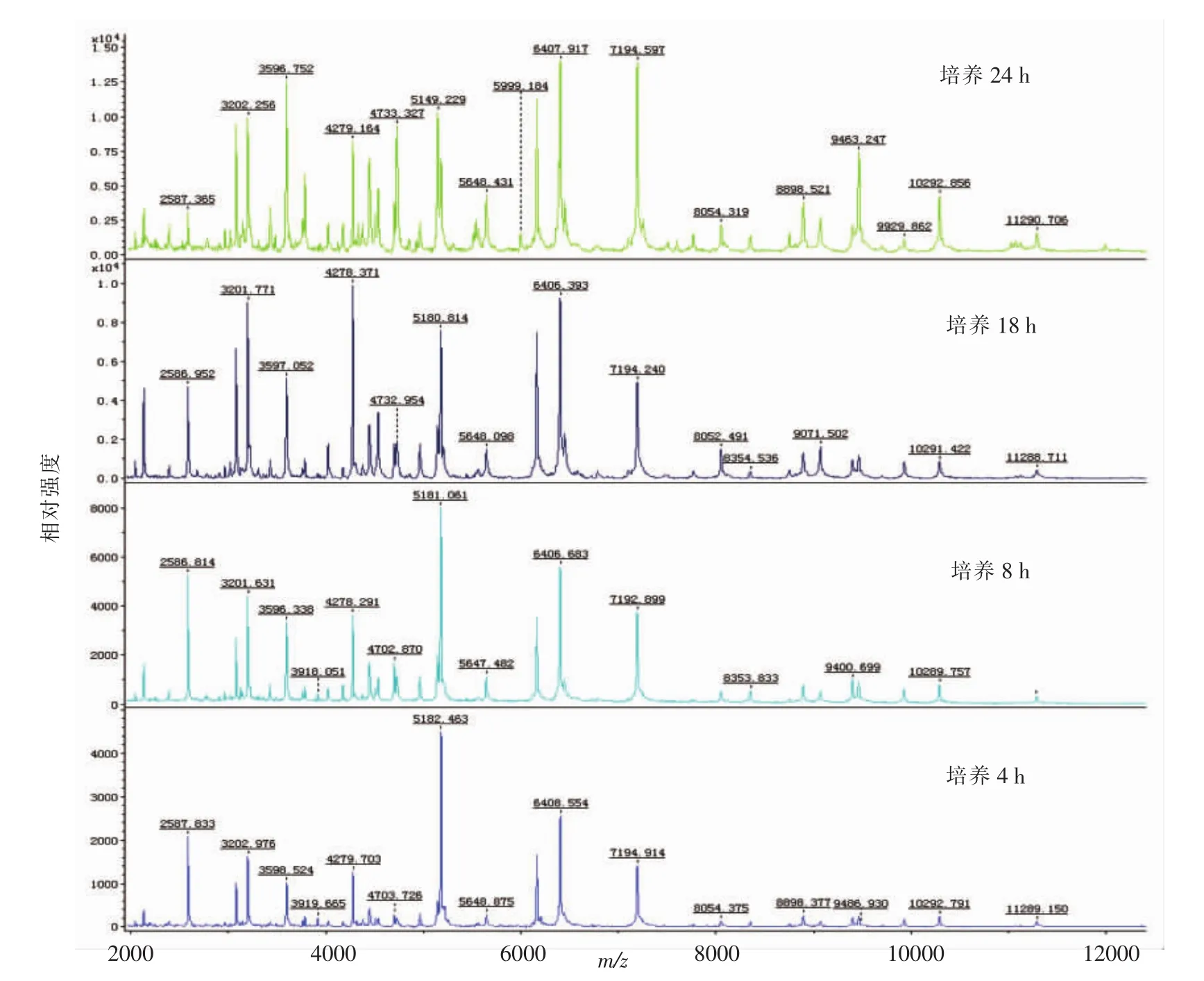
图3 不同培养时间培养的副溶血性弧菌(ATCC17802)鉴定质谱图Fig.3 Mass spectrum of V.parahaemolyticus(ATCC17802)strains cultured during different time
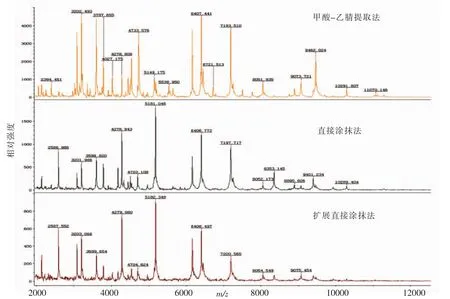
图4 不同处理方法的副溶血性弧菌(ATCC17802)鉴定质谱图Fig.4 Mass spectrum of V.parahaemolyticus(ATCC17802)strains cultured during different sample treatments
2.3 培养基对MALDI-TOF-MS质谱图信号的影响
选取未生长微生物的区域进行蛋白质量图谱的采集,单纯的培养基峰信号集中在m/z 2 000~4 000 u之间,将这些信号与培养24 h的微生物峰信号相比,培养基的峰信号不包含在微生物的特征峰中,所以不考虑培养基对副溶血性弧菌质谱图带来的影响。(图5)。
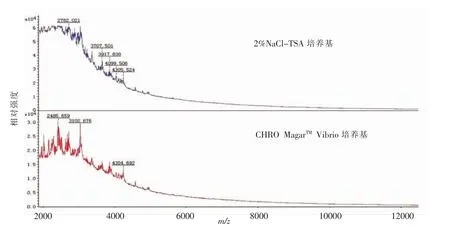
图5 不同培养基背景信号的质谱图Fig.5 Mass spectrum of different mediums
2.4 副溶血性弧菌MALDI-TOF-MS检测方法的稳定性试验
将ATCC17802、CGMCC1.1997接种于2%NaCl-TSA培养基,在37℃培养24 h后用甲酸-乙腈提取法对副溶血性弧菌进行处理,然后进行MALDI-TOF-MS检测,重复采集10次质谱图,确定该检测方法的稳定性。结果表明,2株参考菌株经MALDI-TOF-MS鉴定全部为副溶血性弧菌(V.parahaemolyticus),10次检测的鉴定分值比较接近均超过2.400,全部达到可完全确认菌种的鉴定结果,并且MALDI-TOF-MS质谱图变化也很小(图6)。这说明副溶血性弧菌MALDI-TOF-MS检测方法具有很好的稳定性,对于参考菌株ATCC17802、CGMCC1.1997的鉴定结果准确。
2.5 MALDI-TOF-MS检测方法准确性验证
对副溶血性弧菌MALDI-TOF-MS检测方法进行验证。结果表明,被测副溶血性弧菌分离株的MALDI-TOF-MS鉴定分值97.6%(450/461)大于2.000,报告为副溶血性弧菌。其余11株分离株鉴定结果不是副溶血性弧菌或鉴定分值低于2.000,针对11株分离株进一步采用实时荧光PCR方法进行鉴定,结果见表1。
3 讨论
副溶血性弧菌MALDI-TOF-MS检测方法建立中,在培养条件优化方面,采用2%NaCl-TSA、T1N1和CHRO MagarTMVibrio 3种培养基,30,37℃培养4,8,18,24 h对副溶血性弧菌的蛋白质谱鉴定结果没有明显影响,说明副溶血性弧菌对生长条件要求较宽泛。然而,从谱图中可以看出,各种条件下生长的副溶血性弧菌获得的质谱图的特征峰强度和数量方面略有差异。TCBS培养基对副溶血性弧菌的蛋白质谱鉴定分值略低于其它3种培养基,且谱图也明显有异于其它3种培养基。在不同培养基上生长的微生物,由于摄取的营养成分不同,蛋白质表达的种类和含量也有所差异,反映在质谱图上特征峰的数量、位置、强度和峰形不一,这与Rychert等[19]对于TCBS培养基培养后的弧菌经MALDI-TOF-MS检测后质谱图与其它培养基不一致结论相同。因此,要根据待鉴定菌株的实际情况选择最佳的培养基、培养温度和培养时间等条件。

图6 副溶血性弧菌参考菌株(ATCC17802)鉴定质谱图Fig.6 Mass spectrum and identification results of reference strains(ATCC17802)
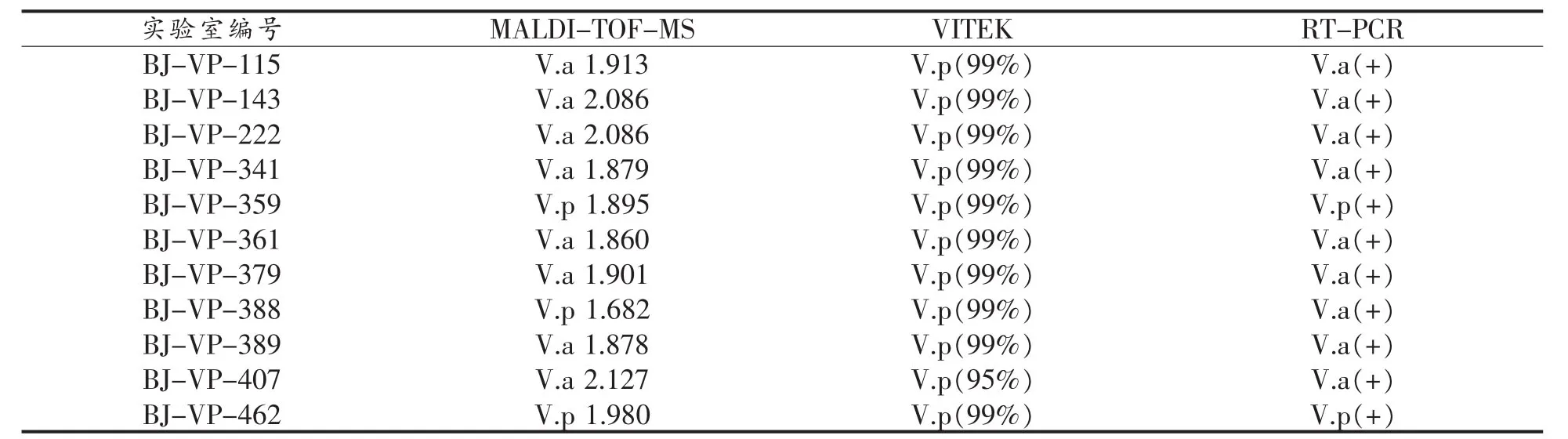
表1 11株副溶血性弧菌分离菌株检测结果Table1 Detection results of 11 strains of Vibrio parahaemolyticus isolates
在处理方法方面,直接涂抹法和扩展直接涂抹法虽然快速易操作,但易受菌体其它代谢物干扰[20],鉴定分值也略低(2.074、1.903);甲酸-乙腈提取法可以将副溶血性弧菌内部和表面的蛋白质提取出来[21-22],所得谱图提供的信息量多,离子峰的个数和强度均较好,从而得到较好的试验结果。
在对副溶血性弧菌MALDI-TOF-MS检测方法的验证中,有11株鉴定结果不是副溶血性弧菌或鉴定分值低于2.000。采用实时荧光PCR方法进一步鉴定,除BJ-VP-388外,其余10株分离株MALDI-TOF-MS检测方法与实时荧光PCR方法的鉴定结果一致。其中8株分离株鉴定结果为溶藻性弧菌(V.alginolyticus),与 VITEK2 Compact全自动微生物分析系统鉴定结果不一致,这是由于VITEK2 Compact全自动微生物分析系统在程序上检测到的生化反应组合模式与数据库中某种细菌编码吻合就会终止鉴定,这可能导致细菌在“种”水平上的鉴定出现错误,这与林杰等[23]在2016年发表的文章中对VITEK2 Compact全自动微生物分析系统在“种”水平鉴定出现错误的原因结论一致。BJ-VP-388用MALDI-TOF-MS检测方法与VITEK2 Compact全自动微生物分析系统鉴定结果一致,然而与实时荧光PCR方法的鉴定结果不一致。本研究将在后续试验中对这株分离株做进一步的全基因组测序,以确定这些分离株的正确种属。
本研究结果表明建立的副溶血性弧菌MALDITOF-MS检测方法用于鉴定副溶血性弧菌具有很好的重复性和稳定性,可以快速、准确地鉴定副溶血性弧菌。该方法与传统的鉴定方法相比较,具有操作简单、高通量、快速等优点[24-25]。因此,该方法可用于副溶血性弧菌的日常检测和鉴定。

