珊瑚菌子实体多糖结构鉴定与抗氧化活性
(浙江工业大学 海洋学院,浙江 杭州,310014)
珊瑚菌,泛指子实体直立,呈简单棒状、珊瑚状、片状、角状、甚至猴头状的一类腐生或土生的真菌[1],隶属珊瑚菌科。珊瑚菌营养丰富,功能性物质种类较多,具有较好的医用价值及保健功效[2-3]。研究表明,从珊瑚菌子实体和菌丝体中得到的多糖具有抗氧化活性[4-6]。目前,对于珊瑚菌的研究多限于资源调查、鉴定分类、液体培养、大分子物质提取工艺及化学成分的研究,关于珊瑚菌多糖纯化的研究也有过报道[7-10]。董芳等[11]采用热水浸提法提取珊瑚菌多糖,经树脂脱色、醇沉、Sevage法脱蛋白、DEAE-52柱层析和蒸馏水透析得到多糖RBP-I。
笔者采用水提醇沉法从珊瑚菌中提取粗多糖,再经DEAE sepharose fast flow离子柱、Sephacryl G-25和S-400 High-resolution凝胶柱进一步分离纯化,得到均一多糖RFPF2A,此前关于该多糖组分的研究还未见报道。采用红外光谱扫描(IR)、高效液相色谱(HPLC)、气相色谱-质谱联用(GC-MS)、核磁共振(NMR)分析其结构及单糖组成。通过不同的抗氧化试验方法测定了RFPF2A的羟基自由基清除能力、超氧阴离子清除能力、亚铁离子金属螯合能力和总还原力,为珊瑚菌多糖用于保健食品和医药产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
珊瑚菌子实体干品(Ramariaflava)购于四川省川珍实业有限公司;填料DEAE-sepharose fast flow,Sephacryl G-25和S-400 High-resolutuion购于美国GE公司;吩嗪硫酸钾脂(PMS)、还原型辅酶(NADH)、氯化硝基四氮唑兰(NBT)、硫代巴比妥酸(TBA)、菲咯嗪、脱氧核糖、葡聚糖、三氟乙酸(TFA)和单糖标准品(L-鼠李糖(L-Rha)、L-阿拉伯糖(L-Ara)、L-岩藻糖(D-Fuc)、D-葡萄糖(D-Glc)、D-木糖(D-Xyl)、D-半乳糖(D-Gal)、D-甘露糖(D-Man))购于美国Sigma-Aldrich化学试剂公司;其他试剂均为国产分析纯。
1.2 主要仪器设备
高效液相色谱柱TSKgel G4000PWXL,日本TOSOH公司;傅里叶红外光谱仪(Nicolet 6700),Nicolet Continu μm红外显微系统,Thermo Electron公司;AVANCE III傅里叶超导核磁共振波谱仪,瑞士Bruker公司;XK 16 mm×100 cm、XK 26 mm×100 cm层析柱,美国GE公司;Finnigan Trace Ultra-DSQ II气相质谱联用仪,气相柱采用TG-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),美国Thermo Fisher公司。
1.3 方 法
1.3.1 珊瑚菌均一多糖RFPF2A的制备
取珊瑚菌子实体干品600 g,0.45 mm过筛,25 ℃下用10倍体积的95%乙醇(体积分数)脱脂12 h。脱脂后加入25倍蒸馏水,沸水提取2 h,过滤,收集清液,再加入95%乙醇进行分级醇沉,冷冻干燥后得到粗多糖RFPF30,上清液继续加入95%乙醇至终体积分数达到60%,得到粗多糖RFPF60。采用DEAE sepharose fast flow离子柱、Sephacryl G-25和S-400 High-resolution凝胶柱层析对RFPF60进行分离纯化得到均一性多糖RFPF2A[12]。
1.3.2 RFPF2A分子质量的测定
采用高效液相色谱法测定RFPF2A分子质量[13]。高效液相色谱系统:Water 1525,色谱柱TSKgel G4000PWXL,示差检测器Water 2414,以超纯水为流动相,流速为1 mL/min,样品进样量为1 μL,柱温(30.0±0.1) ℃。
准确称取分子质量已知的T-系列Dextran标准品(分子质量分别为1,5,12,80,150,270,670 kDa),将各标准品用超纯水溶解,配制成2 mg/mL的标准品溶液,用0.45 μm微孔滤膜过滤后进样。以多糖标样的保留时间(min)为横坐标、以lgMw为纵坐标制作标准曲线图。
1.3.3 单糖组成分析
采用气相色谱-质谱联用法分析RFPF2A组分的单糖组成。根据何晋浙等[14]试验方法进行乙酰化实验。乙酰化后的产物使用Trace 1300/ISQ气相-质谱联用色谱仪进行分析,检测器为氢火焰离子检测器(FID),色谱柱采用TG-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),载气为高纯氮气,流速为1.0 mL/min。温度程序设定为:初始温度120 ℃保持1 min,以10 ℃/min升温至240 ℃,保持6.5 min。接口温度、离子源温度定为250 ℃,1.0 μL进样,分流比1∶30,质量扫描范围40~500 amu,扫描时间0.28 s。
标准单糖样品乙酰化:精确称量等摩尔(2 mmol/L)单糖标品(L-Rha,L-Ara,L-Fuc,D-Glc,D-Xyl,D-Gal,D-Man)分别溶于3 mL蒸馏水中,配制成单糖的单标溶液;精确称量等摩尔(2 mmol/L)单糖标品(L-Rha,L-Ara,L-Fuc,D-Glc,D-Xyl,D-Gal,D-Man)混合溶于3 mL蒸馏水中,配制成单糖的混标溶液。加入适量硼氢化钠后密封并间歇振荡3 h,后用冰醋酸中和过量的NaBH4。加入少量甲醇混匀并减压蒸干,真空干燥器中静置24 h,110 ℃烘箱干燥15 min,后加入4.0 mL醋酐,100 ℃下反应1 h。冷却至室温后加入甲苯,减压蒸干。用氯仿溶解后加入等体积蒸馏水充分混匀,加入适量无水硫酸钠干燥,过0.45 μm有机膜待GC-MS分析。
样品乙酰化:2 mg样品用TFA(2 mol/mL,4 mL)110 ℃水解2 h,用甲醇夹带旋干TFA,加入30 mg NaBH4,后续与标准单糖乙酰化步骤相同。
样品甲基化:2 mg多糖样品溶于0.5 mL DMSO中,加入0.6 mL NaOH-DMSO(0.025 g/mL)和0.6 mL 碘甲烷进行甲基化反应[15]。
1.3.4 红外光谱分析
称取2 mg多糖纯品,放入真空干燥器中过夜以除去多余水分,用溴化钾压片后进行红外光谱扫描,扫描波长范围选择400~4 000 cm-1。
1.3.5 核磁共振分析
称量多糖样品30 mg,用0.5 mL重水(D2O)溶解,重复冻干,D2O复溶3次,采用500 MHz核磁共振仪测定,25 ℃lH NMR用HDOδ为内标,13C NMR的化学位移用饱和3-三甲基硅丙烷磺酸钠的重水溶液(D2O+DSS)为外标[16]。
1.4 抗氧化实验
1.4.1 羟基自由基清除能力
参照Chen等[17]的方法测定。样品溶解于蒸馏水中使样品质量浓度为0~5.0 mg/mL,0.2 mol/L pH值为7.4的磷酸盐缓冲液,2.67 mmol/L脱氧核糖和0.13 mmol/L EDTA混合配成反应缓冲溶液。取0.1 mL样品溶液与0.6 mL反应缓冲液混合,依次添加0.2 mL 0.4 mmol/L的亚铁硫酸铵,0.05 mL 2.0 mmol/L的抗坏血酸以及0.05 mL 20 mmol/L的H2O2。反应体系在37 ℃下反应15 min。然后向混合物中加入1 mL 10 g/L的TBA,1 mL 20 g/L的TCA。涡旋振荡后,沸水浴15 min,然后在冰水浴中冷却。在532 nm处测定其吸光度。抗氧化活性(AA)用羟基自由基清除能力表示,其计算公式为
(1)
式中:A样品表示被测样品的吸光度;A空白表示以去离子水代替样品的空白吸光度。
1.4.2 超氧自由基清除能力
参考Jia等[18]的方法测定。将样品溶于蒸馏水中使样品质量浓度为0~5.0 mg/mL,配制16 mmol/L,pH 8.0的Tris-HCl,分别取0.1 mL各质量浓度的样品溶液,依次加入含557 μmol/L NADH的Tris-HCl 1 mL,含45 μmol/L PMS的Tris-HCl 1 mL,含108 μmol/L NBT的Tris-HCl 1 mL。在25 ℃水浴条件下恒温反应5 min,测定560 nm处的吸光度。按照上述式(1)计算超氧自由基清除能力。
1.4.3 亚铁离子金属螯合能力测定
参考Gao等[19]的方法测定。1 mL不同质量浓度的样品(0~5.0 mg/mL)与3.7 mL甲醇,0.1 mL 2 mmol/L FeCl2混合,加入0.2 mL 5 mmol/L的菲洛嗪触发反应,室温下高速振荡10 min,在562 nm处测定吸光度。吸光度越低表示螯合能力越强。按照上述式(1)计算亚铁离子螯合能力。
1.4.4 还原力测定
参照吴振等[20]的方法测定。配制质量浓度为0~5.0 mg/mL的样品。分别取2.5 mL样品,加入2.5 mL pH值为6.6,浓度为0.2 mol/L的磷酸盐缓冲液,2.5 mL 10 g/L的K3Fe(CN)6,混合后在50 ℃下水浴20 min。加入2.5 mL 100 g/L的TCA终止反应,离心10 min,取上清液加5 mL水和1.2 mL 1 g/L的FeCl3,振荡混匀,在700 nm处测定吸光度。
2 结果与分析
2.1 RFPF2A结构分析
2.1.1 RFPF2A相对分子质量的测定
RFPF2A的高效液相色谱图如图1所示,RFPF2A的洗脱谱图呈对称峰,由此判断其为均一组分的多糖。通过峰面积计算表明多糖的纯度达到90%以上,RFPF2A保留时间为6.582 min,根据保留时间计算得到分子量为9.87×102kDa。
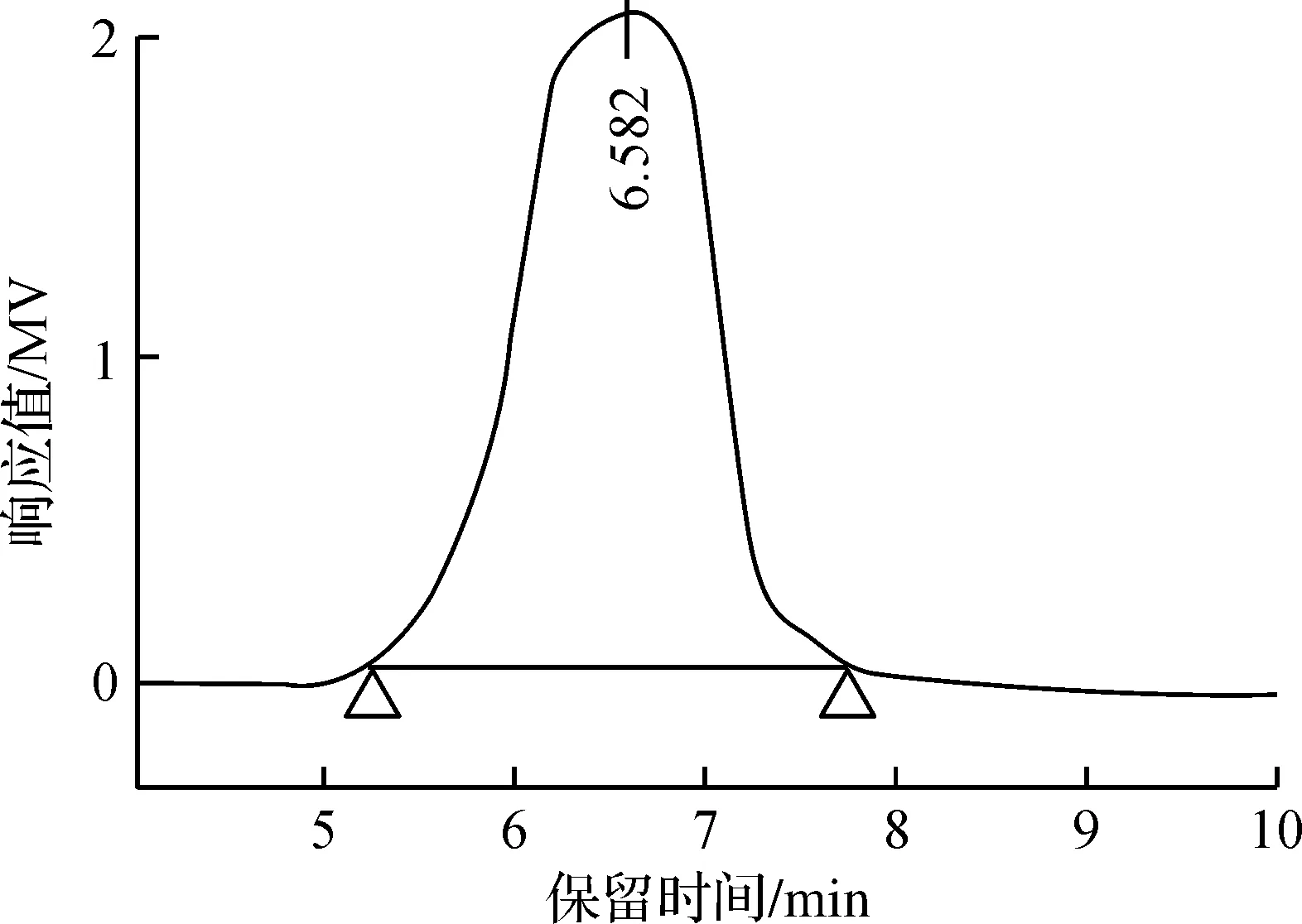
图1 RFPF2A的HPLC曲线Fig.1 Curve of RFPF2A with HPLC
2.1.2 RFPF2A单糖组成分析
7 种单糖混标的GC-MS谱图如图2所示,由表1和图2确定混标中各单糖的出峰顺序依次为L-鼠李糖、L-阿拉伯糖、L-岩藻糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖。表1中的RSD1为6 次重复试验的相对标准偏差值,RSD2为6 次平行试验的相对标准偏差值,两个相对标准偏差RSD1和RSD2均小于5%,说明本实验采用的乙酰化方法可操作性较好,可用于后续实验分析。
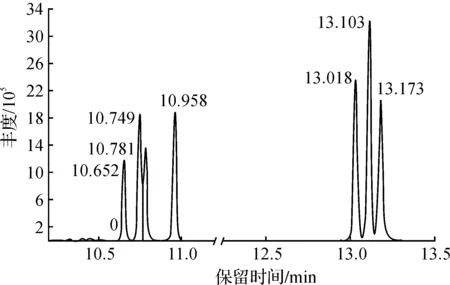
图2 混合标准品乙酰化衍生物的气质色谱图Fig.2 GC-MS of acetyl derivatives of complex standard monosaccharides
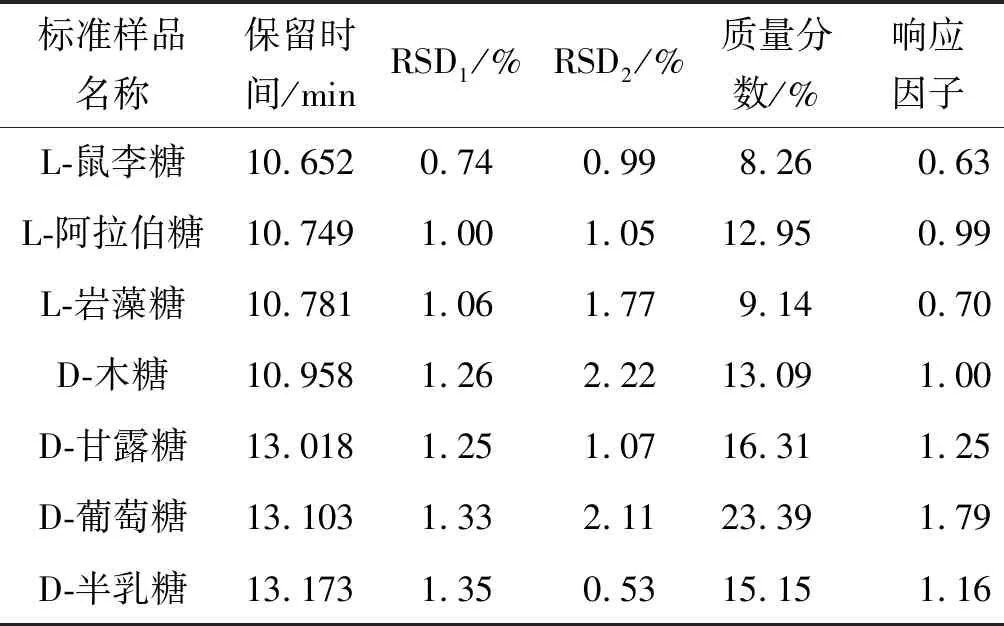
表1 混合标准品气相色谱结果及分析Table 1 Results and analysis of the monosaccharides in standard sample
RFPF2A的气质谱图如图3所示,通过与混标谱图及各个峰保留时间处的质谱图对比可知:RFPF2A主要含有D-葡萄糖,另外还含有少量的D-半乳糖、D-甘露糖,其摩尔比为1.00∶0.15∶0.26。董芳等[11]通过热水浸提、树脂脱色、分级醇沉和脱蛋白后得到均一多糖组分RBP-I,其分子质量为15 857 Da,主要由鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,其摩尔比为1.00∶6.53∶1.99∶8.29∶70.05∶53.80。分析原因,可能是因为原料来源及提取方法不同,从而得到的多糖组分结构存在差异性。
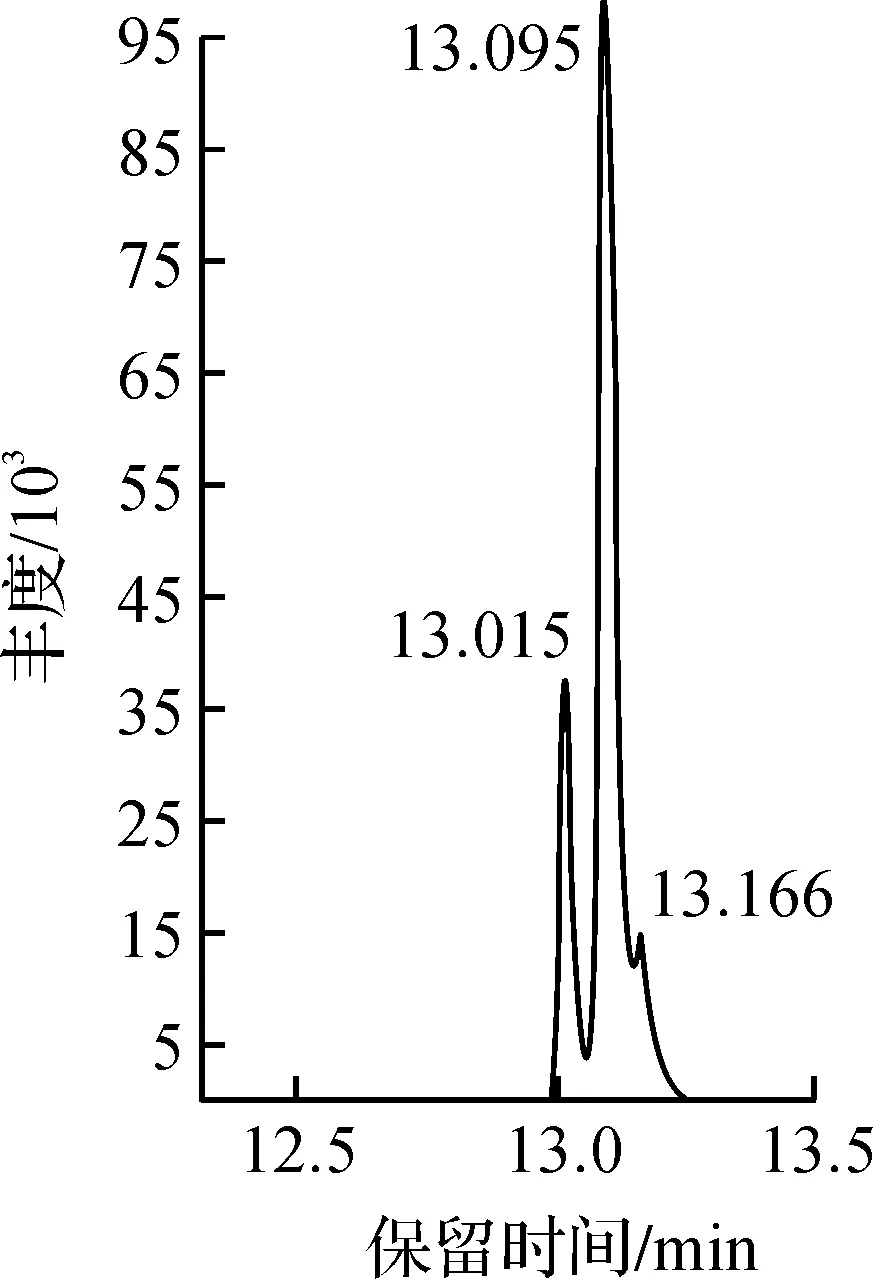
图3 RFPF2A的乙酰化衍生物的气质谱图Fig.3 The GC-MS spectrum of acetyl derivatives from RFPF2A
2.1.3 RFPF2A甲基化分析
表2显示的是RFPF2A甲基化单糖以及单糖连接位点。多糖经两次酸水解的甲基化之后,部分甲基化的糖成为甲基化糖醇乙酸酯。由甲基化分析的最终结果得出RFPF2A的糖残基是由2,3,6-三-O-甲基化甘露糖,3,4-二-O-甲基化半乳糖和2,3,4-三-O-甲基化葡萄糖组成。
表2 RFPF2A的甲基化分析结果Table 2 Results of methylation analysis of RFPF2A
2.1.4 红外光谱分析

图4 RFPF2A的红外光谱分析Fig.4 IR spectra of RFPF2A
2.1.5 核磁共振分析
NMR是主要用于解释多糖结构中糖苷键的构型和重复结构单元中单糖数目的一种分析方法[27-28]。图5(a)为RFPF2A 25 ℃的1H NMR谱,从图中可知:RFPF2A在异头氢区的共振区域主要有一个异头氢的共振峰,且裂分为δ=4.48和δ=4.50的两个峰,在δ=4.69处有一个强的HDO的共振峰,为了避免强HDO峰掩盖部分异头氢的信号,采用图5(b)60 ℃的1H NMR谱与其进行比较。比较图5(a)和图5(b),发现主要有一个异头氢δ=4.53的共振峰,此外还有含量很低的两个小振动峰,此外还可以发现无氧甲基信号,主要的残基C裂分为两个峰,且J1,2约为8 Hz,说明其为β-吡喃葡萄糖构型,与红外光谱分析结果相符。
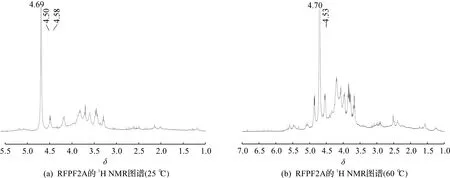
图5 RFPF2A的1H NMR图谱Fig.5 1H NMR spectra of RFPF2A
糖的异头碳信号在δ为100.71~104.26区域,参考13C NMR谱图6(a)可知,在δ=105.79处有一明显异头碳,另外两异头碳不明显。13C NMR 谱上δ为82~88处无共振信号,说明糖残基为吡喃型糖苷。从13C NMR谱的DEPT-135谱图6(b)可知:在δ=71.64处出现反峰,说明该组分含六位取代的残基,而δ=63.45处负峰为六位未取代的碳信号,结果与甲基化分析结果相符。

图6 RFPF2A的13C-NMR图谱Fig.6 13C-NMR spectra of RFPF2A
2.2 RFPF2A抗氧化活性
2.2.1 羟基自由基清除能力
羟基自由基是活性氧中最活泼的自由基,也是毒性最大的自由基,几乎能与活细胞中任何分子发生反应,对于筛选、评价具有清除自由基能力的功能食品有着重要意义。RFPF2A的羟基自由基清除能力如图7所示,由图7可知:RFPF2A具有一定的清除羟基自由基的能力,且随着质量浓度的增加而增加。王丽娟等[4]以珊瑚菌为原料,研究了珊瑚菌多糖的提取及其对羟自由基的清除作用,发现当粗多糖的质量浓度为5 mg/mL时,羟基自由基清除能力可达到60%以上,说明经本实验分离纯化后的珊瑚菌多糖RFPF2A清除羟基自由基的能力明显高于同质量浓度的珊瑚菌粗多糖,有着较好的羟基自由基清除能力。
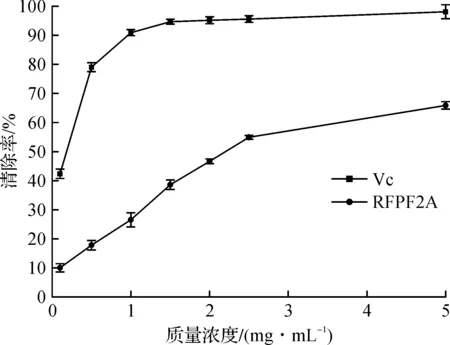
图7 RFPF2A对羟基自由基的清除能力Fig.7 Hydroxyl radical scavenging ability of RFPF2A
2.2.2 超氧阴离子清除能力
在细胞的氧化反应中,通常首先形成的是超氧自由基,当产生其他类型的细胞损坏自由基和氧化物质时,其对细胞的破坏效果更大。加入抗氧化剂会引起吸光度值的下降,表明混合物中的超氧阴离子自由基被消耗。RFPF2A的超氧阴离子清除能力如图8所示,实验表明:随着样品质量浓度的增加,RFPF2A对超氧阴离子的清除能力也随之加强。在低质量浓度时Vc的清除能力明显优于RFPF2A,当质量浓度为2.5 mg/mL时,RFPF2A对超氧阴离子自由基的清除率为51.6%,高于相同质量浓度的米胚多糖对超氧阴离子自由基的清除能力[29]。当质量浓度达到5 mg/mL时RFPF2A的清除能力达到74.47%,说明RFPF2A的超氧阴离子清除能力较好。

图8 RFPF2A对超氧阴离子的清除能力Fig.8 The ability of RFPF2A to remove superoxide anions
2.2.3 亚铁离子金属螯合能力
铁离子在生物体内能够引发脂质过氧化,并导致羟基自由基的产生,因此铁离子鳌合能力也是一个重要的评价抗氧化能力的指标。RFPF2A的亚铁离子金属螯合能力如图9所示,随着质量浓度的增加,RFPF2A对金属的螯合能力逐渐加强;当RFPF2A达到最高质量浓度5 mg/mL时,它的螯合能力达到61.82%,高于同质量浓度蛹虫草多糖的螯合能力[30],说明RFPF2A具有较好的亚铁离子螯合能力。
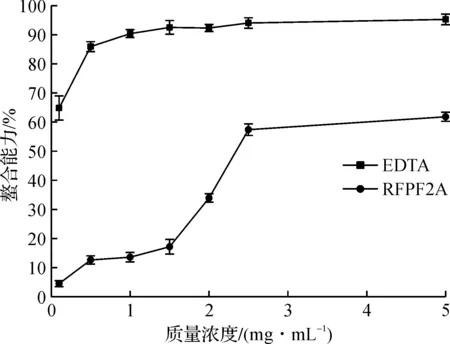
图9 RFPF2A的金属螯合能力Fig.9 Metal chelation capabilities of RFPF2A
2.2.4 还原力
化合物的还原力可作为化合物具有潜在抗氧化活性的重要指标。RFPF2A的还原力如图10所示,结果显示:RFPF2A具有较强的还原力作用,且还原力与多糖质量浓度呈正相关,随着质量浓度的上升RFPF2A还原力作用增强。当RFPF2A质量浓度为2 mg/mL时,其还原力吸光值达到1.106,明显大于同质量浓度下虎斑乌贼肌肉多糖的还原力吸光值[31];且当RFPF2A质量浓度为5 mg/mL时,其还原力吸光值达到1.506,基本与Vc相同。

图10 RFPF2A的还原力Fig.10 Reducing power of RFPF2A
3 结 论
通过水提醇沉法提取RFPF60组分,再经DEAE-sepharose fast flow离子柱、Sephacryl G-25和S-400 High-resolution凝胶柱层析进一步分离纯化得均一多糖组分RFPF2A;通过HPLC得RFPF2A平均分子质量为9.87×102kDa;乙酰化结果得出RFPF2A多糖由D-葡萄糖、D-半乳糖和D-甘露糖组成,其摩尔比为1∶0.15∶0.26;甲基化分析RFPF2A主要由1,6连接的葡萄糖构成,此外还有少量1,4连接的甘露糖和少量1,2,6连接的半乳糖;由核磁共振分析得出,葡萄糖为β-吡喃构型,半乳糖是α-构型,甘露糖是β-构型。另外通过不同种类的抗氧化实验证明了均一多糖RFPF2A具有一定的抗氧化活性,并且抗氧化活性与其质量浓度呈正相关。本研究为珊瑚菌作为潜在功能性食品原辅料提供科学依据,关于珊瑚菌活性与结构的对应关系,还有待后续进一步研究,从而能够更加科学合理地开发利用珊瑚菌资源。

