高压微射流处理对大豆分离蛋白结构功能特性及其乳液性质的影响
朱明明,宁方建,温平威,熊 华,赵 强
(南昌大学 食品科学与技术国家重点实验室, 南昌 330047)
大豆分离蛋白(SPI)是以豆粕为原料,采用碱提酸沉法制备的一种大豆蛋白制品,具有极高的营养价值和优良的功能性质。随着国民生活水平的提高,大豆蛋白经常被用于食品添加剂来改善食品的品质,在食品的众多领域中被广泛地研究与应用。然而,大豆蛋白的功能特性一般较差,在一定程度上制约了其应用范围[1]。大豆分离蛋白的自身结构会对其功能性质产生很大的影响,也会影响大豆蛋白制品的感官特性[2]。因此,对大豆分离蛋白进行改性在食品生产与加工保藏方面具有重要作用[3]。
高压微射流技术是一种良好的物理改性方式。高压技术是通过柱塞作用将物料分散到可以分别调节压力大小的阀组中,流经工作区后,失去压力的物料以1 000~1 500 m/s的速度喷出,然后碰撞在冲击环上,产生剪切、空穴等作用从而把物料破碎的一种技术[4]。在样品进行处理的过程中,物料同时受到多种机械力作用及其热效应,从而诱导生物大分子结构及其性质发生变化[5]。近年来,高压微射流技术被广泛应用于大分子的改性。涂宗财等[6]研究了超高压微射流均质对蛋清蛋白溶液粒度和流变性的影响,结果表明处理后的蛋清蛋白粒度、黏度都会发生变化。李杨等[7]研究了低压均质处理对大豆分离蛋白溶解性及结构的影响,结果表明低压均质处理能够降低大豆分离蛋白的粒径,显著改善溶解性。Subirade等[8]发现高压均质处理对β-乳球蛋白二级结构的影响较小,但对其三级结构的影响比较显著。Iordache等[9]探讨了高压微射流处理对变性乳蛋白溶液结构以及功能性质的影响,研究表明高压微射流处理可以使蛋白质的粒径降低,提高了蛋白质的溶解性。
目前,国内对于大豆蛋白乳液的研究越来越多[10-11],但是对高压微射流处理对大豆蛋白结构或乳化性影响的相关研究较少。因此,本文研究高压微射流处理对大豆分离蛋白结构、功能性质及乳液性质的影响,对大豆制品的加工与应用具有重要的理论与实际意义。
1 材料与方法
1.1 实验材料
脱脂豆粕,哈高科大豆食品有限责任公司;一级大豆油,中粮福临门食品营销有限公司。1-苯胺基-8-萘磺酸,Sigma公司;福林酚试剂,北京索莱宝科技有限公司;磷酸二氢钾、磷酸二氢钠、氯化钠、盐酸、氢氧化钠、十二烷基硫酸钠(SDS)、 异辛烷、异丙醇、甲醇、丁醇、硫氰酸铵、氯化钡、硫酸亚铁、异丙苯氢过氧化物、三氯乙酸、硫代巴比妥酸、1,1,3,3-四乙氧基丙烷等,均为分析纯。
T18高速分散机,美国 IKA公司;M-110EH微射流均质机,美国 MFIC公司;Nano-ZSE马尔文粒度电位仪,英国Malvern公司;F4500型荧光分光光度计,日本日立公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备
大豆分离蛋白(SPI)的制备采用碱提酸沉法,并稍作改动。称取 200 g豆粕粉分散于3 L去离子水(质量体积比1∶15)中,用2 mol/L NaOH溶液调pH至7.5,在室温下搅拌1 h,离心(8 000×g,20 min,4℃),弃沉淀物。将上清液pH调至4.5,离心(5 000×g,10 min,4℃),弃其上清液,所得沉淀物经两次水洗(pH 4.5)后,分散于适量的去离子水中,调pH至7.5。充分溶解后置于去离子水透析24 h,冷冻干燥后于-20℃贮存备用。
1.2.2 高压微射流处理
称取一定量的SPI溶解于去离子水中,配成10 mg/mL的SPI溶液。采用高压微射流均质机,分别于 0、35、65、95、125、155 MPa条件下循环均质3次。处理后的SPI溶液冷冻干燥,-20℃贮存备用。
1.2.3 SPI乳液的制备
配制50 mg/mL的SPI溶液,用高压微射流在不同压力(0、35、65、95、125、155 MPa)条件下进行处理。然后分别向上述处理过的溶液中加入体积分数20%的大豆油,混合液用高速分散机(12 000×g)分散10 min后,于35 MPa下进行微射流处理2次,即得到新鲜乳液。将新鲜乳液在37℃烘箱中储存10 d,分别在0、1、3、5、7、10 d时对其油脂氧化状况进行分析测定。
1.2.4 SPI的性质分析
1.2.4.1 粒径测定
参照张媛等[12]的测定方法,采用马尔文粒度电位仪测定SPI的粒径分布。用 50 mmol/L 的中性磷酸盐缓冲液将SPI溶液样品稀释到1 mg/mL,在室温(20℃)条件下进行测量。
1.2.4.2 荧光光谱分析
根据蒋将等[13]的方法,将20 mg/mL SPI溶液稀释在0.01 mol/L pH 7.0 的磷酸盐缓冲液中,终质量浓度调整为1 mg/mL,采用荧光分光光度计在激发波长290 nm(狭缝宽5 nm)条件下以20 nm/s的扫描速度得到300~400 nm 之间的发射光谱(狭缝宽5 nm),以pH 7.0的0.01 mol/L的磷酸盐缓冲液为空白。
1.2.4.3 表面疏水性的测定
采用1-苯胺基-8-萘磺酸荧光探针法测定表面疏水性。将SPI样品溶解于0.01 mol/L、pH为7.0的磷酸盐缓冲液中,质量浓度范围为0.1~2.0 mg/mL。取样品液2 mL,加入50 μL的ANS振荡,静置5 min。设定激发波长为360 nm(狭缝校正5 nm),发射波长为480 nm(狭缝校正5 nm),测定荧光强度。以荧光强度对蛋白质质量浓度作曲线,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数。
1.2.4.4 溶解性的测定
溶解性测定根据Zhao等[14]的方法,稍作改动。取0.2 g样品溶解于20 mL去离子水中,搅拌 30 min后调节pH至中性,再搅拌30 min,离心(5 000×g)10 min,取适量上清液稀释,用福林酚法测定上清液中蛋白质含量,以BCA为标准蛋白。
溶解性=上清液中蛋白质含量/样品总蛋白质含量×100%
1.2.4.5 乳化性与乳化稳定性的测定
采用比浊法测定乳化性及乳化稳定性。在圆底离心管中加入1 mg/mL的样品溶液16 mL和4 mL大豆油,用匀浆机以12 000 r/min高速剪切1 min,立即从底部0.5 cm处移取乳状液50 μL, 加入1 mg/mL SDS溶液5 mL稀释,涡旋振荡混匀,在500 nm处测吸光值(A0),10 min后再次移取50 μL乳状液,用SDS溶液稀释后测定其吸光值(A10)。按下式计算SPI的乳化性(EAI,m2/g)及乳化稳定性(ESI,%)。
(1)
ESI=A10/A0×100%
(2)
式中:C为样品溶液质量浓度,1 mg/mL;Φ为油相所占体积分数,0.20。
1.2.5 SPI乳液的性质分析
1.2.5.1 乳液粒径的测定
采用马尔文粒度电位仪对制备的新鲜乳液进行粒径测定,用蒸馏水作为分散介质,每次测定重复3次。
1.2.5.2 乳液Zeta电位的测定
将新鲜乳液用蒸馏水稀释100倍,采用 Malvern Zetasizer Nano ZS (ZEN 3600)测定仪测定乳液Zeta电位。每个样品测定重复3次,取平均值。
1.2.5.3 氢过氧化物的测定
参考Shantha等[15]的方法。取0.3 mL乳液于小离心管中,加入1.5 mL异辛烷和异丙醇的混合物(异辛烷和异丙醇的体积比为3∶1),充分振荡(10 s,3次),然后进行离心(1 000×g,2 min),取有机层(上层清液)200 μL,加入到2.8 mL 体积比为2∶1的甲醇和丁醇混合物中,然后再分别加入15 μL 3.94 mol/L的硫氰酸铵和15 μL 二价铁离子溶液(0.132 mol/L氯化钡和0.144 mol/L硫酸亚铁以1∶1的比例混合,过0.22 μm滤膜),反应20 min后,于510 nm波长下测定吸光值。通过异丙苯氢过氧化物标准曲线计算样品中氢过氧化物浓度。
1.2.5.4 TBARS值的测定
参考Mcdonald等[16]的方法。取1 mL乳液加入到带有螺旋塞的试管中,之后加入2 mL TBA测试液(15%三氯乙酸和0.375%的硫代巴比妥酸溶于0.25 mol/L HCl),沸水浴15 min 后于流动水下冷却至室温10 min,然后用1.2 μm的微孔滤膜进行过滤,滤液于532 nm下测定吸光值。乳液中硫代巴比妥酸反应物的浓度通过 1,1,3,3-四乙氧基丙烷标准曲线进行计算。
1.2.6 统计分析
样品进行3组平行实验,SPSS17.0方差分析法(ANOVA)分析实验数据,结果表示为“平均值±标准偏差”,图表中不同的上角标表示显著性差异(p<0.05)。
2 结果与分析
2.1 SPI的性质
2.1.1 溶解性
溶解性是蛋白质最重要的一个功能性质,蛋白质的其他功能性质如起泡性、乳化性都与溶解性相关。高压微射流处理对SPI溶解性的影响如图1所示。

图1 高压微射流处理对SPI溶解性的影响
由图1可知,没有经过高压微射流处理的样品溶解性约为64%,随着均质压力的逐渐增大,SPI的溶解性快速增加。当压力达到95 MPa时,SPI的溶解性达到最大,为76%。相比较未经高压微射流处理的样品,SPI的溶解性增加幅度较大。这主要是由于在较低的均质压力下,SPI在剪切力和冲击力的双重作用下,其粒径变小,相对应的比表面积增加,增大了蛋白与水相的接触面积,溶解性得以提高。这与文献[17-19]所报道的相一致,即当粒径减小时,蛋白质分子的表面区域增大,分子的活性基团得以暴露出来,通过氢键与水的作用提高了蛋白的溶解性。许艳华等[20]的研究则认为,当压力达到一定程度时,大豆蛋白的分子间就会出现解聚集现象,变成更小的亚基单位,蛋白质分子的二硫键、静电相互作用和氢键被破坏,蛋白质分子展开,蛋白质内部极性基团和疏水基团被暴露出来,这一定程度增强了溶剂与分子的相互作用,从而使得溶解性提高。
由图1可知,当均质压力增加至125、155 MPa时,SPI溶解性出现下降的趋势。这是由于蛋白质分子在解折叠过程中的过度展开,使得分子间的疏水作用以及静电引力增强而产生聚集体,从而使其溶解性降低。Floury等[21]的研究表明,当均质压力超过150 MPa时,大豆蛋白的11S球蛋白溶解性降低,推测的原因是由于蛋白质变性与聚集引起的,该结果与本文得到的结果相一致。
2.1.2 乳化性与乳化稳定性(见图2、图3)

图2 高压微射流处理对SPI乳化性的影响

图3 高压微射流处理对SPI乳化稳定性的影响
由图2可知,SPI的乳化性随着均质压力的升高呈现先升高后降低的趋势。高压均质对SPI乳化性的影响与对溶解性影响的规律基本吻合。蛋白溶解性提高时,越来越多的蛋白溶于水中,从而大大提高了蛋白的迁移率,使其吸附到油水界面的概率大大增加,从而改善了蛋白的乳化性。当均质压力达到35 MPa时,SPI乳化性达到最大,为76.56 m2/g,相比较未经高压微射流处理的样品,其乳化性得到了很大的提高。这可能是由于随着均质压力的增大,对蛋白质分子的剪切力增强,使得蛋白质分子的粒径降低,从而提高了蛋白的乳化性。文献[22-23]也证实了该结论。当均质压力大于35 MPa时,蛋白的乳化性呈现下降的趋势,这是由于当均质压力达到一定值时,分子间的静电引力变大,从而乳化性也随之降低。杨盛楠等[24]则认为这是由于随着均质压力的增大,受到机械作用和热效应的相互影响,导致蛋白发生一定程度的变性,使得蛋白表面疏水性降低,从而SPI的乳化性随之下降。
由图3可知,随着均质压力的不断提高,SPI的乳化稳定性不断增大。
2.1.3 荧光光谱分析
荧光光谱是用来分析蛋白三级结构的一种方法,主要以色氨酸残基侧链为发射基团,通过蛋白质分子侧链的变化分析其三级结构的变化[25]。图4为高压微射流处理的SPI的内源荧光光谱和最大吸收波长。

图4 高压微射流处理的SPI的内源荧光光谱和最大吸收波长
由图4可知,不同均质压力处理使得SPI的色氨酸内源荧光光谱发生变化,主要表现在最大吸收波长的增大(发生红移)和荧光强度的降低。而最大吸收波长的大小与色氨酸残基所在的周边环境有关,最大吸收波长大于330 nm说明色氨酸残基暴露在蛋白质所处的外部极性环境中,色氨酸残基所处的微环境极性越强,最大吸收波长越大[26]。从图中可以看出,未经处理和处理过的样品的最大吸收波长均大于330 nm,这表明色氨酸残基暴露于蛋白质分子所处的极性环境之中。高压微射流作用使SPI的最大吸收波长增大,发生红移,这表明高压处理增大了色氨酸暴露的程度,而且使蛋白质分子的三级结构变得更加疏散。
2.1.4 表面疏水性(见图5)
由图5可知,高压微射流处理对SPI的表面疏水性有显著的影响。随着均质压力的增大,SPI的表面疏水性逐渐增大,蛋白质的表面疏水性与处理的压力呈现正相关关系。这是由于当高压处理时,蛋白质的结构会变得较为松散,进而使得疏水残基得以暴露出来,从而使其疏水性增加。在95~155 MPa处理时,表面疏水性随着均质压力的增大急速上升,这可能是由于在较高压力处理下,加速了蛋白质分子的展开,使之展开更加完全。这与Wang等[27]得到的结果相一致。

图5 高压微射流处理对SPI表面疏水性的影响
2.1.5 粒径(见图6)

图6 高压微射流处理对SPI粒径的影响
由图6可知,在0~95 MPa压力下,SPI的平均粒径随着均质压力的升高而降低。这是由于均质过程中SPI在有限的空间中不断撞击,导致聚合体的解聚和破碎,变成更小的颗粒,从而使得SPI的平均粒径变小。当均质压力进一步增大至125、155 MPa时,SPI的平均粒径却逐渐增大。这是由于均质压力继续增大时,SPI分子之间的相互作用力也会随着增大,形成了更多的蛋白聚集体,从而增大了SPI的平均粒径。
2.2 SPI乳液的性质
2.2.1Zeta电位(见图7)

图7 高压微射流处理对SPI乳液Zeta电位的影响
由图7可知,未经高压微射流处理的SPI乳液液滴表现出较低的负电位,随着均质压力的增大,乳液的Zeta电位绝对值变化不大。当均质压力增加到155 MPa时,SPI乳液的Zeta电位绝对值增大,这可能是由于处理压力达到一定程度时,乳液液滴间的静电排斥作用增强,乳液的稳定性提高,从而Zeta电位的绝对值得以提高。
2.2.2 粒径分布(见图8)

图8 高压微射流处理对SPI乳液粒径分布的影响
由图8可知:乳液制备过程中经相同的压力处理,乳液的粒径分布较为均一化;对于未经高压微射流处理的SPI,其乳液液滴绝大部分平均粒径在600 nm左右,少量分布在100 nm左右;经过高压微射流处理后,SPI乳液的粒径分布峰值都向较小粒径的方向移动,平均粒径在150 nm左右;同时随着均质压力的增大(除95 MPa处理外),整体粒径分布依次向较小粒径移动。经过高压微射流处理后的SPI乳化性得到了一定程度的提高。一般地,蛋白乳化能力的提高可以使乳液中油滴的体积平均粒径降低。因此,蛋白经压力处理一定程度上减小了蛋白乳液的平均粒径,提高了乳液稳定性。
2.2.3 氢过氧化物
乳液中油脂的氧化程度是判断乳状液食品质量的一项非常重要的指标。初级氧化产物即脂质氢过氧化物的生成量则可以直观地反映乳液中油脂的初级氧化情况[28]。图9为高压微射流处理下SPI乳液储存10 d内油脂的初级氧化状况。
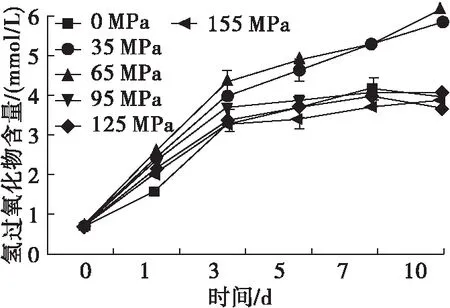
图9 高压微射流处理下SPI乳液储存10 d内油脂氢过氧化物的生成情况
由图9可知,乳液在压力为65 MPa处理时油脂氧化速率最快,乳液在压力为125、155 MPa处理时的初级氧化速率总体上要低于未处理的乳液。这可能是由于均质压力越大,乳液油滴界面的蛋白浓度相应增高,油滴界面周围SPI起到一定程度的抗氧化作用。
2.2.4 TBARS值
乳液中油脂的次级氧化是指油脂初级氧化得到的产物进一步分解成醛、酸等小分子物质的过程,这些小分子具有刺鼻气味,是乳液中油哈味的内在根源[29]。图10是高压微射液处理下SPI乳液储存10 d内油脂次级氧化产物的生成情况。

图10 高压微射流处理下SPI乳液储存10 d内TBARS的生成情况
由图10可知,在压力为35、95、125、155 MPa 的条件下,乳液油脂次级氧化产物生成速率的变化趋势与初级氧化速率变化趋势相一致,而在压力为65 MPa的条件下,乳液油脂次级氧化产物生成速率的变化趋势与初级氧化速率的变化相比存在一定差异。这表明乳液油脂初级氧化产物分解成小分子的过程和油脂的初级氧化过程有一定的差别,次级氧化产物生成的速率还与初级氧化产物的累积有关。
3 结 论
高压微射流处理对SPI的粒径、表面疏水性、溶解性、乳化性、乳化稳定性以及对SPI乳液的Zeta电位、氧化稳定性均产生显著影响。随着压力的增大,SPI粒径呈现先降低后升高的趋势;荧光光谱表明,处理后的SPI色氨酸残基暴露在蛋白质所处的外部极性环境中,最大吸收波长增大(发生红移)、荧光强度降低;较低压力的处理可以增大SPI的溶解性,而随着压力的进一步增大,蛋白质分子间的疏水作用和静电引力增强,产生新的聚集体,导致其溶解性下降;当均质压力大于35 MPa时,分子间的静电引力变大,SPI乳化性呈现下降的趋势;高压微射流处理可明显降低SPI乳液的平均粒径,提高乳液稳定性;SPI乳液在一定的压力下初级氧化速率要低于未处理的乳液。

