血清炎症因子在急性缺血性脑卒中后感染患者中的变化
王 毅,欧阳玥,康绍军,何利平
重庆市大渡口区重钢总医院:1.神经外科;2.检验科;3.内分泌科,重庆 400081
脑卒中为全球第二大死亡原因及成人病残首要原因,给社会和家庭带来了沉重的负担[1]。在急性缺血性脑卒中后1周内发生的尿路感染或肺部感染被认为是脑卒中相关感染,发病率较高,并可影响预后[2]。一方面,脑卒中导致的神经功能缺损可以加重感染的发生;另一方面,严重的感染使得神经功能受损更加严重,两者之间形成恶性循环[3]。由于脑卒中后感染严重影响预后,所以早期应用抗菌药物进行抗感染治疗也不断地被探讨,到目前为止存在不少有争议的结果。一项临床Meta分析结果显示,抗菌药物并不能降低脑卒中后感染的病死率[4]。然而,早期通过血清标志物识别有感染风险的患者,可能提高脑卒中后感染的诊断准确性,从而及早进行预防性抗感染治疗,提高治疗效果。本研究对急性缺血性脑卒中患者早期炎症因子——脂多糖结合蛋白(LBP)、白细胞介素(IL)-6和C反应蛋白(CRP),以及抗炎因子——IL-10进行分析,评价以上指标作为早期急性缺血性脑卒中后感染标志物的可能性。
1 资料与方法
1.1一般资料 选取2016年8月至2018年9月在重庆市大渡口区重钢总医院神经内科、外科住院的46例急性缺血性脑卒中患者为研究对象,其中男29例,女17例;年龄47~80岁,平均(60.50±10.40)岁。诊断符合1995年第四届全国脑血管病会议制定的诊断标准,发病6 h内入院,并经过CT或MRI确诊。排除合并恶性肿瘤、入院前有呼吸系统或其他系统感染、出血性脑卒中,以及服用免疫抑制剂的患者。所有研究对象根据入院确诊后1周内是否发生脑卒中后感染分为感染组19例(41.3%)和无感染组27例(58.7%)。两组患者在年龄、性别构成比、高血压、高血脂、糖尿病及吸烟等方面比较,差异无统计学意义(P>0.05)。见表1。本研究符合本院医学伦理委员会的伦理学标准,并在被批准后进行,向患者及家属告知相关临床试验内容及步骤,并签订知情同意书。
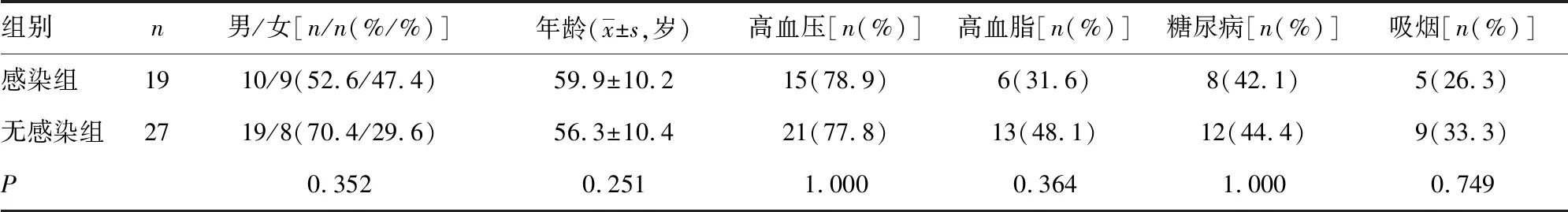
表1 感染组与无感染组患者临床资料比较
1.2方法 所有患者入院后收集包括姓名、年龄、性别、心血管危险因素(高血压、糖尿病、高血脂、吸烟等)等一般资料,并进行一系列包括临床、实验室和影像学的检查。入院后使用美国国立卫生研究院卒中量表(NIHSS)对患者进行第一次脑卒中严重程度评估,出院后3个月,通过随访对患者再次进行NIHSS评估。脑卒中感染定义为入院确诊后1周内发生的感染,患者有明显的感染迹象,例如发热、咳嗽、呼吸急促、排尿困难等。
1.2.1炎性细胞因子检测 分别于患者入院后6 h、12 h、24 h、3 d、7 d采集患者晨起空腹肘静脉血3~5 mL,1 600×g离心15 min,分离血清,-70 ℃保存待测。血清IL-6和IL-10检测采用双抗体夹心ELISA(上海森雄科技实验有限公司提供试剂盒);血清CRP检测采用胶乳增强免疫比浊法(广东捷基生物技术公司提供试剂盒);LBP应用美国R&D公司的人LBP检测试剂盒(上海西唐生物科技有限公司提供试剂盒)以ELISA检测。
1.2.2神经功能NIHSS评分 分别于患者入院6 h和随访3个月后(出院后3个月)对患者进行NIHSS评分,共15项检测内容,包含每种主要脑动脉病变可能需要进行的神经系统检查项目,以及受试者精神状态、感觉功能、瞳孔反应和足底反射项。神经功能缺损程度分为:轻度,NIHSS评分<7分;中度,NIHSS评分7~15分;重度,NIHSS评分>15分。

2 结 果
2.1两组患者NIHSS评分比较 感染组及无感染组入院6 h的NIHSS评分分别为(12.3±3.6)、(5.0±2.6)分,感染组明显高于无感染组,差异有统计学意义(P<0.001);出院后3个月,感染组及无感染组的NIHSS评分分别为(3.1±2.0)、(2.0±0.9)分,差异无统计学意义(P=0.024)。
2.2血清炎症因子水平变化 感染组患者血清LBP在入院后第1天内逐渐升高,然后逐渐下降,在入院后6、12、24 h与无感染组比较,差异均有统计学意义(P<0.05);感染组患者的血清IL-6入院时就较无感染组患者高,然后逐渐下降,在入院后6 h、12 h、24 h、3 d和7 d与无感染组比较,差异均有统计学意义(P<0.001);感染组患者的IL-10也呈逐渐下降的趋势,在入院后6 h、12 h、24 h和3 d与无感染组比较,差异均有统计学意义(P<0.05);感染组患者的CRP水平入院后检查逐渐升高,在第3天达到高峰,然后下降,在入院后6 h、12 h、24 h、3 d和7 d与无感染组比较,差异均有统计学意义(P<0.001)。见表2,图1。

表2 两组患者血清炎性因子水平的比较
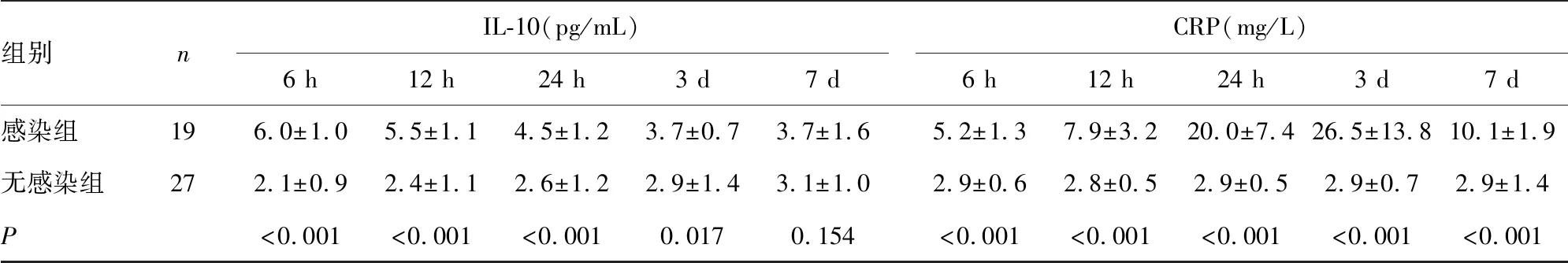
组别nIL-10(pg/mL)6 h12 h24 h3 d7 dCRP(mg/L)6 h12 h24 h3 d7 d感染组196.0±1.05.5±1.14.5±1.23.7±0.73.7±1.65.2±1.37.9±3.220.0±7.426.5±13.810.1±1.9无感染组272.1±0.92.4±1.12.6±1.22.9±1.43.1±1.02.9±0.62.8±0.52.9±0.52.9±0.72.9±1.4P<0.001<0.001<0.0010.0170.154<0.001<0.001<0.001<0.001<0.001
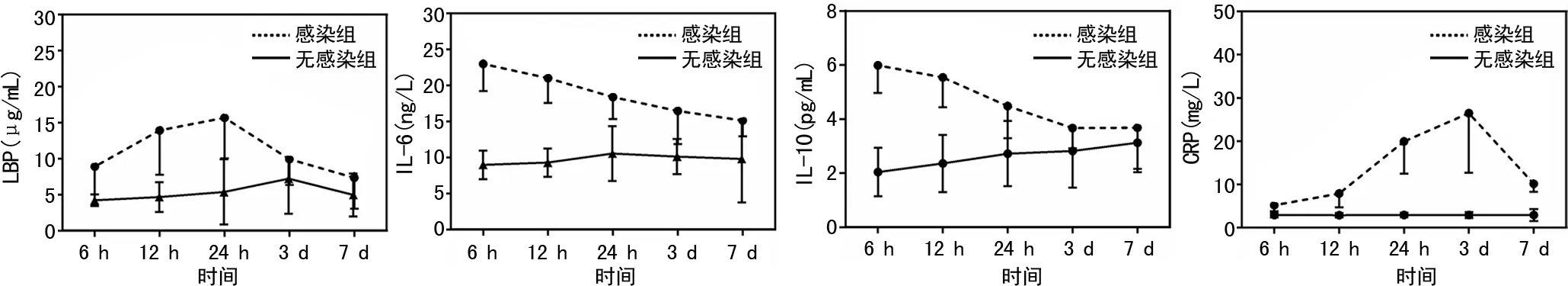
图1 两组患者血清炎症因子随时间的变化趋势
2.3急性缺血性脑卒中后感染的独立危险因素 二元Logistic回归分析结果显示入院后6 h的NIHSS评分(P=0.014)、LBP(P=0.041)和CRP(P=0.002)为急性缺血性脑卒中后感染的独立危险因素。见表3。
2.4ROC曲线分析 对入院6 h后的NIHSS、LBP和CRP进行ROC曲线分析显示,NIHSS的AUC为0.97(95%CI:0.93~1.01;P<0.000 1);LBP的AUC为0.71(95%CI:0.55~0.87;P=0.02);CRP的AUC为0.96(95%CI:0.90~1.01;P<0.000 1)。见图2。
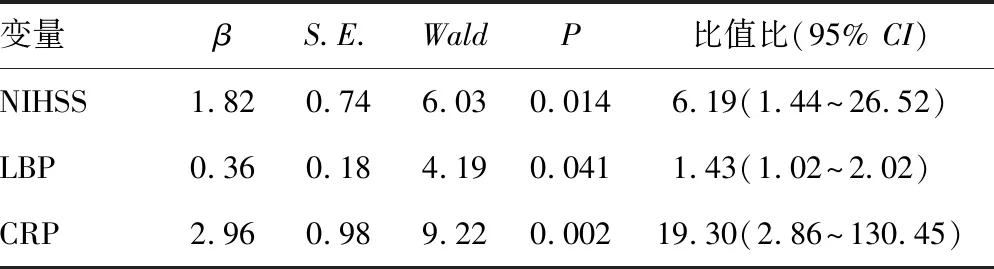
表3 急性缺血性脑卒中后感染的独立危险因素
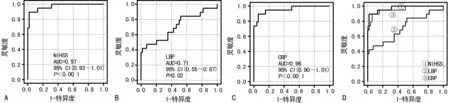
注:A、B、C、D分别为入院6 h后NIHSS、LBP、CRP及3项指标共同对诊断急性缺血性脑卒中后感染的ROC曲线分析。
图2ROC曲线分析
3 讨 论
急性缺血性脑卒中为常见人类致残致死性疾病之一,致使患者不同程度丧失劳动能力和生活自理能力,给患者健康和生命造成极大的威胁[1]。急性缺血性脑卒中后,包括巨噬细胞在内的炎症细胞分泌的炎症因子如IL-6、TNF-α等可促进CRP产生,并可影响脑基质金属蛋白酶的生成,后者可使血-脑脊液屏障通透性增加、促进炎性反应[5]。在缺血性脑卒中急性期,强大的抗炎反应抑制免疫系统,使患者更易被感染[6],例如误吸性肺炎和尿路感染。IL-10是抑制炎症的主要因子。
近年研究表明,炎症在急性缺血性脑卒中的发病机制中起重要作用,它与脑血管病之间的关系越来越受到关注。但有研究显示,缺血性脑卒中后,明显的抗炎反应可以通过下丘脑-垂体-肾上腺轴、交感神经系统和迷走神经系统引起机体免疫抑制[3,6]。因此,脑卒中患者更加容易发生感染。临床研究也发现在脑卒中患者发生感染后,抗炎细胞因子IL-10水平升高。而IL-6和CRP等前炎症介质随着感染的加重而升高[7-8]。另外,LBP是机体对细菌表面的脂多糖做出反应必不可少的急性期反应蛋白,可以诱发急性炎性反应。LBP水平在脑卒中患者感染后有明显的升高[9-10]。本研究结果显示,感染组患者血清IL-6和IL-10水平均明显高于无感染组,CPR逐渐升高,在第3天达到高峰,然后逐渐下降。LBP作为一种急性期蛋白在有感染的患者中逐渐升高。
血清高水平IL-6与脑卒中严重程度和患者预后明显相关。可以说IL-6可以作为梗死灶部位炎性程度的一项预测指标。研究显示,急性缺血性脑卒中患者入院时NIHSS评分与血清IL-6和CRP水平呈正相关,表明急性缺血性脑卒中患者血清IL-6和CRP水平越高,其神经功能缺损程度越严重[11]。急性缺血性脑卒中患者经药物治疗1周后,随着NIHSS评分的下降至接近轻度损伤上限值时,血清中上述3种炎症因子水平也明显下降。由此可见,在缺血性脑卒中急性期监测IL-6和CRP等炎症因子的变化有助于病情严重程度的评估。
一些临床试验研究表明,预防性抗感染治疗不仅能降低感染率,同时也可改善临床预后。预防性的抗感染治疗的机制可能为能够降低机体感染发生时高热、低血压及低氧对神经系统神经元的潜在不利影响[12]。研究显示,对严重缺血性脑卒中卧床不起的患者在24 h之内预防性使用美洛西林和舒巴坦进行抗感染治疗,可以达到改善患者临床结局及预后的效果[13]。在发病24 h之内使用米诺环素的急性缺血性脑卒中患者,在发病30 d后与使用安慰剂患者比较,其预后明显改善[14]。PADMA等[15]的研究也证实了米诺环素对脑卒中患者预后有利。但是,另外一些临床试验显示预防性抗感染药物治疗没有降低感染发生率,也未能改善预后[16-17]。
综上所述,在急性缺血性脑卒中急性期,NIHSS评分、血清LBP和CRP变化可用于急性缺血性脑卒中后感染的早期监测,为临床早期进行干预提供依据。

