ProGRP、CYFRA21-1和胱抑素C联合检测对不同病理类型肺癌的诊断价值*
刘道利,邱芳华,周伟青,龙华婧,刘燕娣,高东华,梁 涯
广州市中医医院:1.检验科;2.院感科;3.病理科,广东广州 510130
近几年来,随着人口老龄化的发展,环境污染日益严重,恶性肿瘤成为阻碍人类健康、社会发展的严重危险因素。全国肿瘤登记中心最新数据显示,2013年全国肿瘤新发病例368.2万例,死亡病例为222.9万例,其中发病例数排首位的为肺癌,其新发病例为73.3万例,死亡病例数居首位的也是肺癌,为32.4万例[1]。因传统的影像学检查灵敏度低,病理组织活检易造成患者创伤,且难以发现微小的组织病灶,故寻找灵敏度和特异度高的生物标志物用于辅助诊断肺癌尤为重要。近年来,胃泌素释放肽前体(ProGRP)用于辅助诊断肺癌越来越受到关注[2-4],而越来越多的研究也证实了胱抑素C(CysC)与恶性肿瘤相关[5-6]。本研究旨在分析联合检测ProGRP、细胞角蛋白19片段(CYFRA21-1)和胱抑素C(CysC)对诊断肺癌的灵敏度、特异度。
1 资料与方法
1.1一般资料 选择2018年1-12月广州市中医医院肺病科收治的81例经病理组织细胞学检查诊断为肺癌,同时排除有肾脏疾病的患者纳入肺癌组,男40例,女41例,年龄35~78岁,其中腺癌组24例,鳞癌组28例,小细胞肺癌组29例。收集同期59例肺良性病变患者纳入肺良性病变组,其中男32例,女27例,年龄40~80岁,包括慢性阻塞性肺疾病、感染性肺炎、肺气肿、支气管扩张等疾病患者,排除肾脏疾病患者。同期60例本院健康体检者纳入健康对照组,无心脏、肝脏、肾脏等疾病,无肿瘤家族史,其中男33例,女27例,年龄38~82岁。5组研究对象一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2仪器与试剂 仪器使用罗氏Cobas e601化学发光仪、日立7180全自动生化仪;ProGRP、CYFRA21-1检测均采用罗氏原装试剂、质控品和校准品。CysC检测试剂由宁波美康生物有限公司提供。所有操作均严格按照说明书操作,质控在控。
1.3检测方法 采集所有研究对象清晨空腹静脉血标本,3 500 r/min离心10 min分离血清后,2 h内完成检测。本实验室阳性阈值:CYFRA21-1>3.3 ng/mL,ProGRP>77.80 pg/mL,CysC>1.25 mg/L,超临界值则为阳性。
1.4统计学处理 采用Excel 2007软件、SPSS 19.0统计软件进行数据处理及统计分析。非正态定量资料采用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Kruskal-Wallis秩和检验;非双变量正态分布资料采用Spearman法进行相关性分析;诊断效果评价采用受试者工作特征(ROC)曲线分析。以P<0.05为差异有统计学意义。
2 结 果
2.15组的CYFRA21-1、ProGRP、CysC水平比较 腺癌组、鳞癌组和小细胞肺癌组的CYFRA21-1水平高于肺良性病变组和健康对照组,差异有统计学意义(P<0.05)。小细胞肺癌组的ProGRP水平高于肺良性病变组、腺癌组、鳞癌组和健康对照组,差异有统计学意义(P<0.05)。鳞癌组和小细胞肺癌组的CysC水平高于肺良性病变组、腺癌组和健康对照组,腺癌组的CysC水平高于健康对照组,差异有统计学意义(P<0.05)。见表1。
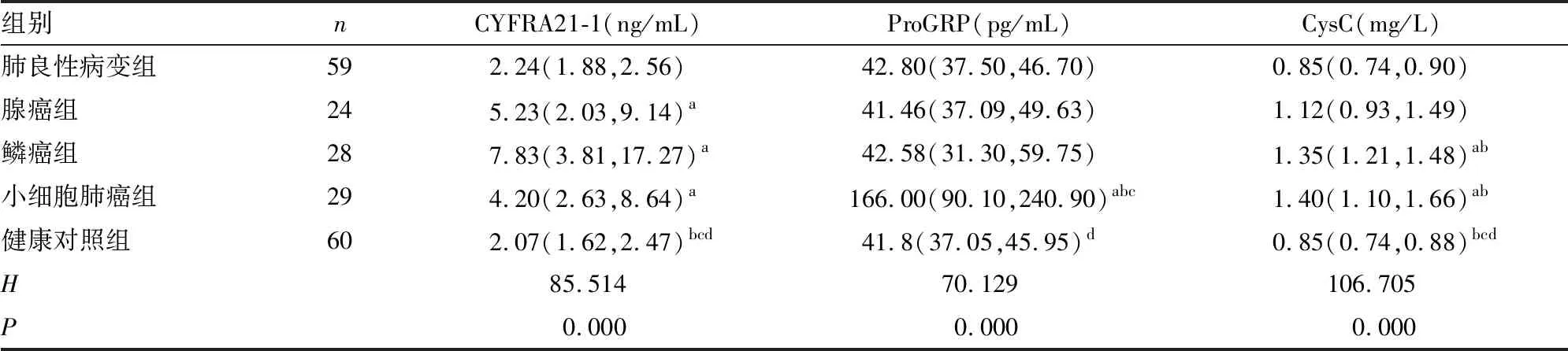
表15组的CYFRA21-1、ProGRP、CysC水平比较[M(P25,P75)]
注:与肺良性病变组比较,aP<0.05;与腺癌组比较,bP<0.05;与鳞癌组比较,cP<0.05; 与小细胞肺癌组比较,dP<0.05。
2.2CYFRA21-1、ProGRP、CysC及联合检测诊断肺癌的效果 CYFRA21-1、ProGRP、CysC及3项指标联合检测诊断肺癌的AUC(95%CI)分别为0.848(0.778~0.903)、0.670(0.585~0.747)、0.920(0.862~0.959)和0.964(0.918~0.988),联合检测的AUC最大。见表2及图1。

表2CYFRA21-1、ProGRP、CysC及联合检测诊断肺癌的效果
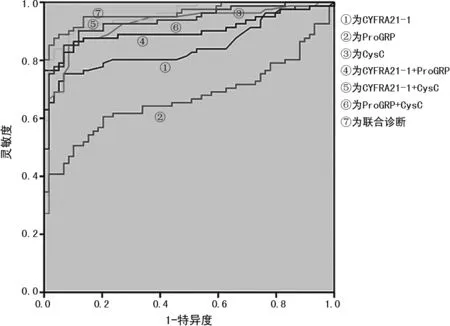
图1CYFRA21-1、ProGRP、CysC及联合检测诊断肺癌的ROC曲线
2.3CysC与CYFRA21-1、ProGRP相关性分析 小细胞肺癌组中,ProGRP与CysC呈显著正相关(r=0.641,P<0.05)。见图2及表3。

图2 小细胞肺癌组中ProGRP与CysC的散点图表3CysC与ProGRP及CYFRA21-1相关性分析
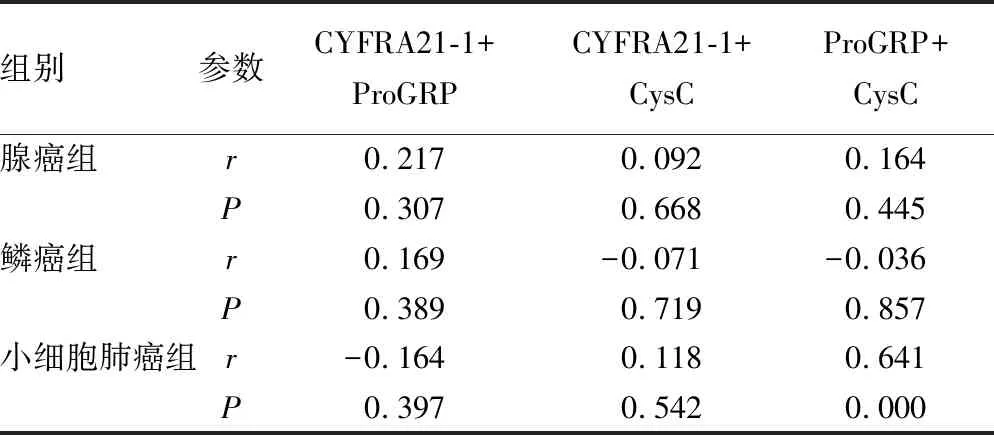
组别参数CYFRA21-1+ProGRPCYFRA21-1+CysCProGRP+CysC腺癌组r0.2170.0920.164P0.3070.6680.445鳞癌组r0.169-0.071-0.036P0.3890.7190.857小细胞肺癌组r-0.1640.1180.641P0.3970.5420.000
2.43项指标在4个病例组中的阳性率 CYFRA21-1在鳞癌组中阳性率最高,为82.14%;ProGRP在小细胞肺癌组中阳性率最高,为89.66%,见表4。

表43项指标在4个病例组中的阳性情况[n(%)]
3 讨 论
肺癌是我国发病率和病死率最高的癌症,由于其起病隐匿,易转移,临床上患者被确诊时往往是中晚期,目前临床上诊断肺癌主要依据影像学、病理学检查,以及传统的肿瘤标志物如癌胚抗原、神经元特异性醇化酶、鳞状细胞癌相关抗原等,它们都存在灵敏度和特异度不高,或是取材不佳导致假阴性太高的问题,且有创检查患者难以接受。因此,迫切需要寻找更高临床价值的生物学标志物,便于及早诊断,改善预后,提高患者生存率。
ProGRP是一种新的激素类肿瘤标志物,其在哺乳动物胃的神经纤维及肺的神经内分泌组织中分布广泛,由于半衰期长,近年来,被广泛用于肺癌的诊断及病情监测,是一种新的神经内分泌源肿瘤标志物,是目前小细胞肺癌早期诊断的首选敏感肿瘤标志物[4]。有研究表明,ProGRP对小细胞肺癌的诊断具有较高的灵敏度和特异度,可用于其他疾病与非小细胞肺癌的鉴别诊断[7-8]。马大威等[9]研究显示,ProGRP对小细胞肺癌诊断的灵敏度为97.56%,特异度为98.04%,阳性率为100.00%。本文研究同样显示,不同组的ProGRP水平比较,小细胞肺癌组高于其他4组,差异有统计学意义(P<0.05),且ProGRP在小细胞肺癌组中阳性率最高,为89.66%。沈隽霏等[10]通过对ProGRP诊断的性能评价及临床应用评估,发现ProGRP诊断小细胞肺癌性能的AUC为0.963(95%CI0.868~0.931),阳性预测值为71.68%,阴性预测值为96.83%。本研究通过ProGRP对肺癌组诊断的性能评价,结果显示AUC(95%CI)为0.670(0.585~0.747),阳性预测值为74.6%,阴性预测值为57.5%,再次证明ProGRP可用于肺癌病理分型,特别是对小细胞肺癌的诊断价值优于其他肺癌。以上结果表明,ProGRP可作为肺癌病理分型的一项理想指标。
CYFRA21-1是细胞角蛋白19的可溶性片段,在上皮细胞及上皮细胞来源的恶性肿瘤细胞内有表达,当上皮细胞癌变时,经蛋白酶降解或细胞凋亡后,CYFRA21-1碎片释放入血,对肺癌的诊断有较大的临床意义[11]。本研究中血清CYFRA21-1水平在鳞癌患者中的表达水平及阳性率较高,对诊断肺癌的灵敏度和特异度分别为75.3%、93.2%,与芦珂[8]的研究结果一致。虽与王文洋等[11]报道中的灵敏度有些不符,可能与本研究的非小细胞肺癌病例数较少相关,需进一步加大病例数验证。
CysC过去一直被用来作为反映肾脏滤过功能的指标,监测肾脏功能。近几年来,CysC在肺癌方面的研究越来越受到重视,其高表达对指导临床肺癌诊断、评估预后有重要意义[6]。曹晋峰等[12]研究表明肺癌患者血清CysC水平明显升高,且术前与术后相比,差异有统计学意义(P<0.05),其机制可能是由于CysC分泌与抑制的不平衡,从而促进了肿瘤细胞的生长、侵袭和远处转移。机体的应激反应使CysC相应增高,以抑制胞外胱氨酶的水解活性。本研究中,鳞癌组和小细胞肺癌组的CysC水平高于肺良性病变组、腺癌组及健康对照组,腺癌组高于健康对照组,差异有统计学意义(P<0.05),其对诊断肺癌的灵敏度和特异度分别为85.2%、91.5%,与丁湘彧等[13]研究结果一致。此外,贺洪军等[5]的研究显示,CysC区分癌症组与非癌组的灵敏度和特异度分别为85.8%、74.5%,通过回归分析校正后,发现高CysC水平是肺癌发生的独立危险因素。本研究还通过Spearman法分析CysC与ProGRP、CYFRA21-1的关系,得出小细胞肺癌组中,CysC与ProGRP呈正相关(r=0.641),这可能与本研究中小细胞肺癌组的病理分型构成比及转移器官数相关,CysC水平随着TNM分期的增加,会逐渐增高[14]。
本研究旨在探讨联合检测ProGRP与CysC、CYFRA21-1对肺癌诊断的灵敏度和特异度,3项指标联合检测诊断的AUC最大,为0.964(0.918~0.988),阴性预测值与阳性预测值分别为95.9%、84.9%,3项指标联合检测比ProGRP与CysC、CYFRA21-1各单项及两两联合检测的灵敏度和特异度更高,大大提高了肺癌的诊断率。多项生物学标志物联合检测是提高血清标志物诊断肺癌灵敏度和特异度的重要途径,为临床诊断提供了新的手段。
综上所述,血清ProGRP、CFRA21-1和CysC检测对肺癌病理分型、鉴别诊断有一定的参考价值,三者联合检测是灵敏度、特异度较高的临床诊断肺癌的手段。

