泊那替尼通过Notch通路对T315I突变细胞增殖凋亡的影响
梁志伟, 谢秀仪, 罗国桢, 吴苑芳, 郑怡, 邓专红, 梁佩珍
开平市中心医院血液科(广东江门 529300)
慢性髓系白血病(chronic myeloid leukemia,CML)是一种起源于多能造血干细胞的恶性克隆性疾病,是常见的血液系统恶性肿瘤,以9号染色体和22号染色体易位并产生BCR-ABL融合基因为主要特征[1]。世界卫生组织调查研究发现慢性髓系白血病的发病率为(3.5~5.5)/10万,且呈逐年上升的趋势[2]。以伊马替尼为代表的酪氨酸激酶抑制剂(TKI)可靶向抑制BCR-ABL蛋白激酶的活性,促进克隆性白血病细胞凋亡,显著提高CML患者的缓解率和生存率[3]。随着TKIs药物的使用,部分患者出现耐药,大量的研究证据提示BCR-ABL依赖途径和BCR-ABL非依赖途径是导致耐药的主要原因[4-5]。BCR-ABL异常扩增和ABL激酶区点突变是BCR-ABL依赖途径耐药的主要原因,激酶区发生T315I突变时对第1代和第2代的TKI药物均不敏感[6]。泊那替尼作为第3代TKI药物,可有效治疗出现T315I突变的慢性髓系白血病患者[7],Breccia等[8]研究认为泊那替尼可通过多种途径调节骨髓微环境,促进白血病细胞凋亡,进一步清除CML细胞。Linder等[9]研究发现三氧化二砷可通过Notch通路,产生氧化应激反应,促进神经胶质瘤干细胞样细胞的凋亡。泊那替尼对Notch通路的影响及对T315I突变细胞株增殖和凋亡的影响的相关报道较少。2017年9月至2019年5月期间,本研究通过体外实验研究泊那替尼对T315I突变细胞株Notch信号通路的影响,为进一步揭示CML患者耐药机制提供理论依据。
1 材料与方法
1.1 材料与仪器 T315I突变CML细胞株KBM5R(南方医科大学南方医院血液病研究所惠赠)、DMSO(美国sigma公司)、泊那替尼原料药(上海翰香生物制品有限公司)、重组人核转录因子-κB(rhNF-κB)(美国Promega公司)、DMEM低糖培养基(美国Gibco公司)、噻唑蓝(MTT)(美国sigma公司)、Hoechst33258试剂盒(武汉博士德生物科技有限公司)、RIPA裂解液(武汉博士德生物科技有限公司)、抗体均购于美国Abcam公司、酶标仪(德国Bio-Tek公司)、共聚焦显微镜(日本Nikon公司)、电泳仪(美国 Corning 公司)、移液器(德国 Eppendorf 公司)。
1.2 方法
1.2.1 细胞培养及分组 KBM5R细胞经复苏后加入含10%胎牛血清的DMEM培养基,置于37℃、5%CO2的培养箱中培养,3 d传代1次,待细胞长至对数生长期后用于实验。设立对照组(C组),泊那替尼组(P组):加入泊那替尼处理细胞,泊那替尼+rhNF-κB组(Pr组):加入泊那替尼和rhNF-κB共同处理细胞。
1.2.2 MTT检测细胞的增殖能力 选择对数生长期的KBM5R细胞,调整细胞密度为2×104,接种于96孔板中,设立对照组,加入不同浓度的泊那替尼进行处理,浓度分别为:0.5、1、2、5、10、20和50 μmol/L,37℃、5%CO2培养箱中培养48 h。弃去孔板内液体,每孔加入100 μL含5 mg/mL MTT的DMEM培养基,继续孵育4 h后弃去上清,加入150 μL的DMSO,震荡混匀,采用全自动酶标仪检测各组细胞在570 nm处的吸光度值,计算各组细胞的增殖情况,并计算半数抑制浓度(IC50),确定适宜的泊那替尼浓度用于后续实验。
选择对数生长期的KBM5R细胞,调整细胞密度为2×104,接种于96孔板中,P组加入泊那替尼,Pr组加入泊那替尼和1 μg/mL的rhNF-κB[10],C组加入等量的DMEM培养基,处理细胞48 h,MTT法检测各组细胞的增殖情况。
1.2.3 Hoechst染色法检测细胞的凋亡数量 采用Hoechst 33258染色检测细胞的凋亡数量:选择对数生长期的KBM5R细胞,调整细胞密度为5×105,接种于6孔板中,P组加入泊那替尼,Pr组加入泊那替尼和1 μg/mL的rhNF-κB,C组加入等量的DMEM培养基,37℃、5%CO2培养箱中培养48 h。弃去培养基,加入适量的新鲜配置的4%多聚甲醛,固定细胞30 min,用PBS清洗3次,每孔加入50 μL的Hoechest33258染色剂,室温条件下避光孵育10 min,用荧光显微镜观察细胞的状态,记录各组细胞的凋亡情况:若细胞的胞核出现高亮的蓝色则表明细胞出现凋亡,记为凋亡细胞。
1.2.4 DCFH-DA检测细胞的活性氧(ROS)水平 采用DCFH-DA检测细胞的ROS水平:选择对数生长期的KBM5R细胞,调整细胞密度为5×105,接种于6孔板中,P组加入泊那替尼,Pr组加入泊那替尼和1 μg/mL的rhNF-κB,C组加入等量的DMEM培养基,37℃、5%CO2培养箱中培养48 h。每孔加入10 μmol/L的DCFH-DA,37℃避光孵育20 min,弃去培养基,用PBS清洗,调节共聚焦显微镜的激发波长为488 nm,发射波长为525 nm,检测各组细胞的荧光强度,评价细胞内ROS的水平。
1.2.5 Western blot检测相关蛋白的表达水平 采用Western blot检测各组细胞凋亡相关蛋白和Notch通路相关蛋白的表达水平:选择对数生长期的KBM5R细胞,调整细胞密度为5×105,接种于6孔板中,P组加入泊那替尼,Pr组加入泊那替尼和1 μg/mL的rhNF-κB,C组加入等量的DMEM培养基,37℃、5%CO2培养箱中培养48 h。弃去培养基,每孔加入适量的RIPA裂解液,加入1%的蛋白酶抑制剂和1%的磷酸酶抑制剂,提取各组细胞的总蛋白,采用BCA蛋白定量试剂盒测定各组细胞蛋白的浓度,制备等浓度的上样缓冲液后,用15%的SDS-聚丙烯酰胺凝胶进行电泳、转膜、新鲜配置的5%脱脂奶粉封闭蛋白条带1 h。按目的条带大小切下条带,4℃孵育兔(Rabbit)-胱天蛋白酶3(Caspase3)、Rabbit-B淋巴细胞瘤-2(Bcl-2)、Rabbit-Bcl-2相关X蛋白(Bax)、Rabbit-Notch1、Rabbit-发状分裂相关增强因子1(Hes1)、Rabbit-血管内皮生长因子(VEGF)和Rabbit-GAPDH过夜,TBST清洗3次,室温下用辣根过氧化物酶共轭的二抗孵育1 h,TBST清洗3次。配置ECL显影液,于暗室内曝光、显影,计算各个蛋白的表达水平。
1.3 统计学方法 采用SPSS 22.0统计软件,各组间数据资料运用单因素方差分析(One-Way ANOVA),经方差齐性检验,若方差齐性则两两比较采用Bonferronic法,若方差不齐将采用Welch法分析,以P<0.05为差异有统计学意义。
2 结果
2.1 泊那替尼对细胞增殖的影响 10 μmol/L的泊那替尼即可抑制KBM5R细胞的增殖(P<0.01),IC50=16.07 μmol/L,见图1。本实验选择20 μmol/L的泊那替尼用于后续实验。P组加入20 μmol/L的泊那替尼处理细胞,Pr组加入20 μmol/L泊那替尼和1 μg/mL rhNF-κB共同处理细胞,C组加入等量的DMEM培养基,P组的细胞增殖能力显著低于C组(P<0.01),Pr组细胞的增殖能力显著高于P组(P<0.01),见图2、表1。
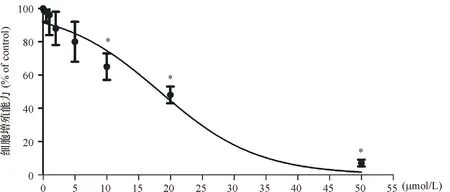
*P<0.01 vs C组
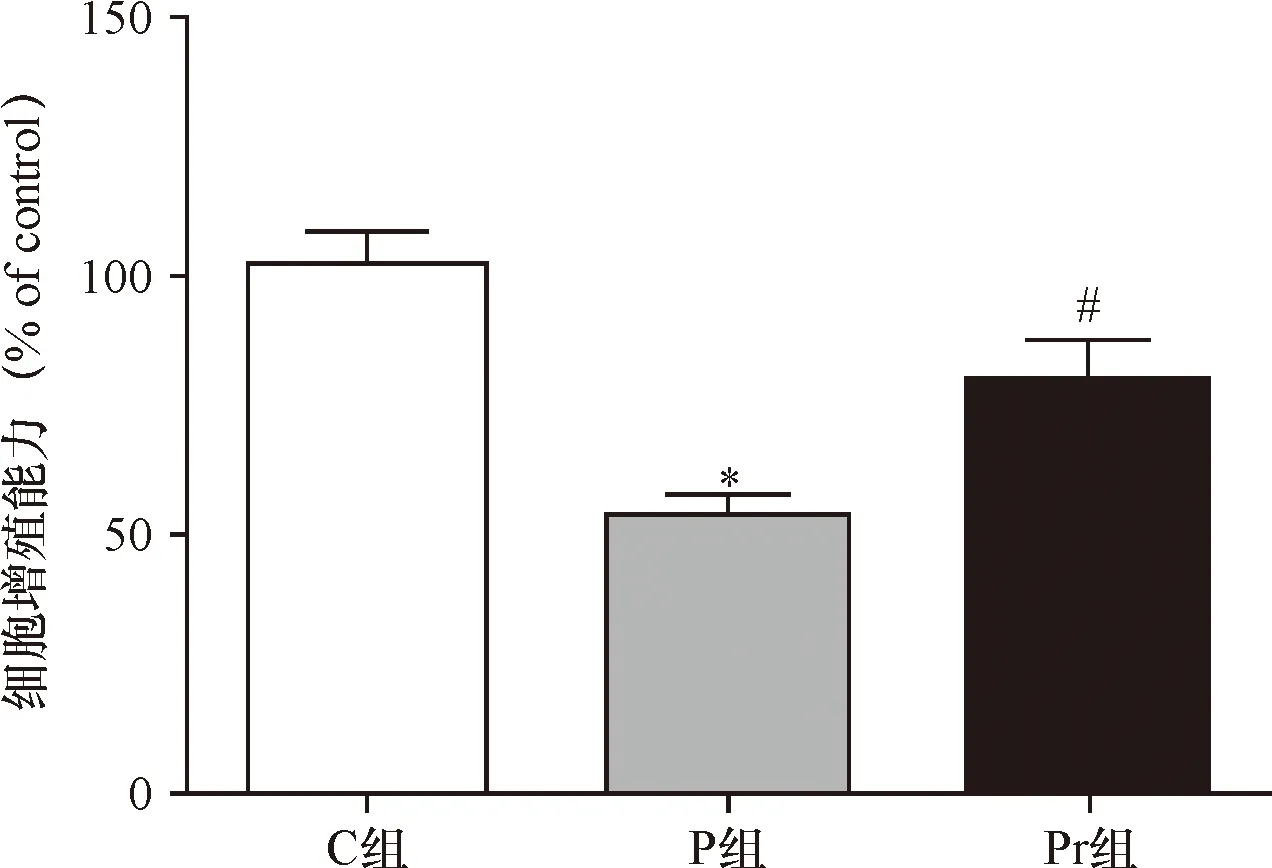
*与C组比较P<0.01; #与P组比较P<0.01
表1 MTT检测各组细胞的增殖能力
*与C组比较P<0.01;△与P组比较P<0.01
2.2 泊那替尼对细胞凋亡的影响 Hoechst 33258染色结果提示P组细胞的凋亡数量显著高于C组(P<0.01),加入rhNF-κB干预后,Pr组KBM5R细胞的凋亡数量显著低于P组(P<0.01),见图3~4、表2。
2.3 泊那替尼对细胞内ROS水平的影响 DCFH-DA结果提示P组细胞中ROS的水平显著高于C组(P<0.01),加入rhNF-κB干预后,Pr组KBM5R细胞中ROS的水平显著低于P组(P<0.01),见图5~6、表3。

箭头所指为Hoechst33258染色中呈高亮蓝色的细胞
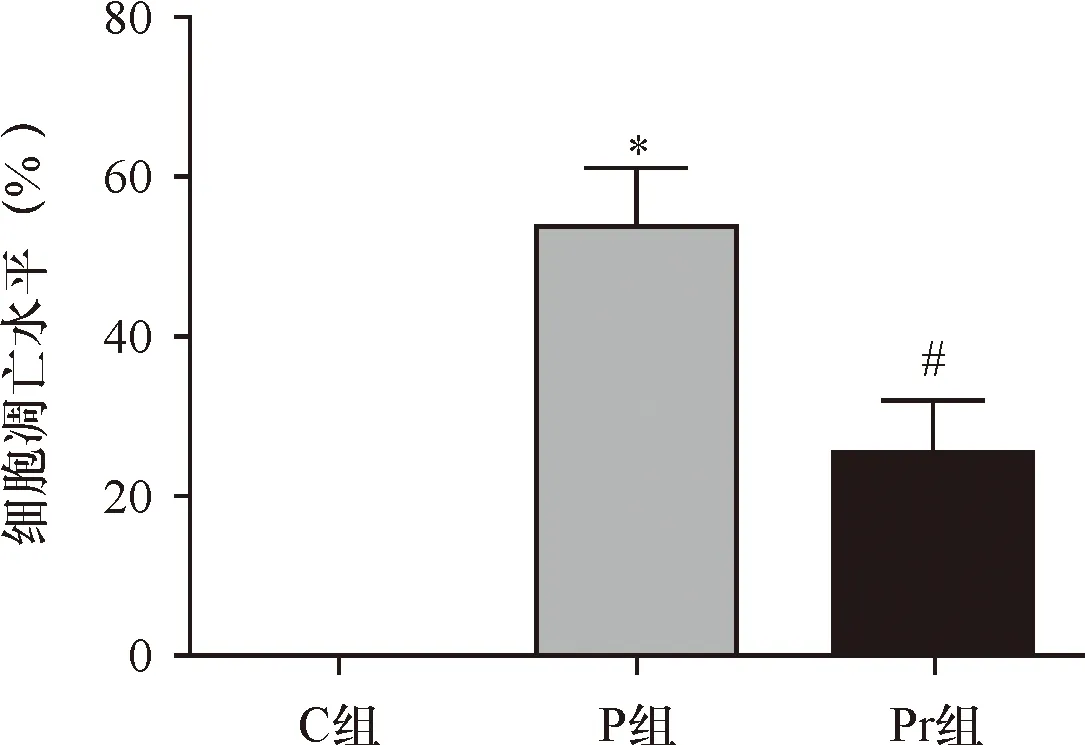
*与C组比较P<0.01;#与P组比较P<0.01
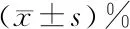
表2 各组细胞的凋亡水平
*与C组比较P<0.01;△与P组比较P<0.01
2.4 泊那替尼对细胞内凋亡相关蛋白的影响 P组细胞内Caspase3的表达水平显著高于C组(P<0.01),Bcl-2/Bax的表达水平显著低于C(P<0.01),给予rhNF-κB干预可显著降低Pr组细胞内Caspase3的表达水平,增加Bcl-2/Bax(P<0.01),见图7~8、表4。
2.5 泊那替尼对细胞内Notch信号通路的影响 P组细胞内Notch1、Hes1和VEGF的表达均显著低于C组(P<0.01),给予rhNF-κB干预后,Pr组细胞内Notch1、Hes1和VEGF的表达均显著增加(P<0.01),见图9~10、表5。
3 讨论
TKIs可特异性地抑制BCR-ABL激酶,从而靶向治疗CML,大大延长患者的生存期,BCR-ABL激酶区突变是导致CML患者对TKIs产生耐药的主要原因。Mat等[11]研究发现T315I突变可有效降低伊马替尼、达沙替尼等与BCR-ABL蛋白的结合位点,使得ABL激酶与药物的结合被阻断,进而出现耐药。T315I突变导致苏氨酸315突变至异亮氨酸,破坏氢键,进而使得蛋白的结构和构象发生改变[12]。泊那替尼作为第3代TKIs类药物,Ⅱ期临床研究结果提示T315I突变的CML患者使用泊那替尼可达到70%以上的细胞遗传学缓解,可有效治疗T315I突变的难治性CML[13]。本研究选择T315I突变的CML细胞株KBM5R进行实验,结果发现泊那替尼可有效抑制细胞的增殖,促进细胞的凋亡。

图5 DCFH-DA检测细胞内ROS的显微图
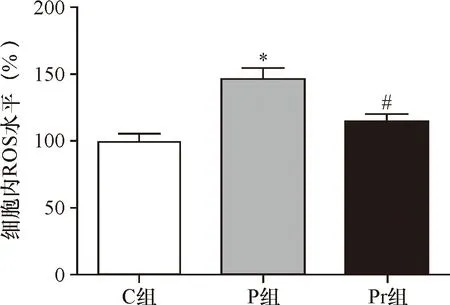
*与C组比较P<0.01;#与P组比较P<0.01
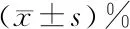
表3 各组细胞的ROS水平
*与C组比较P<0.01;△与P组比较P<0.01
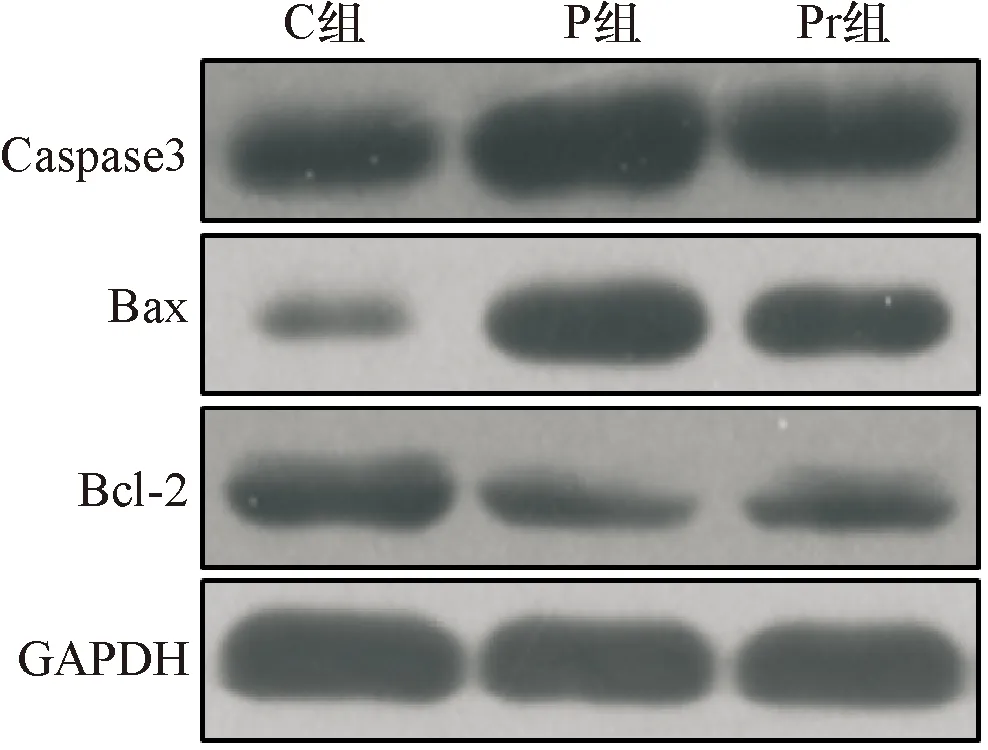
图7 Western blot检测凋亡相关蛋白的表达水平(蛋白条带图)
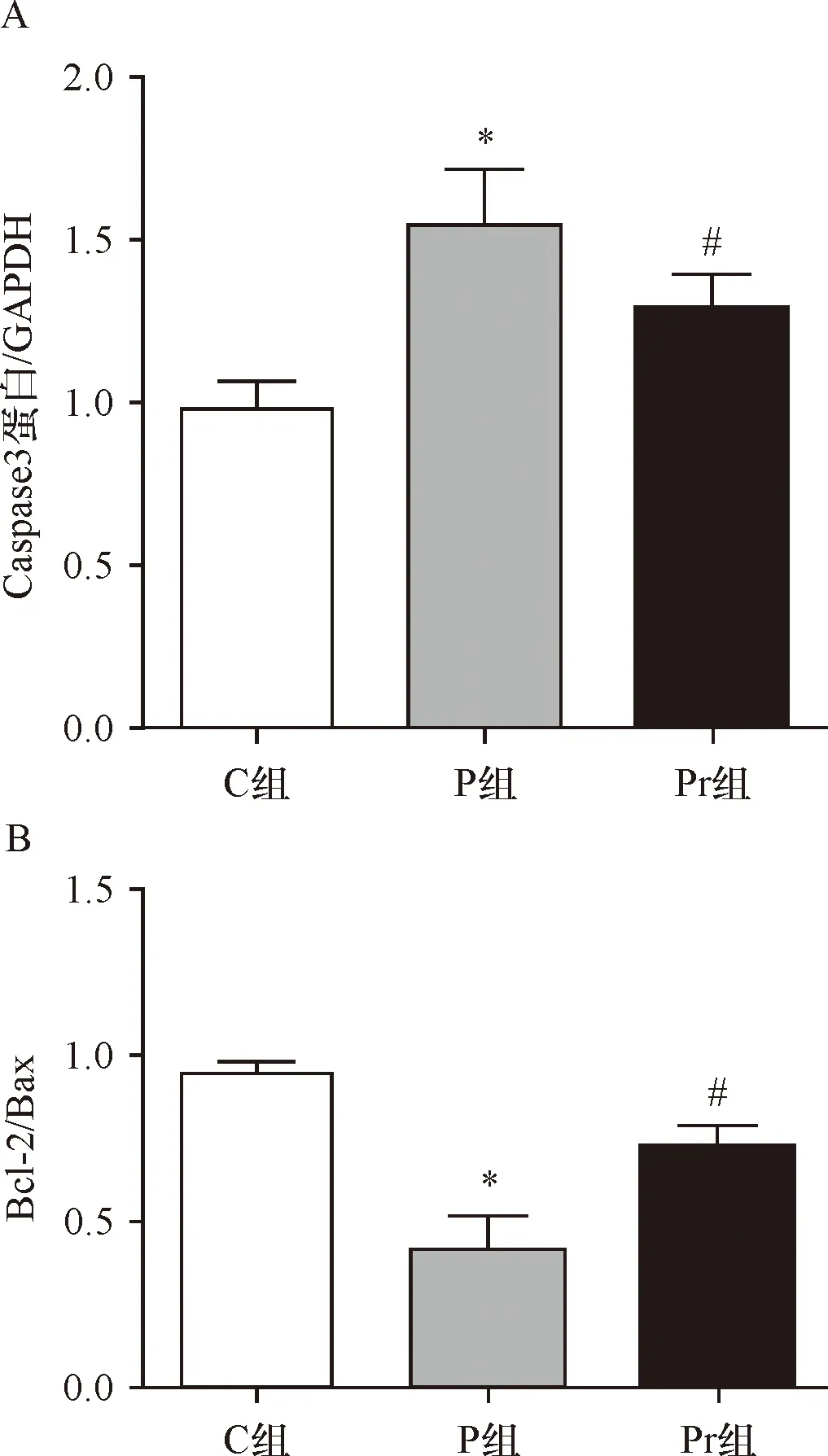
A:Caspase3蛋白统计图;B:Bcl-2/Bax统计图;*与C组比较P<0.01;#与P组比较P<0.01
图8Westernblot检测凋亡相关蛋白的表达水平


组别Caspase 3/GAPDHBcl-2/BaxC组0.98±0.080.94±0.04P组1.54±0.17*0.42±0.09*Pr组1.28±0.10△0.73±0.06△
*与C组比较P<0.01;△与P组比较P<0.01
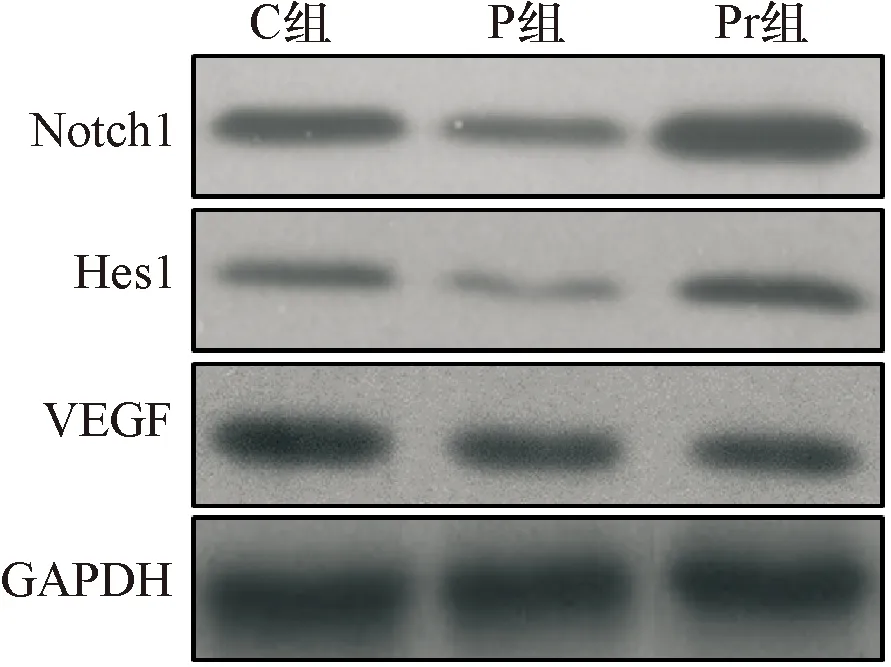
图9Westernblot检测Notch信号通路相关蛋白的表达水平(蛋白条带图)
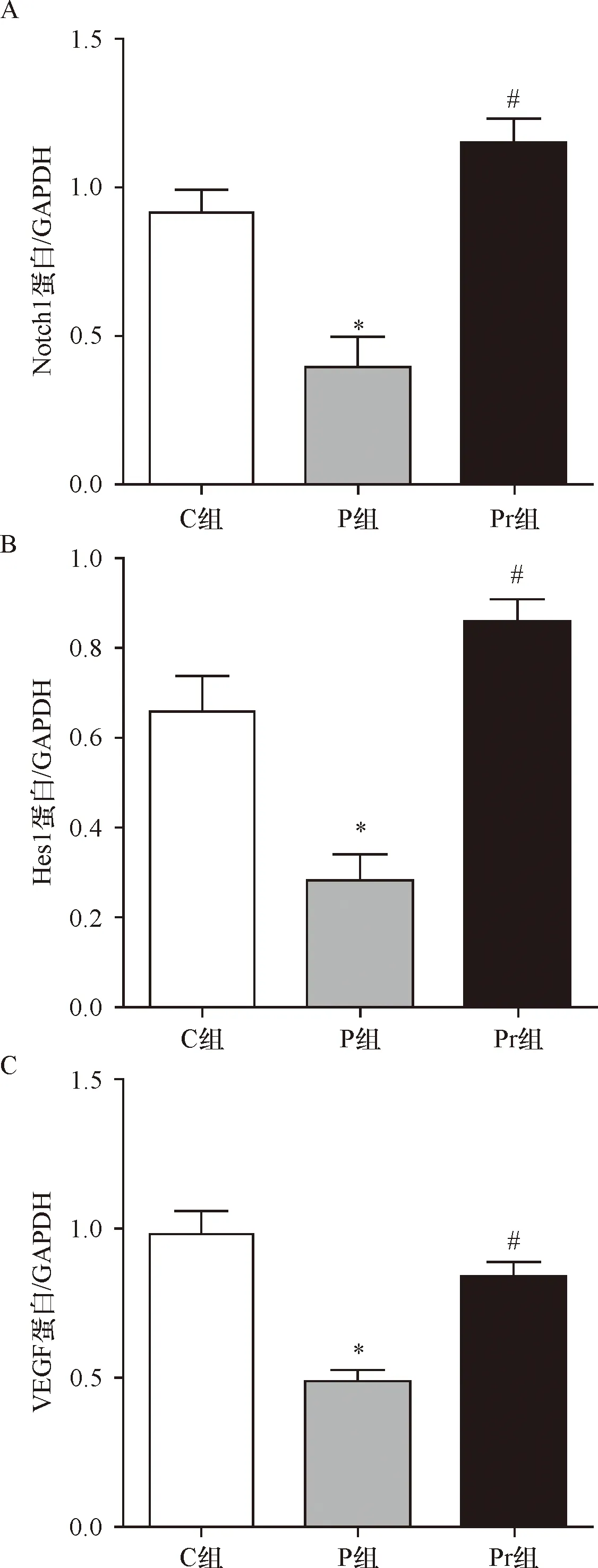
A:Notch1蛋白统计图;B:Hes1蛋白统计图;C:VEGF蛋白的统计图;*与C组比较P<0.01;#与P组比较P<0.01
图10Westernblot检测Notch信号通路相关蛋白的表达水平

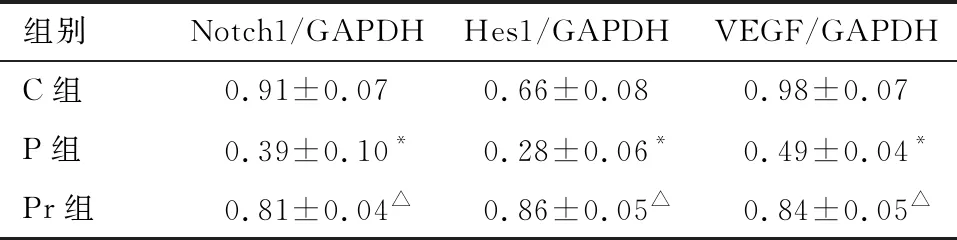
组别Notch1/GAPDHHes1/GAPDHVEGF/GAPDHC组0.91±0.070.66±0.080.98±0.07P组0.39±0.10*0.28±0.06*0.49±0.04*Pr组0.81±0.04△0.86±0.05△0.84±0.05△
*与C组比较P<0.01;△与P组比较P<0.01
Notch信号通路是存在于多种生物体内的高度保守的信号通路,参与调控细胞的多个生理过程,与细胞的增殖、凋亡和分化等密切相关[14];相邻细胞间的Notch受体与配体相互结合可启动Notch信号通路,进而激活下游靶蛋白Hes1的表达,发挥生物学作用[15]。值得注意的是,Notch信号通路在不同的组织中发挥的调节作用并不完全相同,Butko等[16]研究认为Notch信号通路可有效促进正常造血干细胞的自我更新,发挥维持干性的作用,有效抑制干细胞向其他细胞分化;同时,大量的研究证据提示抑制Notch信号的激活可有效抑制急性髓系白血病细胞的增殖,使得急性髓系白血病细胞生长停滞、凋亡[17-18];Sengupta等[19]发现Notch信号通路在急性期的CML患者中被激活的比例增加,急性期CML患者体内Hes1的表达显著增加;上述的结果均提示Notch信号通路及靶基因Hes1可调控髓系白血病进展。本研究发现泊那替尼可有效降低KBM5R细胞中Notch1和Hes1的表达,抑制Notch信号通路的激活,进而促进凋亡蛋白的表达,增加细胞内ROS的水平,增加细胞凋亡。同时采用Notch信号通路激动剂rhNF-κB激活Notch后,细胞的增殖显著增加,凋亡的数量显著降低。Kannan等[20]研究认为激活骨髓中Notch信号通路的激活会显著增加高危急性髓系白血病患者不良预后的风险。本研究还发现抑制Notch信号通路可显著降低VEGF的表达,该结果提示泊那替尼通过抑制Notch信号通路,进而减少肿瘤细胞内VEGF的表达,进而发挥促进KBM5R细胞凋亡的作用。Ikram等[21]研究认为血管发育及新生与多种血液系统肿瘤的发生、发展及肿瘤细胞对化疗药物的敏感性密切相关。
综上所述,泊那替尼通过抑制Notch信号通路,降低VEGF的表达,增加T315I突变的CML细胞中ROS的水平,增加凋亡蛋白的表达,促进细胞凋亡,发挥治疗T315I突变CML患者的作用。本研究结果进一步揭示CML细胞出现T315I突变的机制,为T315I突变CML患者的治疗药物选择提供理论依据。

