甲烷水合物藏降压+注入开采技术分析研究
张 磊
(中国石化胜利石油工程有限公司钻井工艺研究院,山东东营 257017)
2003年至2012年阿拉斯加北坡进行的一系列试验及现场试验:利用二氧化碳进行交换水合物中的CH4,作为含甲烷水合物藏生产的可行性进行了分析研究。利用CO2交换技术的实验室研究成果,进行了多年的现场试验研究。在阿拉斯加北坡上成功地完成了对CO2注入量和CO2交换的研究。这项复杂的实地试验是多学科的。在设计完井和生产过程中结合了实验室和仿真模型的工作方法。由阿拉斯加以外的地区承建商及服务供应商提供专业人员及专用设备促进了该项目的高效实施。阿拉斯加北坡的Ignik Sikumi现场试验成功的证明二氧化碳可以注入一个充满水合物的含水储层,CO2/CH4交换技术开发天然气水合物藏的应用在未来可能具有商业可行性。
2013年3月在日本东海岸外的南开槽东部地区成功施工世界上第一个海底甲烷水合物完井系统并进行了降压法的生产试验。该完井系统采用电潜泵(ESP)与井下实时监测相结合同时产生分离的流体和气体流到地面,结合自然和人工分离方法实现水合物的试采。
陆地和海上的试采表明:仅以一种方法降压或者CO2/CH4交换技术实现天然气水合物的商业化开采难度非常大,甚至可以说不现实。本文提出的降压+注入法组合一体化循环开采技术为开采天然气水合物提供了新的可行的思路。
1 技术原理
甲烷水合物开采方法有热激法、降压法、化学抑制剂法、CO2置换法、地面分解法等[3-5],降压法是当水合物储层下方赋存大量游离气或其他流体时,通过抽吸方式将此游离气体或其他流体抽出,降低该区域压力,打破原有地层相平衡,进而迫使天然气水合物分解的方法。降压法不需要连续激发,设备简单,成本较低,适用于大面积开采,是现有开采方法中较为有效有前景的一种开采方法。
CO2置换法是将CO2注入海底天然气水合物层,由于CO2较甲烷更易形成水合物且其水合物稳定赋存压力比甲烷水合物低,在温度、压力满足一定条件时,CO2便自发置换出甲烷水合物中的甲烷分子(原理:CH4·nH2O+CO2=CO2·nH2O+CH4),以此实现天然气水合物的开采。该置换反应自发进行,受扩散控制,满足热力学和动力学原理,是一种新兴的理论可行的开采方式。
本文提出的降压+注入法组合一体化循环开采技术方法。降压与上述提出的降压法相同,注入的液体含有CO2和促进甲烷水合物分解的分解剂(生物醇)和保证储层渗透率的多孔介质材料,也可以对注入的流体加热。这样可以实现现有四种技术方法合一。注采一体化循环可以保证生产的速率及连续性。从而实现商业化的开采。
2 甲烷水合物藏特征
降压+注入法组合一体化循环开采技术除了从经济观点考量外,这些储量中有多少能够安全的提取出来还没有得到证实。进一步了解储层特征,结合储层的流动运输性质和热力学,可以更好地为生产服务。甲烷水合物藏的边界条件(见表1),储层性质(见表2),储层介质性质(见表3)。

表1 甲烷水合物藏初始条件和边界条件

表2 储层性质

表3 储层介质属性
3 水合物藏理论分析
3.1 组分相分析
水合物具有多组分性质,水合物与其他相之间相互作用,形成水合物的各种相,其中每一相都具有独特的填充组分和化学势。考虑到任何特定水合物体系中可能存在的所有相,吉布相态规律不可能完全填充,平衡也不可能建立。因此,动力状态由热力学第一和第二定律的结合来控制,最稳定的水合物首先形成。分析相之间竞争的水合物相变的影响,受一种使吉布斯自由能最小的方案质量和热量传输的限制。
自然界中的水合物可由气体、水和吸附相中的水合物形成。例如,水合物的形成可能发生在气相中的水和CH4,这是最常见的讨论路线[1],其描述为:

水合物也可以由水形成,并在水相中溶解CH4[6,7]。从理论上看,水合物也可以在水溶解水合物[8]前相内形成。天然气水合物藏内注入CO2乳液作为甲烷生产工艺和CO2封存方法涉及两种机理。其主要机理是孔隙水和注入CO2形成新的CO2水合物,其描述为:
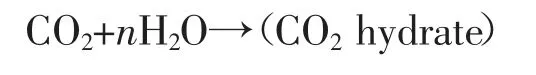
其中n为水化数,等于7.67(假设CO2只填充较大的空腔)。另一种机制是CH4在水合物结构内的固相交换和注入CO2,描述为:

该机制受固体扩散率的限制,因此速度相对较慢,当孔隙介质含水饱和度较低(≈5 %)时,该机制占主导地位。其中CO2填充在6个较大的空腔中,CH4填充在2个较小的空腔中。形成的混合CO2/CH4水合物和CO2水合物在热力学上优于CH4水合物。因此,CO2/CH4水合物与CO2水合物的化学亲和力越大,其稳定性越好。水合物的形成是一个放热反应。因此,新的CO2水合物的生成热为附近的CH4水合物提供了所需的离解热,并有助于该过程的继续。因此,从热力学、动力学的角度该过程都是可行的。需要采取一些措施促进该过程的发生,以期待达到商业生产的速率要求。以前的试验研究表明:该置换可以在多孔材料中高速进行,因此,保证储层的孔隙度与渗透率非常关键。
3.2 水合物成核理论
利用经典成核理论可以计算完整CH4水合物、CO2水合物及CO2和CH4水合物的生长速率:
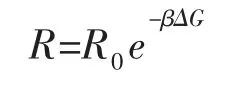
式中:R-水合物增长的动力学速率。利用吉布斯自由能最小化法计算了水合物的竞争相变。自由能计算为:
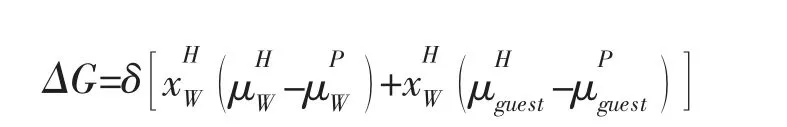
上述方程给出了水合物与水合物形成之间的化学势差。x-摩尔分数;μ-化学势;H-水合物相;P-母相(水分子,气体分子)。其中的“客体”分子(即CO2)产生。δ+1描述水合物生长,δ-1描述了水合物分解。有关水合物不同路线和动力学速率计算的详细信息,请参考文献[1-7]。

