类泛素化蛋白NEDD8单克隆抗体制备
姚 威,孙海伟,霍 娜,于婉琪,萧 飒,陈鸿军
(1.中国农业科学院上海兽医研究所,上海200241;2.西北农林科技大学动物医学院,杨凌712100)
类泛素蛋白NEDD8(neural precursor cell expressed developmentally down-regulated 8)最初的报道是在小鼠胚胎的脑组织中高度富集的新的mRNA[1]。NEDD8含有81个氨基酸,是一种类泛素蛋白修饰分子,与泛素分子的一致性为59%,相似性高达80%,其相似程度是众多类泛素分子中最高的[2]。研究表明,Nedd8能像泛素一样在体内固有酶促作用下被共价结合到底物蛋白上,参与蛋白质翻译后修饰,这一过程被称为NEDDylation[3]。NEDDylation的发生机制与泛素化(Ubiquitination)[4]和SUMOylation[5-6]相似,成熟的NEDD8分子可以通过其C端的甘氨酸与UBA3半胱氨酸活性位点形成一个高能量的硫酯键,UBA3是NEDD8活化酶(E1)(APPBP1和UBA3组成的异源二聚体)的催化亚单位且具有ATP依赖性。而后,活化的NEDD8被转移到结合酶E2(Ubc12/UBE2M或UBE2F)的半胱氨酸活性位点并形成硫酯键,最后,NEDD8被E3连接酶带到相应的底物蛋白的赖氨酸残基形成异肽键[7-8]。
迄今为止,NEDDylation修饰的底物尚未完全明确,本研究制备特异性抗NEDD8单抗,取代商品化的NEDD8抗体,进行免疫学检测,旨在以此作为工具鉴定NEDDylation的底物。
1 材料与方法
1.1 细胞和实验动物人胚肾293T细胞系、小鼠骨髓瘤SP2/0细胞系为本实验室保存;BALB/c小鼠购自中国科学院上海斯莱克动物研究中心。
1.2 载体与主要试剂pET30a(+)原核表达载体及pcDNA3.1-2×Flag真核表达载体为本实验室保存;BamH I、XhoI等限制性核酸内切酶以及T4 DNA连接酶均为公司产品;Phanta MaxSuper-Fidelity DNA聚合酶购自南京诺唯赞生物公司;单抗(mAb)亚类鉴定试剂盒购自Southern biotech公司;3, 3, 5, 5'-四甲基联苯胺底物显色液;增强化学发光试剂盒购自美国赛默飞公司;Hybri-Max聚乙二醇融合试剂盒、辣根过氧化酶酶标兔抗小鼠IgG、完全弗氏佐剂以及不完全弗氏佐剂均为为美国Sigma公司产品;RPMI-1640培养基、HAT培养基、HT培养基、胎牛血清购自美国Gibco公司;Cullin-1抗体D-5购自美国Santa Cruz公司。
1.3 NEDD8 PCR扩增参照人源nedd8基因核苷酸序列(GenBank登录号:CR407662.1),设计并合成了扩增nedd8基因全长的特异性引物。上游引物nedd8-F:5'-CGCGGATCCATGCTAATTAAAGTG AAGACGCTGA-3';下游引物nedd8-F:5'-GCCC TCGAGTCACTGCCTAAGACCACCTCCTCCT-3',引物由苏州金唯智公司合成。收取A549细胞,利用Qiagen RNeasy试剂盒进行RNA提取,以此为模板,利用随机引物N9反转录为cDNA,常规扩增nedd8基因。
1.4 重组原核表达载体及真核表达载体的构建将PCR扩增得到的目的片段用BamH I和XhoI进行双酶切,与同样进行双酶切的pET30a、pcDNA3.1-2×Flag载体4℃连接过夜。然后转化DH5α感受态细胞,提取的质粒经PCR、酶切鉴定后,挑选出疑似阳性重组子的克隆送往苏州金唯智生物科技有限公司进行最终测序,筛选出阳性重组子,原核或真核重组质粒分别命名为pET30-Nedd8、pFlag-Nedd8。
1.5 NEDD8蛋白原核表达及鉴定将阳性重组原核表达质粒转化BL21(DE3)感受态细胞,挑取独立菌落于含100 μg/mL氨苄青霉素的LB培养基中37℃振荡培养过夜,次日以1∶100转接至含氨苄青霉素的LB培养基中,于37℃振荡培养至OD600值达0.4~0.6时,用最终浓度为0.1~1 mmol/L的IPTG在不同温度、时间培养体系进行诱导,确定最终的最佳诱导表达条件。以最佳的表达条件进行大量诱导,然后4℃离心,将离心所得的菌体送往吉尔生化(上海)有限公司进行纯化及浓缩,最后将得到的表达产物进行SDS-PAGE分析。
1.6 小鼠免疫及抗体制备取经过纯化的His-NEDD8蛋白为免疫原疫腹腔注射6周龄的BALB/c雌性小鼠,每隔7 d免疫一次,每次免疫量为50 μg。一免用等体积的完全弗氏佐剂包裹免疫原经腹腔免疫,二免用等体积的不完全弗氏佐剂包裹免疫原经腹腔免疫,三免直接用纯化抗原经腹腔免疫小鼠,三免后第3 d时按参考文献[11]方法制备单抗[11]。
1.7 间接ELISA方法的建立对免疫小鼠及非免疫小鼠进行眼球采血,免疫小鼠血清作为阳性血清,正常非免疫小鼠血清和SP2/0上清作为阴性血清,纯化的免疫原蛋白作为包被抗原,HRP标记山羊抗鼠IgG作为酶标二抗,以免疫小鼠多抗血清经矩阵ELISA的方法确定最佳抗原包被浓度,按照常规的方法进行包备、封闭和洗涤后,4℃保存,待后续筛选单抗使用。
1.8 SDS-PAGE和Western blot鉴定正常293T细胞以及过表达pFlag-Nedd8和pFlag-Ub的293T细胞经变性处理后,按照常规方法转印至NC膜,利用含5%脱脂乳TBST缓冲液4℃封闭过夜,加入待检单克隆抗体,将各种抗体反应的NC膜放置于37℃中作用4 h,TBST洗涤3次,HRP标记兔抗鼠IgG室温作用2 h,ECL显色试剂盒曝光显色。
1.9 免疫共沉淀(Co-immuno-precipitation,Co-IP)293T细胞铺10 cm细胞培养皿,待细胞长满后弃细胞上清,用常温PBS洗2遍。向培养皿中加入1 mL弱性RIPA细胞裂解液置于冰上裂解30~45 min,中间每隔15 min轻轻晃动培养皿使裂解液均匀分布。将裂解液收集到离心管中于4℃、13 400×g离心10 min。将裂解液分装到2个离心管中,每个离心管中分别加入30 μL的Protein A/G,同时分别加入2 μL Cullin-1抗体和鼠源IgG作为阴性对照。另外取40 μL的裂解产物加入10 μL的5×SDS Loading buffer,95℃加热样品10 min,该样品作为IP实验的对照。抗体、蛋白裂解液及protein A/G共孵育5 h后,用IP裂解液洗涤3~4次,用40 μL IP裂解液重悬Protein A/G Agarose并加入10 μL 5×SDS Loading buffer煮样。4℃、10 800×g离心10 min,取上清,将Input、IgG对照、IP样品进行SDS-PAGE,然后进行后续的Western blot分析。同样的方法用制备的单克隆抗体进行免疫共沉淀实验。
1.10 NEDD8抗原表位鉴定根据NEDD8蛋白疏水区及亲水区,将nedd8基因分成不同的截短体,通过同源重组的方法克隆至pET30a载体上。所用引物如下:N8-R:5'-CTCGAGCACCACCACCAC-3';N829aa-F:5'-GTGGTGGTGGTGCTCGAGTCAA CGCTCC TTGATTCG-3';N838aa-F: 5'-GTGGTGG TGGTGCTCGAGTCATGGGGGGATTCCCTC-3';N847aa-F: 5'-GTGGTGGTGGTGCTCGAGTCAGCC ACTGTAGATGAG-3';N858aa-F: 5'-GTGGTGGT GGTGCTCGAGTCAATCAGCTGCTGTCTT-3'。重组载体分别命名为pET30-NEDD8 (1~29aa)、pET30-NEDD8 (1~38aa)、pET30-NEDD8 (1~47aa)、pET30-NEDD8(1~58aa)。将阳性重组原核表达质粒转化BL21(DE3)感受态细胞,进行原核表达,Western blot检测NEDD8单克隆抗体针对的抗原表位。
2 结果
2.1 原核重组质粒pET30-Nedd8鉴定参照人源nedd8核苷酸序列,设计并合成了扩增nedd8基因全长的特异性引物,从A549基因组中扩增出nedd8片段,大小为243 bp,经双酶切后克隆入载体pET30a(+)中,经过PCR鉴定和测序,nedd8基因已经被正确插入到表达载体中,且方向正确阅读框完整,无碱基突变,表明已成功构建原核表达重组质粒pET-Nedd8。
2.2 重组蛋白的表达和纯化结果将构建好的pETNedd8转化至BL21(DE3)感受态细胞,经过条件优化,确定在37℃条件下,经1 mmol/L的IPTG诱导8 h时,可溶性rNEDD8蛋白的产量最高。由图1可见,rNEDD8蛋白在上清及包涵体中均有大量表达。大量诱导表达之后,送往上海吉尔生化公司纯化,由图2可见,纯化结果良好,纯化后的蛋白浓度为0.51 mg/mL。
2.3 间接ELISA方法建立每只小鼠免疫50 μg纯化蛋白,共进行3次免疫,在最后一次免疫后72 h之内进行细胞融合[11]。根据ELISA矩阵法,确定蛋白的最佳包被浓度为32 ng(稀释度为1∶1600),阳性血清和阴性血清的最佳稀释倍数为1∶2000。
2.4 单抗制备免疫后的小鼠取脾脏进行细胞融合,利用间接ELISA以及Western blot方法进行筛选,获得3株能稳定分泌抗体的杂交瘤细胞株,分别命名为1G3、1G11、4B7。这3株单克隆抗体的OD450值维持在3.5以上,而SP2/0上清对照和阴性血清对照OD450值维持在0.5以下,对上述单抗进行亚克隆纯化及扩大培养,分别按照常规方法制备腹水。经间接ELISA检测发现,3个单克隆抗体的亚克隆株全部具有较高的ELISA效价,且分泌的抗体都能识别重组蛋白rNEDD8蛋白。在后续的培养过程中发现1G11杂交瘤细胞株的ELISA效价比较稳定,所以选择1G11单抗作为最终的杂交瘤细胞株。mAb亚类鉴定试剂盒鉴定表明,这株mAb重链属于IgG1α,轻链属于κ。
2.5 Western blot检测由图2显示,分泌的3个单克隆抗体均能识别重组蛋白rNEDD8。由于NEDD8蛋白与泛素蛋白Ub具有高度同源性,为了确定NEDD8单克隆抗体的特异性,本研究利用pFlag-Nedd8、pFlag-Ub质粒分别转染293T细胞,用单克隆抗体进行Western blot检测。结果发现:单抗1G11能够特异性识别pFlag-Nedd8质粒转染细胞裂解产物,形成多条NEDD8修饰的蛋白梯度,而与pFlag-Ub质粒转染细胞裂解产物不反应(图2)。
2.6 Co-IP检测结果为检测单克隆抗体是否适用于Co-IP实验,本研究检测Cullin-1的NEDDylation修饰。由图3所示,无论用Cullin-1抗体还是用1G11单抗,均可以识别被NEDD8修饰的Cullin-1蛋白,表明单抗能够识别Cullin-1的NEDD8修饰。这说明制备的单克隆抗体具有良好的免疫反应性和特异性,且可用于Co-IP共沉淀实验。
2.7 NEDD8抗原表位鉴定根据Protean软件分析NEDD8蛋白的疏水区及亲水区,构建不同的原核表达载体,分段表达NEDD8蛋白,长度分别为29 aa、38 aa、47 aa、58 aa以及全长。原核表达之后,经过SDS-PAGE电泳,由从图4A可见,各截短体蛋白都能够获得成功表达。将这些表达产物作为抗原,用1G11单抗为一抗,进行Western blot分析。由图4B可见,29 aa长度的多肽不能够被识别,而38 aa及以上长度的多肽的则反应性良好。结合图4C序列比对结果,可以推断,单克隆抗体1G11的识别表位可能在29~32 aa,该段表位的aa序列为29RVEE32,其识别区的结构模拟图蓝色球状区域(图4D)。
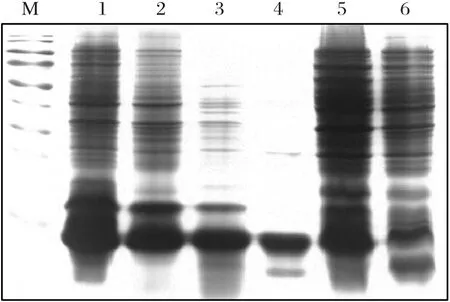
图1 重组蛋白rNEDD8的SDS-PAGE分析Fig.1 Analysis of the recombinant protein by SDS-PAGE
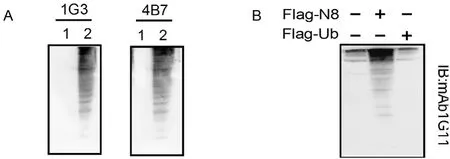
图2 单克隆抗体免疫反应和特异性分析Fig.2 Immunoreaction of specificity analysis of mAb 1G11

图3 NEDDylated修饰Cul1修饰检测Fig.3 Detection of NEDDylated Cullin-1 by co-IP assay
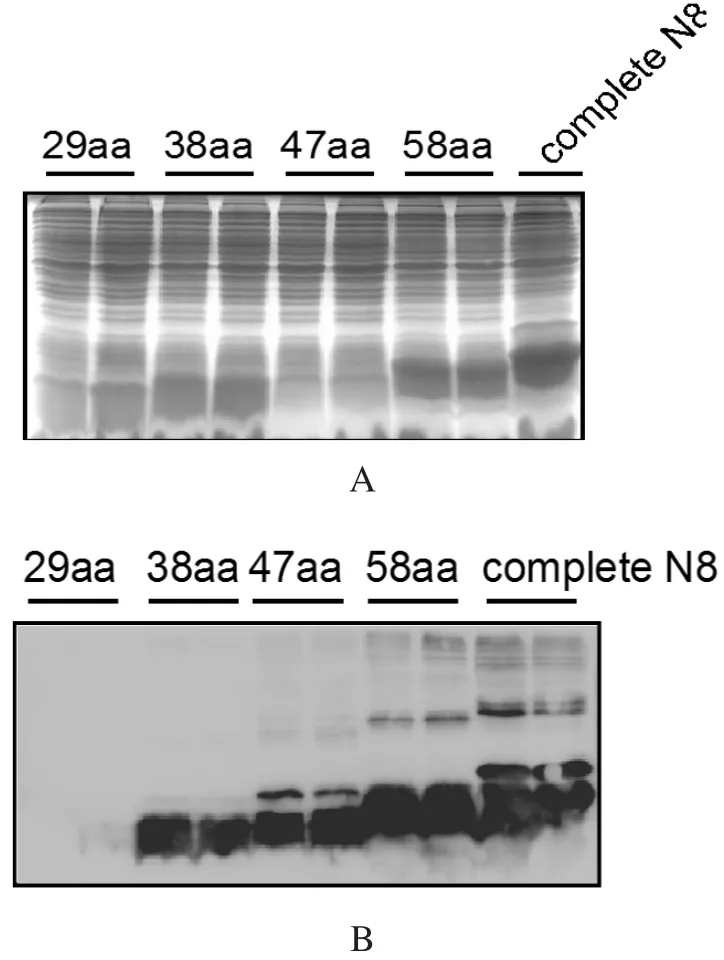

图4 表位鉴定Fig.4 Characterization of the epitope of mAb 1G11
3 讨论
NEDDylation是一种类泛素化的蛋白质翻译后修饰途径。在此过程中,类泛素化小分子NEDD8通过NAE1激活酶、E2结合酶与E3连接酶的催化作用,共价结合到蛋白底物上,对其进行修饰。NEDDylation目前被认为广泛地参与调控蛋白的活性、稳定性、细胞定位以及蛋白间互作,与癌症、发育疾病和病毒感染之间都存在着紧密的联系。人免疫缺陷症病毒多个病毒蛋白通过不同方式劫持Cullin相关的E3连接酶(CRLs)复合物,从而利用了NEDDylation修饰功能,实现逃避免疫和促进病毒复制[9-10]。在感染单纯疱疹病毒的细胞中,NEDDylation可以通过加强CRL对IκB的泛素化,促进其在蛋白酶体的降解,进而释放具有活性的NF-κB入核,启动干扰素基因的转录[11]。而在卡波氏肉瘤病毒感染的细胞中,NEDDylation也可以通过启动NF-κB途径来调控病毒的潜伏期相关基因表达[12]。
NEDDylation还能够修饰病毒蛋白,在多种病毒的生命周期中发挥重要作用,如流感病毒的PB2蛋白被NEDD8蛋白修饰后其稳定性降低,从而抑制流感病毒的复制[13];HDM2能够增强乙型肝炎病毒HBx的NEDDylation修饰,从而抑制其泛素化降解,增强HBx蛋白的稳定性及功能[14]。因此,NEDDylation类泛素化修饰途径在天然免疫过程中发挥着重要作用。
市场上虽然已有商品化NEDD8抗体,但是在实际的实验中操作中,并不能满足Co-IP实验需求。本研究制备获得的单抗能够特异性地识别NEDD8蛋白,能用于Co-IP实验。这为今后更深入地研究内源性NEDDylation修饰作用打下了良好的基础,为更好地阐述在病毒感染中NEDDylation的免疫调控作用提供了实用的生物工具。

