碧萝芷通过激活蛋白激酶B改善AML12细胞胰岛素抵抗
钟文霞,王艺颖,2,范斌,谷剑秋
(1.中国医科大学附属第一医院内分泌与代谢病科,沈阳 110001;2.温州医科大学附属第二医院营养科,浙江 温州 310009;3.中国医科大学附属盛京医院神经内科,沈阳 110004)
糖尿病是一组由遗传及环境等多种病因引起的、以碳水化合物和脂质代谢失调为特征的一种代谢性疾病。尽管2型糖尿病的发病机制尚不完全明确,但肝脏的糖脂代谢紊乱一直被认为是其主要发病机制之一。肝脏是人体重要的物质代谢器官,其通过对营养物质的分解、合成、储存及再分配来维持人体的代谢稳态。肝脏出现胰岛素抵抗时,胰岛素对糖原合成及葡萄糖摄取的作用减弱,导致血糖升高;另一方面又促进甘油三酯在肝脏沉积,进一步增强胰岛素抵抗[1]。碧萝芷(pycnogenol,PYC)是法国沿海松树皮提取物,其主要成分为原花青素、儿茶酚、紫杉叶素和酚酸[2],具有强大的抗氧化和抗炎作用。本研究通过体外建立肝脏胰岛素抵抗模型,观察PYC对AML12 细胞糖代谢的影响,并探讨其相关分子机制。
1 材料与方法
1.1 试剂
油酸(oleic acid,OA)购自美国Sigma公司,PYC购自瑞士Horphag 研究有限公司,葡萄糖氧化酶试剂盒购自上海荣盛生物有限公司,糖原染色(periodic acid-schiff stain,PAS)试剂盒购自沈阳万类有限公司,胰岛素受体底物(IRS/p-IRS)抗体、蛋白激酶B(AKT/p-AKT)抗体、磷酸化糖原合成酶激酶3β(p-GSK3β)抗体、GAPDH抗体均购自美国CST公司,实时PCR引物购自上海生工有限公司,PCR试剂盒均购自日本TaKaRa公司。PCR引物如下:GAPDH,正义链 5'-TGTGTCCGTCGTGGATCTGA-3',反义链5'-TTGCTGTTGAAGTCGCAGGAG-3';G6PC,正义链5'-TGGAGTCTTGTCAGGCATTG-3',反义链 5'-GTA GAATCCAAGCGCGAAAC-3';PEPCK,正义链 5'-CT GGCACCTCAGTGAAGACA-3',反义链 5'-TCGATG CCTTCCCAGTAAAC-3';PGC1α,正义链 5'-GTGCC ACCGCCAACCAAGAG-3',反义链 5'-TTCCTCGTGT CCTCGGCTGAG-3';Gpi1,正义链 5'-CAACTGCTA CGGCTGTGAGA-3',反义链 5'-CCCGGACTTGGTGA TGTACT-3';Eno1,正义链 5'-GTGGTGTCCATCAG AGATCC-3',反义链 5'-CGCTTAGGGTTGGTCACTG T-3';PKLR,正义链 5'-AGTCGGAGGTGGAAATTG TG-3',反义链 5'-GCAACGACCTGGGTGATATT-3'。
1.2 方法
1.2.1 细胞培养及处理:以2×105/mL浓度将AML12细胞(上海中科院)接种于6孔板中,37 ℃、5% CO2孵箱内培养。细胞分为5组:(1)空白对照组;(2)PYC50(50 μg/mL)组;(3)OA(200 μmol/L)组;(4)PYC10(10 μg/mL)+OA(200 μmol/L)组;(5)PYC50(50 μg/mL)+OA(200 μmol/L)组。PYC预处理1 h后加入OA,共培养24 h后收集细胞。
1.2.2 细胞培养基上清剩余葡萄糖含量测定:将细胞接种于6孔板,OA处理24 h,取培养基上清液。将葡萄糖标准品用去离子水倍比稀释为5 000、1 250、312.5、78、19.5 μmol/L做标准曲线,工作液按说明书配制(R1∶R2=4∶1),取标准品及待测样品各10 μL加入96孔板中,再加入工作液190 μL,37 ℃水浴30 min,酶标仪测定540 nm处吸光度值。
1.2.3 PAS糖原染色:将细胞接种于24孔板爬片,待细胞生长至80%左右,弃上清,用PBS洗2次,加入高碘酸溶液染色10 min,PBS充分水洗5 min,加入Schiff试剂浸染5~10 min,自来水水洗3次,每次1 min,显微镜下观察细胞染色情况。
1.2.4 实时PCR检测糖异生及糖酵解相关基因表达:按说明书提取总RNA,取1 μg总RNA,按逆转录试剂盒合成单链 cDNA。以cDNA为模板,GAPDH为内参,按 SYBER Green Real-time PCR荧光试剂盒说明书操作,总反应体积20 μL。
1.2.5 Western blotting检测胰岛素信号通路相关蛋白表达:OA处理细胞24 h,加入100 nmol/L胰岛素处理20 min后提取总蛋白,每孔加入60 μL裂解液充分裂解,离心(4 ℃,12 000g,15 min)取上清。蛋白上样量50 μg,电泳(10% SDS-PAGE凝胶)、转膜(50 V,90 min)、5%牛血清蛋白封闭(90 min),一抗IRS(1∶1 000兔抗鼠单克隆IgG)、p-IRS(1∶1 000兔抗鼠单克隆IgG)、AKT(1∶1 000兔抗鼠单克隆IgG)、p-AKT(1∶1 000 兔抗鼠单克隆IgG)、p-GSK3β(1∶1 000兔抗鼠单克隆IgG)、GAPDH(1∶1 000鼠抗鼠单克隆IgG),4 ℃孵育过夜,TBST洗膜(15 min×3次),二抗孵育(1∶5 000,室温2 h),ECL显影,采用ImageJ软件进行灰度值计算。
1.3 统计学分析
2 结果
2.1 PYC对AML12细胞葡萄糖消耗的影响
与空白对照组相比,OA组细胞培养基葡萄糖剩余量明显增加(P<0.05)。PYC10+OA组、PYC50+OA组与OA组比较,培养基葡萄糖剩余含量显著减少(P<0.05),见图1。表明PYC可促进AML12细胞对葡萄糖的消耗。
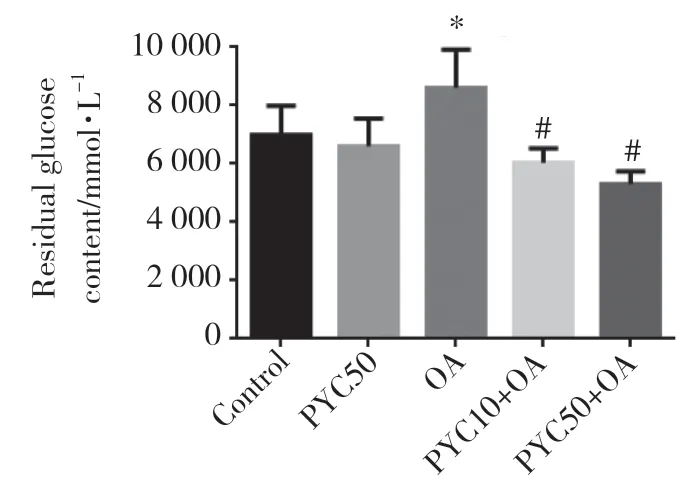
图1 PYC促进AML12细胞对葡萄糖的消耗Fig.1 PYC promoted glucose consumption in AML12 cells
2.2 PYC对AML12细胞糖原合成的影响
细胞爬片PAS糖原染色结果显示,加入PYC处理后,PYC10+OA组、PYC50+OA组与OA组比较,糖原含量明显增加,且以PYC50+OA组更为明显,见图2。
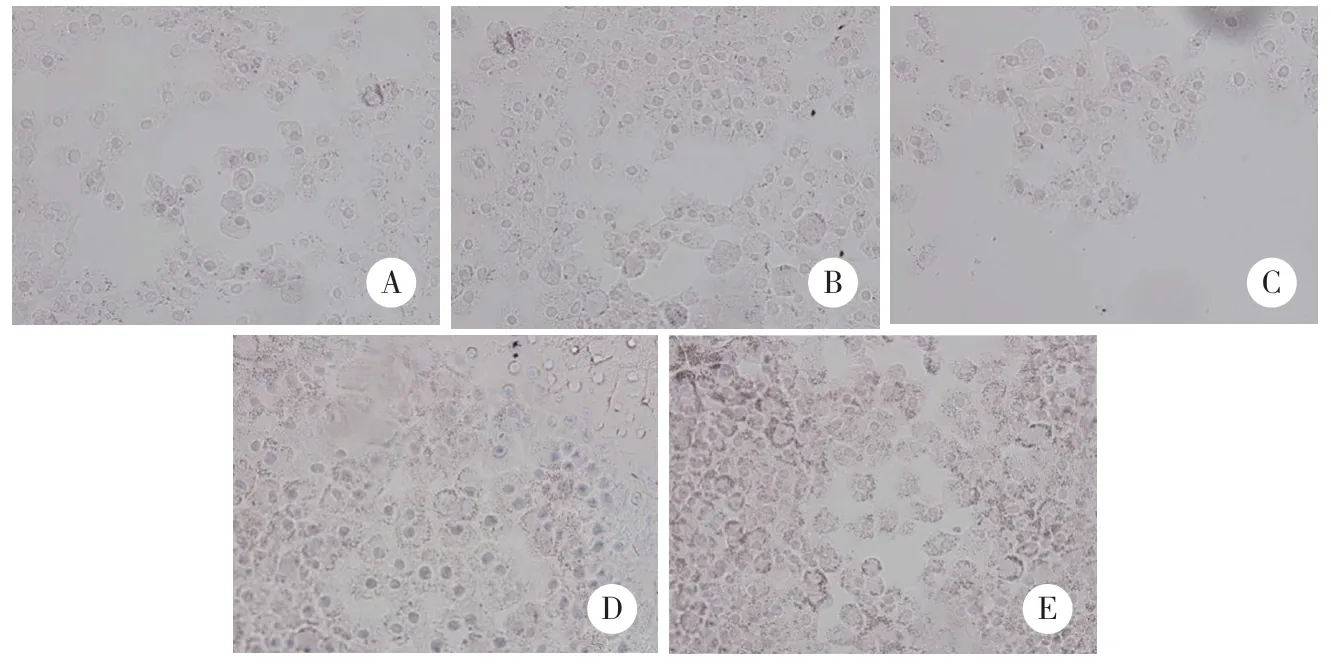
图2 PAS糖原染色 ×400Fig.2 PAS glycogen staining ×400
2.3 PYC对AML12细胞糖酵解及糖异生相关基因表达的影响
血糖平衡的维持与葡萄糖代谢有密切关系,其中糖酵解和糖异生为葡萄糖的重要代谢途径。实时PCR结果发现,与OA组比较,PYC10+OA组、PYC50+OA组中糖异生基因PGC1α、PEPCK及G6PCmRNA 表达无统计学差异(P>0.05),糖酵解基因Gpi1、Eno1mRNA表达增加但差异无统计学意义(P>0.05),PKLRmRNA表达明显增加(P<0.05)。见图3、4。
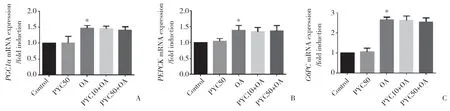
图3 PYC对糖异生基因PGC1α、PEPCK及G6PC mRNA表达的影响Fig.3 Effect of PYC on the mRNA expression of the genes involved in gluconeogenesis,including PGC1α,PEPCK,and G6PC,in AML12 cells
2.4 PYC对胰岛素信号通路的影响
Western blotting结果发现,与OA+insulin组相比,PYC10+OA+insulin组、PYC50+OA+insulin组中IRS及p-IRS蛋白表达无统计学差异(P>0.05),但AKT及p-AKT蛋白、p-GSK3β蛋白表达明显升高(P<0.05)。见图5。

图4 PYC对糖酵解基因Gpi1、Eno1及PKLR mRNA表达的影响Fig.4 Effect of PYC on the mRNA expression of genes involved in glycolysis,including Gpi1,Eno1,and PKLR,in AML12 cells

图5 PYC对胰岛素通路蛋白表达的影响Fig.5 Effect of PYC on the expression of proteins involved in the insulin pathway,including p-GSK3β,p-AKT/AKT,and p-IRS/IRS,in AML12 cells
3 讨论
近年来糖尿病患病率逐年增加,糖尿病的发病机制仍在探索中,但胰岛素抵抗仍是其主要的机制之一。目前临床上有多种降低血糖、改善胰岛素抵抗作用的药物,但是长期使用药物会产生一定的不良反应或出现药物不耐受。因此,有必要对调控糖脂代谢的天然活性物质进行研究。DOSSI等[3]发现玫瑰果油可以抵抗高脂饮食导致的小鼠脂肪肝形成,CHEN等[4]发现白藜芦醇可以通过减轻肥胖小鼠内质网应激及炎症反应改善胰岛素抵抗。PYC是由多种活性物质组成的天然化合物,具有超过其中任何单一组分的强大功效。临床研究发现,PYC可以降低空腹血糖[5],改善血管内皮功能[6]。然而,目前国内外对PYC调控血糖的机制尚不明确。本研究通过给予OA刺激AML12细胞,建立体外肝脏胰岛素抵抗模型,发现PYC可以通过激活胰岛素下游信号通路改善肝细胞胰岛素抵抗。
既往研究[7]发现,在3T3-L1前脂肪细胞中PYC可以促进葡萄糖摄取。本研究给予PYC处理AML12细胞后,发现PYC不仅可以明显增加葡萄糖的消耗,而且还可以促进肝细胞糖原合成。在胰岛素抵抗中,PI3K/AKT是经典的胰岛素信号通路,体内外多种活性物质通过此通路发挥重要的作用。胰岛素与胰岛素受体结合后促使IRS磷酸化活性增强,PI3K的P85/P110复合体与IRS结合,激活AKT,从而调控葡萄糖的摄取、糖原合成、糖酵解、糖异生和脂肪合成等多种代谢过程。GSK3β是糖原合成过程中的重要激酶,GSK3β磷酸化使糖原合酶活性增强,从而促进糖原合成。本研究发现,PYC处理后AKT磷酸化表达增高,且下游p-GSK3β也明显升高,表明PYC可以通过AKT-GSK3β通路促进糖原合成。为进一步了解PYC通过激活胰岛素通路如何调控肝脏葡萄糖代谢,本研究检测了糖异生代谢关键酶G6PC、PEPCK的mRNA表达,发现PYC对糖异生基因G6PC、PEPCK表达无明显作用。叉头蛋白转录因子O1(FoxO1)是糖异生途径中重要的转录因子,它通过与G6PC和PEPCK基因启动子区域结合促进糖异生,而PGC1α则是FoxO1重要的共刺激因子,协同促进糖异生基因的表达。本研究还发现,PYC也不能促进PGC1α的mRNA表达,提示PYC可能不通过糖异生途径发挥作用。在肝脏中,AKT可以激活葡萄糖激酶促进葡萄糖转变成6-磷酸葡萄糖,因此本研究检测了糖酵解途径相关作用酶,发现PYC不能增加糖酵解途径中Eno1和Gpi1的mRNA表达,但可以明显促进糖酵解途径关键酶PKLR的表达。PKLR的主要作用是将磷酸烯醇式丙酮酸转变成丙酮酸,表明PYC很可能是通过糖酵解途径促进糖代谢。
本研究发现,PYC虽然可以促进p-AKT表达,但并没有增加AKT上游p-IRS蛋白的表达。在胰岛素抵抗中,炎症转导通路与胰岛素信号通路存在着联系。PYC可以通过抑制核因子-κB发挥强大的抗氧化抗炎作用[8],而核因子-κB抑制因子激酶则是联系炎症反应与胰岛素抵抗的关键酶之一[9]。本课题组前期研究[10]发现,PYC可以通过激活PPARα调控脂肪小滴蛋白perilipin2表达。因此,PYC是否也可以通过炎症通路或者脂代谢通路调控AKT活性,需进一步深入研究。
综上所述,本研究证明PYC可通过激活AKT促进 PKLR表达调节糖酵解途径,并且促进p-GSK3β表达增加糖原合成,从而调控肝细胞胰岛素抵抗,为研发新的改善胰岛素抵抗药物提供了一定的理论基础。

