肠镜下切开引流术治疗直肠黏膜下脓肿的初步研究*
蔡平,戴晓宇,李坚炯,周海萍
(中国科学院大学宁波华美医院 肛肠外科,浙江 宁波 315000)
直肠黏膜下脓肿传统上行腰麻或者全麻下脓肿切开引流术。近年来,随着消化内镜技术与设备的不断发展,且直肠黏膜对切割无痛觉反应,在无麻醉的情况下,使肠镜下切开引流术治疗直肠黏膜下脓肿成为可能。但目前国内罕见有相关研究报道。本单位在国内较早开展该项技术,至今已积累了一定经验。现报道如下:
1 资料与方法
1.1 一般资料
选择2013年1月-2018年12月在中国科学院大学宁波华美医院收集的直肠黏膜下脓肿病例70 例。其中,男56 例,女14 例;年龄18 ~75 岁,平均43 岁;病程3 ~10 d,平均6 d;首次来诊50 例,经抗炎治疗无效再诊者20 例,70 例患者全部伴有体温升高,46 例高于38.5℃,44 例感觉肛门坠胀、频有便意,30例肛周肿痛剧烈且排尿困难,其中16 例伴有糖尿病,空腹血糖在10 ~21 mmol/L。所有患者均在直肠指诊时,摸到直肠黏膜下饱满、柔软、压痛之肿块,肛门外无红肿、无压痛、摸不到包块,术前行盆腔磁共振成像(magnetic resonance imaging,MRI)确诊为直肠黏膜下脓肿。
1.2 操作器械
Olympus CV-290 肠镜、一次性使用圈套器和威利FORCE2 BJ 高频电刀等。
1.3 手术方法
术前与患者及其家属谈话,告知病情、肠镜治疗方式及替代疗法,签署知情同意书。术前行生理盐水500 ml 灌肠,使其排尽直肠内粪便,由具有丰富治疗经验的肠镜医师进行。术中患者取左侧卧位,清醒状态下鼻导管吸氧,全程心电监护。操作步骤:①行单人肠镜操作,肠镜插入直肠内,助手用注射用水充分冲洗直肠,使直肠清洁,仔细观察直肠黏膜下脓肿部位,可见局部黏膜下隆起明显,如观察困难必要时可倒镜观察,寻找最佳切开引流部位;②助手置入一次性使用圈套器,并连接威利FORCE2 BJ 高频电刀主机,将电流模式调至混切30 W、喷凝式凝血30 W,圈套器金属头部露出约3 mm 左右,使用混切模式纵行逐层切开直肠黏膜层、黏膜下层,注意切开过程需逐步进行,切忌一蹴而就,如有创面出血,及时改用喷凝式凝血模式彻底充分止血,当全层切开后可见脓液自切口涌出;③吸尽脓液后,圈套器继续纵行延长切口,并套除部分直肠黏膜,使脓腔开窗不易闭合,达到充分通畅引流的目的,注意止血彻底;④如脓腔巨大,肠镜可进入脓腔,吸出脓液并彻底冲洗脓腔,如脓腔较小,则肠镜冲水口对准脓腔后,彻底冲洗脓腔即可;⑤再次确认创面无活动性出血后,退出肠镜,手指引导下置入引流管或引流条至脓腔内,并固定妥当。直肠黏膜 下脓肿肠镜下表现及切开引流的操作过程见附图。
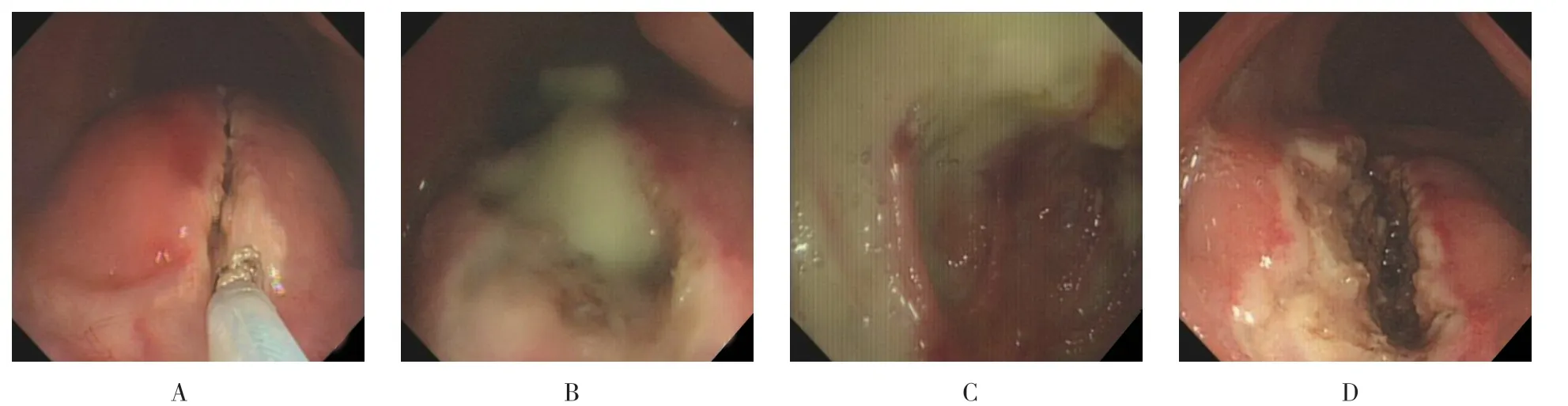
附图 直肠黏膜下脓肿肠镜下表现及切开引流的操作过程Attached fig.Enteroscopic presentation of rectal submucosal abscess and the procedure of incision and drainage
1.4 术后处理
患者术后卧床休息,当天禁食禁饮,常规给予补液、抑酸、止血及抗感染等治疗。密切观察患者症状和生命体征,注意有无腹痛、发热加重、气腹、消化道出血和腹膜炎等并发症出现。对糖尿病患者注意控制血糖,空腹血糖控制在6.0 ~8.0 mmol/L。动态观察血常规、血生化等指标。术后观察引流情况,必要时冲洗脓腔,每日直肠指诊,将手指放入开放的脓腔中做分离和清理动作,以防开放的脓腔两边粘连而形成假愈合,时刻保持肛周清洁干燥。术后3 d 左右确定无明显脓液后,拔除引流管或引流条。
1.5 随访
患者出院后嘱其前6 个月每个月来门诊复诊1 次,术后7 ~12 个月每3 个月门诊复诊1 次,均进行肛门查体,并详细记录查体结果,明确有无复发及形成肛瘘。随访观察12 个月未再复发即确认治愈,为随访终点。
2 结果
70 例直肠黏膜下脓肿患者,均成功行肠镜下脓肿切开引流术,平均操作时间(15.0±5.2)min。24 例患者脓腔巨大置入引流管,46 例患者脓腔较小置入引流条,3 d 后拔除引流管及引流条。70 例患者均治愈出院,无明显并发症发生,无1 例死亡。术后随访12个月,7 例患者术后3 个月确诊形成肛瘘,9 例患者术后6 个月确诊形成肛瘘,确诊条件必须同时符合以下2 点:①肛门指诊发现手术区域可触及条索状硬结;②盆腔MRI 明确形成肛瘘。以上16 例患者均行肛瘘手术后治愈,54 例患者未再复发。
3 讨论
直肠黏膜下脓肿是肛门直肠脓肿的一种,是脓肿位于直肠黏膜下与肌层之间的感染发展成为脓肿。其发展迅速,患者出现周身不适、疲倦和畏寒发热等,甚至出现败血症危及生命[1]。局部以直肠刺激症状为主,有里急后重、下坠感、排尿困难、便次多或便意感等,盆腔MRI 及直肠腔内超声可以确诊[2-3]。
直肠黏膜下脓肿发生于各种人群,男多于女,以青壮年为多,可能是青壮年饮食偏向辛辣刺激食物及饮酒多有关,容易造成肛窦充血、水肿和感染[4]。直肠黏膜下脓肿形成后,仅有很小部分通过抗生素应用得到控制,大部分都需要手术才能治愈,传统的手术方式是切开引流术,切开脓腔将脓液引流干净[5-7]。但是,因为直肠黏膜下脓肿位于直肠内,且位置较高,手术操作视野差,往往切开不够彻底,同时止血困难,导致形成肛瘘高达90.0%以上。形成肛瘘后,再进行第2 次手术治疗,患者痛苦大,疾病的总愈合时间大大延长[8]。
笔者采用肠镜下直肠黏膜下脓肿切开引流术,既符合疾病本身的治疗原则,同时与传统手术相比又具有以下优势:①适用范围广:操作时,因直肠黏膜对切割无痛觉反应,故无需麻醉,对于无法耐受麻醉及外科手术的患者尤为合适;②操作视野好:因在肠镜下操作,可以对直肠进行注气,使肠腔充分扩张,黏膜下脓肿的范围及严重程度清晰可见,便于彻底切开引流冲洗,不留死腔;③手术微创:传统手术有时因为脓肿位置高无法行直肠内切开引流,往往选择在肛周切开切口直达黏膜下脓腔来引流,手术创面大,术后患者换药疼痛明显,而肠镜下脓肿切开引流患者无明显疼痛,且患者术后活动不受限,耐受性好,生活质量高;④安全有效:70 例肠镜下直肠黏膜下脓肿切开引流患者,仅有16 例形成肛瘘,一次性治愈率达77.1%,远高于传统手术,且并发症少,显示出较好的临床疗效和安全性。是一种颇具应用前景的处理直肠黏膜下脓肿的治疗手段。
进行肠镜下直肠黏膜下脓肿切开引流术需注意以下7 点:①术前必须进行灌肠,术中需彻底冲洗直肠,使创面清晰暴露,避免盲目切开;②切开要彻底,需在脓肿最明显的位置纵行全层彻底切开,并且切除部分黏膜以达到脓肿开窗的效果,避免脓腔闭合;③止血要彻底,在切开黏膜的过程中要步步为营,边切开边止血,切勿操之过急,切开过快过深,会导致创面出血,从而影响后续操作;④脓腔冲洗要充分,当脓腔巨大时,肠镜需进入脓腔进行彻底冲洗,使脓液完全流出,并放置引流管或引流条,方便术后冲洗及通畅引流[9];⑤术后换药冲洗要及时,每次换药消毒要严格,将脓腔内分泌物冲洗干净,引流条要放到脓腔底部,保证创口由内向外愈合,防止创口假性愈合[10];⑥术后应用敏感抗生素,直肠黏膜下脓肿往往由肛隐窝感染所致[11-12],多为需氧菌和厌氧菌混合感染,一般采用头孢类和奥硝唑联合应用,再根据细菌培养及药敏实验结果及时调整抗生素[13-14];⑦积极治疗肛隐窝炎和肛乳头炎,防止便秘和腹泻,及时肠镜检查排除肠道特异性疾病,如肠结核、克隆病、溃疡性结肠炎等,并积极治疗[15]。

