凹线仙女蚬Cytb基因片段序列分析及系统进化树初步构建
徐其建 黄镇 林岗
摘 要:初步探究凹线仙女蚬的系统发育地位,为凹线仙女蚬的分子遗传学研究提供前期数据。采用PCR方法扩增得到凹线仙女蚬Cyrenobatissa subsulcata线粒体细胞色素b(Cytb)基因片段序列,序列长为624 bp,并在NCBI上使用NT数据库进行Blast比对分析,进而构建系统进化树,探讨凹线仙女蚬的分类地位。结果显示NT数据库中未见凹线仙女蚬的Cytb基因信息。研究扩增获得的序列与蚬属其他种的Cytb基因片段有88%的相似性,与其他帘蛤目贝类的相似度77.02%~78.53%,表明扩增出的片段是凹线仙女蚬所特有的Cytb基因片段。基于Kimura′s 2-Parameter模型计算得出,3个样本个体的遗传距离仅为0~0.0016,远小于蚬属内种间遗传距离(0.002~0.114),与蚬属的遗传距离为0.127~0.144、与帘蛤目帘蛤科种类遗传距离为0.282~0.335。进化树显示,凹线仙女蚬样品独立聚为一支,与蚬属聚为一大支,支持度为99,表明仙女蚬属与蚬属的亲缘关系较近,与帘蛤科的遗传距离较远。
关键词:凹线仙女蚬;Cytb基因片段;进化树;遗传距离
中图分类号:S917.4 文献标志码:A 文章编号:0253-2301(2020)10-0001-09
DOI: 10.13651/j.cnki.fjnykj.2020.10.001
Abstract: The phylogenetic status of Cyrenobatissa subsulcata was preliminarily explored in this study to provide preliminary data for the molecular genetics research of Cyrenobatissa subsulcata. The PCR method was used to amplify the mitochondrial cytochrome b (Cytb) gene fragment sequence of Cyrenobatissa subsulcata. The sequence length was 624 bp. The Blast comparison analysis was performed on the NCBI by using the NT database to construct a phylogenetic tree and discuss the taxonomic status of Cyrenobatissa subsulcata. The results showed that there was no Cytb gene information of Cyrenobatissa subsulcata in the database. The sequence amplified in this study had 88% similarity with the Cytb gene fragments of other species of the Corbicula, and had 77.02%-78.53% similarity with other clam shellfish, indicating that the fragments amplified by PCR were from the Cytb gene fragment of Cyrenobatissa subsulcata. Based on Kimura′s 2-parameter model, the genetic distance between the three individuals of Cyrenobatissa subsulcata was only 0-0.0016, which was far less than that between the species in Corbicula (0.002-0.114) and with Corbicula was 0.127-0.144, and the genetic distance between the three individuals of Corbicula and the species of Veneridae was 0.282-0.335. The phylogenetic tree showed that the samples of Cyrenobatissa subsulcata were clustered into one branch independently and clustered with Corbicula into a large branch with a support degree of 99, which indicated that Cyrena was closely related to Corbicula, while had a long genetic distance from Veneridae.
Key words: Cyrenobatissa subsulcata;Cytb gene fragment;Phylogenetic tree;Genetic distance
凹線仙女蚬Cyrenobatissa subsulcata隶属于软体动物门Mollusca、双壳纲Bivalvia、异齿亚纲Heterodonta、帘蛤目Veneroida、蚬科Corbiculidae、仙女蚬属Cyrenobatissa。凹线仙女蚬是中国的地方性物种,分布具有局限性,主要栖息于底质为沙或沙泥的咸淡水交汇处,主要分布于广东省(汕头韩江、吴川鉴江)、广西省(防城)、海南省(排港)和台湾省(淡水、苏澳、安平)[1]。蚬科种类在沿海河口半咸水区域也有较多分布,硬壳蚬属的红树蚬Polymesoda erosa分布于中国、菲律宾等地区,我国主要分布于广东省、广西省、海南省、台湾地区等[2];花蚬属的花蚬Cyrenodonax formosana分布于河口砂质区,产于我国台湾地区(淡水)、福建省(云霄)和广西省(防城)[3];蚬属的河蚬广泛分布于江河、湖泊、沟渠及咸淡水交汇处等水域,在福建省的闽江、乌龙江地区有百年的养殖历史,是河口底栖生物的重要组成部分和重要的经济贝类[4-5]。
凹线仙女蚬的研究主要在分类学和生态学[6],对河蚬Corbicula fluminea等蚬科物种研究较多,包括生态特性、遗传差异分析、生长与繁殖等方面[7-9]。凹线仙女蚬是蚬科中个体最大的物种,具有较高的经济价值[6]。蚬的软体部含有较低的脂肪、较高的蛋白质,蚬肉酶解产物具有解酒护肝的功效,可食用也可作为天然调味品,具有较高的营养价值[10]。由于过度捕捞等一系列对自然环境的不合理利用问题,造成河流生态系统结构破坏、生物多样性骤减和生态系统生产力下降,有些地区的蚬类已处于濒危状态,制约了蚬类产业的发展[11-13]。因此,对凹线仙女蚬种质资源的保护、利用研究已显得十分紧迫。物种的分子鉴定是种质资源研究的重要基础,细胞色素b基因(Cytb)作为一种线粒体DNA分子标记,其结构和功能是线粒体DNA的13个蛋白质编码基因中了解最清楚的基因,已广泛用于魁蚶Scapharca broughtonii、鲢Hypophthalmichthys molitrix、松江鲈Trachidermus fasciatus和河蚬Corbicula fluminea等水生物种的分子鉴定、种间变异程度和亲缘关系、不同地理群体遗传多样性和遗传结构等研究[14-19],但目前尚未见凹线仙女蚬线粒体基因研究的相关报道。
本研究以分布于福州市长乐区凹线仙女蚬群体为研究对象,对其Cytb基因片段进行扩增分析,探讨Cytb基因片段作为凹线仙女蚬种类鉴定的分子标记的可行性,可为凹线仙女蚬的遗传多样性、种质资源研究提供基础资料。
1 材料与方法
1.1 试验材料
1.1.1 凹线仙女蚬样本信息 凹线仙女蚬Cyrenobatissa subsulcata个体全部取自福州市长乐区文武砂镇规划中的滨海新区湿地公园(图1)。
1.1.2 试验仪器 PCR仪、凝胶成像分析系统、Nanodrop分光光度计、体视荧光显微镜、电泳仪、解剖镜。
1.1.3 试验试剂 蛋白酶K、Quick-DNA Universal Kit 试剂盒(Zymo Research生物科技公司)、琼脂糖(Sigma-Aldrich)、引物(福州擎科生物技术有限公司合成)、 DNA marker(Thermo Scientific)、 PCR mixture(北京全式金生物技术有限公司)。
1.2 试验方法
1.2.1 形态学性状测定 从采集来的凹线仙女蚬中随机挑选30个,将贝壳表面的水分吸干后,用游標卡尺测量仙女蚬的壳长、壳高、壳宽,精确到0.01 mm。用电子天平测量活体的软体重、壳重、总重精确到0.01 g。凹线仙女蚬的外部形态见图2。
1.2.2 凹线仙女蚬基因组DNA的提取 采用Quick-DNA Universal Kit试剂盒提取基因片段,在所选的30个凹线仙女蚬中随机挑选3个个体,分别提取,每个个体取0.1 g的肌肉组织放入EP管,剪碎后加入95 μL无菌水、95 μL Solid Tissue Buffer(blue)和10 μL蛋白酶K。将EP管放入55℃的水浴锅中水浴1.5 h。当组织溶解后,12000 r·min-1离心10 min,取上层液150 μL,移入新的EP管,加300 μL的Genomic Binding Buffer溶液混合均匀。混合液转入Zymo-spin IIC-xl小管中,12000 r·min-1离心1 min,弃掉下管的液体。再加 400 μL的DNA pre-wash Buffer到小管,12000 r·min-1离心1 min。然后加700 μL的g-DNA wash Buffer液体到小管,12000 r·min-1速度下离心1 min,弃掉下管的液体。最后加入37 μL双蒸水。12000 r·min-1离心1 min后得到DNA溶液,之后进行电泳,并用Nanodrop测定DNA完整度和纯度。
1.2.3 凹线仙女蚬Cytb基因片段的克隆和序列测定 Cytb基因引物设计参考Yamada等[20],序列扩增通用引物为CBF6(5′GCAAGCTTTTGATTCTGTTGTTCACATTG3′)和CBR6(5′GTAGGAATCCTACGCAAAATGAGAATAAGCG3′ )。据梯度PCR确定最适温度57℃,在此温度下进行PCR产物的大体系扩增。PCR 100 μL体系如下:模板DNA 2 μL、上下游引物1 μL、2×PCR mixture 50 μL和无菌水46 μL。分别以3只凹线仙女蚬基因组DNA作模板,放入PCR仪扩增。扩增程序为:预变性94℃ 7 min,变性94℃ 1 min,复性57℃ 45 s,72℃延伸2 min,扩增35个循环结束后,72℃再延伸7 min。预期扩增片段大小640 bp,将PCR产物进行1%的凝胶电泳,选择亮度完好、有特异性条带的PCR产物送到尚亚生物公司测序。
1.3 数据分析
运用Excel对形态学数据进行初步处理,计算变异系数。利用Mega7软件将本研究得到的基因片段在NCBI上使用NT数据库进行Blast比对和序列信息分析。运用Mega7软件内Clustal W进行多序列比对,并辅以人工校对,计算出凹线仙女蚬Cytb基因片段序列长度以及碱基组成;通过Kimura′s 2-Parameter模型计算出凹线仙女蚬与蚬属的其他种Cytb基因片段序列的遗传距离;通过Maximum Likelihood方法对凹线仙女蚬Cytb基因片段进行分子进化树的构建。
2 结果与分析
2.1 凹线仙女蚬形态学性状分析
30个样品各性状表型统计量见表1。各性状的变异系数差异较大,其中壳长、壳高、壳宽形态性状的相对较小,而软体重、壳重和总重性状的相对较大,其中软体重的变异系数最大,为79.35%。
2.2 凹线仙女蚬Cytb基因片段分析
2.2.1 凹线仙女蚬基因组DNA的提取 电泳结果(图3)显示,获得的DNA基因片段大小均在2000 bp以上。所提取的DNA大小完整,条带清晰,说明试剂盒能够有效地提取凹线仙女蚬DNA。进一步对DNA的純度进行检测,浓度均在19 ng·μL-1左右,A260/280均在1.80左右。说明提取的DNA纯度高,无RNA、蛋白质污染,可以进行下一步PCR 扩增反应。
2.2.2 凹线仙女蚬Cytb基因片段扩增 用所设计的引物在57℃退火温度下进行PCR扩增,PCR产物的电泳结果见图4。结果表明,所扩增的3个凹线仙女蚬Cytb基因的PCR扩增产物,大小在640 bp左右,测定的序列峰图完整,没有重叠峰的出现,得到的PCR产物均为单一条带,说明成功扩增出凹线仙女蚬Cytb基因片段。将3个PCR扩增产物进行测序,获得序列。
2.2.3 凹线仙女蚬Cytb基因片段比对分析 经查询,在NCBI数据库尚无凹线仙女蚬Cytb基因序列。将测序得到的凹线仙女蚬Cytb基因片段序列在NCBI上使用NT数据库进行Blast比对及相似性检索,得到100条比对信息,结果见表2。扩增得到凹线仙女蚬的Cytb基因片段序列与蚬属的河蚬、日本蚬、环纹蚬的Cytb基因片段比对的相似度在86.49%~88.25%;与帘蛤目贝类的相似度77.02%~78.53%;与凡氏费氏茧蜂、双斑蟳、三疣梭子蟹的Cytb基因片段比对的相似度在74.12%~74.55%,表明凹线仙女蚬Cytb基因片段序列区分度显著。
2.2.4 凹线仙女蚬Cytb基因片段序列 经测序获得的3条Cytb基因序列中,最长为663 bp,最短为640 bp。运用Mega7软件内Clustal W进行多序列比对,并辅以人工校对,凹线仙女蚬Cytb基因片段的核酸序列为624 bp(图5),该段序列共编码208个氨基酸。从图5可以看出,对3个样品的PCR产物进行比对,序列几乎一致,只在1个碱基上存在突变。
2.2.5 凹线仙女蚬Cytb基因片段序列特征分析 运用Mega7软件内Clustal W进行多序列比对,分析其中624 bp的序列,计算其碱基组成,结果(表3)表明:T(U)、C、A、G的平均碱基组成为45.3%、12.4%、21.5%、20.8%。保守位点623个(99.84%),变异位点1个(0.16%),颠换数为0。其中胸腺嘧啶的比例较高,胞嘧啶的比例偏低;碱基含量T>A>G>C,其中,A+T的含量(66.8%)大于C+G的含量(33.2%),符合线粒体DNA的特征。
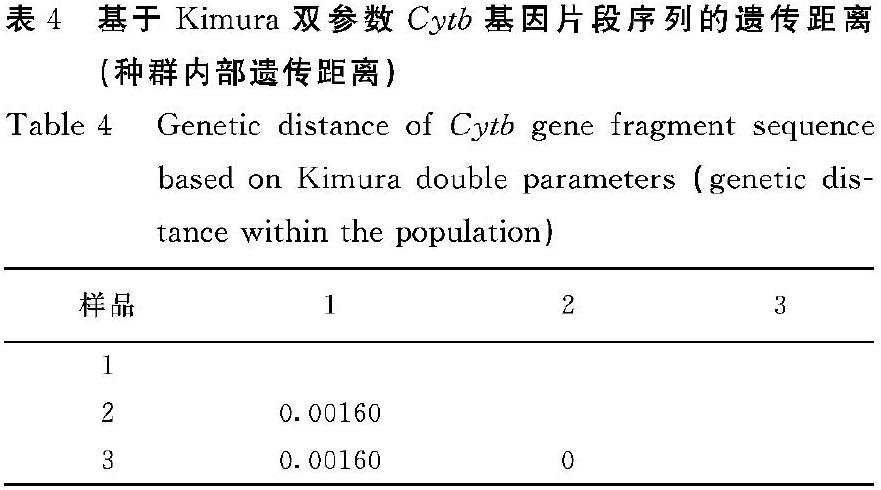
2.2.6 凹线仙女蚬种群内遗传距离 通过Mega7软件中的Kimura′s 2-Parameter模型计算试验样品的Cytb基因片段序列的遗传距离。结果如表4所示:凹线仙女蚬种群内的遗传距离在0~0.00160,平均遗传距离为0.00053,说明种群内差异小。
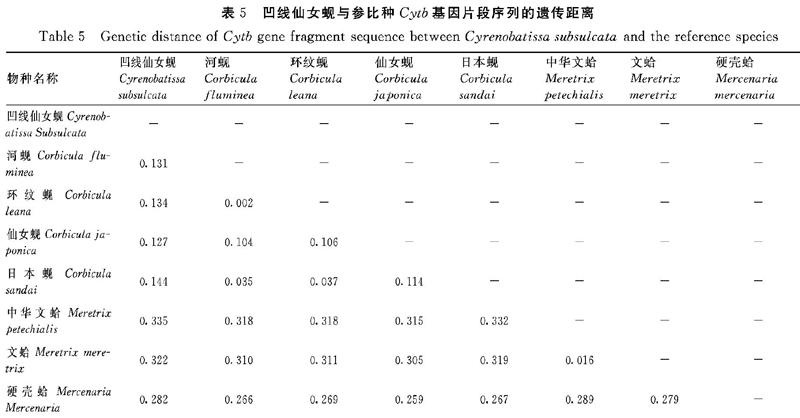
2.2.7 凹线仙女蚬与参比种的属间遗传距离 通过Kimura′s 2-Parameter模型计算出凹线仙女蚬与蚬属的其他种Cytb基因片段序列的遗传距离(表5)。3个样品个体的平均遗传距离为0.00053,远远小于蚬属内种间遗传距离(0.002~0.114)、与蚬属的遗传距离为0.127~0.144、与帘蛤目的帘蛤科种类遗传距离为0.282~0.335,表明仙女蚬属与蚬属能明确区分开,也表明采集的样品为同一物种。
2.2.8 凹线仙女蚬的系统进化树 基于Maximum Likelihood 方法对Cytb基因片段序列进行对比和分析,构建了包括凹线仙女蚬在内的8个双壳类物种的系统进化树(图6)。结果显示,凹线仙女蚬样品独立聚为一支,蚬属的河蚬与环纹蚬聚集再与仙台蚬聚类,最后与日本蚬聚集为一支。仙女蚬属与蚬属又聚为一大支,支持度为99,表明仙女蚬属和蚬属的亲缘关系较近,与帘蛤科的亲缘关系较远。
3 讨论
环境因素是造成双壳类动物个体差异的主要因素之一。蚬科软体动物有因栖息地环境因素形成高度形态变异的特性,仅利用壳体形态特征划分河蚬种类比较困难[21-27]。基于DNA分子标记技术的物种分子鉴定可以弥补形态学分类上存在的样本量多、易形成误差、不能分析基因层次的微观变化情况等缺点,有利于群体遗传育种工作的研究,提高可靠性[28]。而线粒体DNA中Cytb基因分子标记更被大量运用在物种鉴定、系统发育和群体遗传学研究[29-31]。
凹线仙女蚬的壳长、壳宽、壳高的变异系数差异较小,软体重的变异系数最大。这与张俊杰等[32]报道红树蚬、王庆恒等[33]报道波纹巴非蛤的研究结果基本一致。
凹线仙女蚬Cytb基因片段A+T的含量为66.8%,明显大于C+G的含量(33.2%),这一结果与李瑶瑶等[16]在双壳贝类Cytb基因中观察到的结果一致。凹线仙女蚬Cytb基因片段序列与蚬属的河蚬、日本蚬、环纹蚬Cytb基因片段Blast比对结果,结合系统进化树分析表明仙女蚬属与蚬属能明确区分开,也从分子水平上支持凹线仙女蚬为蚬科仙女蚬属而异于蚬属[34]。
保护优质的贝类种质资源成为亟待解决的问题,本研究获得的Cytb基因片段序列可用于凹线仙女蚬的分子鉴定,可为凹线仙女蚬的种质资源研究、蚬科物种间系统进化关系的研究、凹线仙女蚬的生物资源保护和开发利用提供基础资料。
参考文献:
[1]杨文,蔡英亚, 邝雪梅.中国南海经济贝类原色图谱[M].北京:中国农业出版社,2013.
[2]蔡英亚,黄翔鹄,吴洞科.红树蚬的生态观察[J].热带海洋,1995(1):94-98.
[3]徐凤山,张素萍.中国海产双壳类图志[M].北京:科学出版社,2008.
[4]邓勇辉,付辉云,陶志英,等.我国河蚬研究进展与展望[J].江西水产科技,2016(2):33-37.
[5]刘月英,张文珍,王跃先,等.中国经济动物志——淡水软体动物[M].北京:科学出版社,1979.
[6]ZHANG M K.Catalogue of Fresh Water Shells of Taiwan[J].The Malacological Society of ROC,1991(16):86-96.
[7]杞桑,林美心.珠江广州河段河蚬种群的若干生态学研究[J].生态学报,1987(2):161-169.
[8]闻海波.我国主要淡水经济贝类的种质资源研究[D].南京:南京农业大学,2009.
[9]吴丛迪.洪泽湖河蚬繁殖特性及黑黄壳色遗传差异分析[D].上海:上海海洋大学,2019.
[10]张帅,章超桦,高加龙,等.河蚬肉酶解产物解酒护肝功效[J].食品与机械,2019,35(3):166-171.
[11]严维辉,潘元潮,郝忱,等.洪泽湖底栖生物调查报告[J].水利渔业,2007(3):65-66.
[12]袁永浒,王兴元,陈安来,等.洪泽湖螺蚬资源调查报告[J].水产养殖,1994(6):15-16.
[13]毕婷婷,侯刚,张胜宇,等.基于壳长频率分析的洪泽湖河蚬渔获物年龄结构、生长与死亡参数估计[J].水生生物学报,2014,38(4):797-800.
[14]ARIF I A, KHAN H A,BAHKALI A H,et al.DNA marker technology for wildlife conservation[J]. Saudi J Biol,2011,18(3):219-225.
[15]CHEN J,SONG Z,RONG M,et al.The association analysis between Cytb polymorphism and growth traits in three Chinese donkey breeds[J]. Livestock ence,2009,126(1-3):306-309.
[16]李瑶瑶,刘云国,刘凌霄,等.基于线粒体基因ND1、COX1和Cytb的双壳贝类分子系统进化研究[J].福建农林大学学报(自然科学版),2018,47(2):188-197.
[17]王剑平.洞庭湖蚬属的系统分类与生殖特征研究[D].长沙:湖南农业大学,2018.
[18]魏建军,尤宏争,夏苏东,等.松江鲈鱼线粒体Cytb基因分析及其在种质鉴定中的应用[J].河北渔业,2019(8):21-25,61.
[19]杨习文,刘熠,薛向平,等.基于微卫星标记的长江江苏段鲢(Hypophthalmichthys molitrix)增殖放流资源贡献率的评估[J].湖泊科学,2020,32(4):1154-1164.
[20]YAMADA M,ISHIBASHI R,KAWAMURA K,et al.Interrelationships of the freshwater clams Corbicula leana Prime,1864. and C. fluminea (Müller, 1774) distributed in Japan inferred from shell type and mitochondrial DNA Cytb region[J]. Nippon Suisan Gakkaishi,2010,76(5):926-932.
[21]HILLIS D M, PATTON J C. Morphological and Electrophoretic Evidence for Two Species of Corbicula (Bivalvia: Corbiculidae) in North America[J]. The American Midland Naturalist,1982,108(1):74-80.
[22]MORTON B. Polymorphism in Corbicula fluminea(Bivalvia:Corbiculoidea)from HongKong[J].Malacological Review,1987,20:105-127.
[23]ALYAKRINSKAYA I O. Functional Significance and Weight Properties of the Shell in Some Mollusks[J].Biology Bulletin,2005,32(4):397-418.
[24]BRITTON J C,MORTON B.Polymorphism in Corbicula fluminea(Bivalvia:Corbiculoidea)from North America[J].Malacological Review,1986,19:1-44.
[25]RENARD E,BACHMANN V,CARIOU M L,et al.Morphological and molecular differentiation of invasive freshwater species of the genus Corbicula(Bivalvia, Corbiculidea) suggest the presence of three taxa in French rivers[J].Molecular Ecology,2000,9:2009-2016.
[26]BAGATINI Y M,PANARARI R S.Morphological and molecular characterization of Corbicula(Mollusca, Bilvalvia)at Rosana Resevoir,Brazil[J].Acta Scientiarum Biological Sciences,2005,27:397-404
[27]SOUSA R,FREIRE R,RUFINO M,et al.Genetic and shell morphological variability of the invasive bivalve Corbicula fluminea(Mǜller, 1774) in two Portuguese estuaries[J].Estuarine,Coastal and Shelf Science,2007,74:166-174.
[28]劉莹.双齿围沙蚕的分子系统地理学研究[D].青岛:中国海洋大学,2014.
[29]辛一.线粒体COI、COII和CYTB基因在鲍属物种鉴定中的适用性分析[J].海洋科学,2011,35(11):58-62.
[30]于涛,吴彪,杨爱国,等.栉孔扇贝、虾夷扇贝及其杂交子代线粒体COI和Cytb基因遗传多样性分析[J].海洋科学,2016,40(3):1-9.
[31]位正鹏.翡翠贻贝(Perna viridis)线粒体COI片段序列特性和香港巨牡蛎(Crassostrea hongkongensis)线粒体基因组全序列研究[D].青岛:中国海洋大学, 2008.
[32]张俊杰,周浩郎,邢永泽,等.红树蚬表型性状对秋季软体部重量的影响效果分析[J].广西科学,2012,19(4):384-386.
[33]王庆恒,邓岳文,杜晓东.波纹巴非蛤Paphia undulata表型性状通径和回归分析[J].热带海洋学报,2010,29(5):132-135.
[34]徐凤山.中国海双壳类软体动物[M].北京:科学出版社,1997.
(责任编辑:柯文辉)

