补骨脂多糖的分离纯化、结构鉴定及其对RAW264.7巨噬细胞活力的影响
尹震花,张娟娟,陈 林,郭庆丰,张 伟,康文艺,*
(1.黄河科技学院 郑州市天然产物合成生物学重点实验室,郑州市药用资源研究重点实验室,河南 郑州 450063;2.河南省小分子新药研发国际联合实验室,河南 郑州 450063)
多糖是广泛存在于动植物、真菌及藻类中的一种生物大分子,具有抗氧化、抗菌、免疫调节、抗癌、抗血栓等多种药理活性[1-5]。补骨脂为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,为传统中药[6]。按照《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号),补骨脂可用于保健食品。现代研究表明,补骨脂含有香豆素类、黄酮类、单萜类等多种成分,具有抗炎、抗菌、抗氧化、抗肿瘤、降血糖等多种功效[7-8]。关于补骨脂多糖(Psoralea corylifolia polysaccharides,PPs),目前仅国内几位学者对不同产地补骨脂粗多糖的含量及免疫活性进行了初步研究[9-12],鲜见对补骨脂粗多糖的纯化、结构分析及其对RAW264.7巨噬细胞活力影响的研究。水提取的粗多糖溶液中含有色素、蛋白质等杂质,直接测定影响其活性及结构鉴定[13],因此需对补骨脂粗多糖进行分离纯化。
本研究以补骨脂为材料,采用热水提取、乙醇沉淀的方法从补骨脂中提取粗多糖,采用Sevag法除蛋白,经DEAE-52和Sephadex G-100柱色谱分离,对分离纯化得到的多糖的一般理化性质、单糖组成、摩尔质量进行研究,并采取多种光谱手段表征其结构,同时评价其对RAW264.7巨噬细胞活力的影响,旨在为更好地开发和利用补骨脂中的多糖组分提供理论依据。
1 材料与方法
1.1 材料与试剂
补骨脂(批号:170703,产地:发徽亳州)于2018年9月购买于河南省郑州市张仲景大药房,经河南大学中药研究所李昌勤教授鉴定为豆科植物补骨脂的干燥成熟果实,标本存放于黄河科技学院天然药物研究室。
小鼠RAW264.7巨噬细胞 中国科学院上海细胞科学研究所;石油醚、无水乙醇 天津市津东天正精细化学试剂厂;浓硫酸 开封方晶化工厂;苯酚天津凯通化学试剂有限公司;不同摩尔质量的葡聚糖(T-40、T-64、T-150、T-250、T-500) 德国Sigma-Aldrich公司;D(+)-葡萄糖、D(+)-木糖、L(+)-阿拉伯糖、L(+)-鼠李糖、D(+)-甘露糖、D-半乳糖 德国Dr Ehrenstorfer GmbH公司;DEAE-52纤维素 赛谱锐思(北京)科技有限公司;Sephadex G-100 瑞典GE Healthcare Bio-Science AB公司;三氟乙酸、硼氢化钠阿拉丁试剂(上海)有限公司;超纯水 实验室自制;Dulbecco’s Modified Eagle’s Medium(DMEM) 北京Solarbio科技有限公司;胎牛血清 美国Gibco公司;透析袋(相对分子质量8 000~14 000) 上海华蓝化学科技有限公司;96 孔细胞培养板 美国Corning公司;其他试剂均为分析纯。
1.2 仪器与设备
LL-1500型冷冻干燥仪器、TRACE 1310气相色谱仪、二氧化碳细胞培养箱 美国Thermo公司;高效液相色谱(high performance liquid chromatography,HPLC)仪特特世科技(上海)有限公司;Bruker Avanced III400 MHz核磁共振(nuclear magnetic resonance,NMR)波谱仪德国Bruker公司;场发射扫描电子显微镜 美国FEI Quanta 250 FEG公司;傅里叶变换红外光谱仪美国Nicolet公司;EnVision多标记微孔板检测系统美国PerKinElmer公司;分析天平 赛多利斯科学仪器有限公司。
1.3 方法
1.3.1 粗多糖的提取
补骨脂称质量4.4 kg,粉碎,石油醚浸提脱脂3 次,每次3 d,残渣挥发干石油醚,用70%乙醇溶液浸提3 次,每次3 d,残渣挥发至无醇味,加入一定量蒸馏水,于(85±2)℃提取3 次,每次4 h,合并、过滤、浓缩至原体积的1/4,加入无水乙醇调至乙醇体积分数为70%,静置,4 000 r/min离心8 min,回集沉淀,冷冻干燥得到补骨脂粗多糖。
1.3.2 粗多糖的分离纯化
采用S e v a g法[14]除去粗多糖中的蛋白,重复4 次;除蛋白后的多糖经DEAE-52纤维素柱色谱(60 cm×2.5 cm)分离,超纯水、0.05 mol/L NaCl溶液洗脱,经苯酚-浓硫酸法隔管检测,490 nm波长处测吸光度,绘制多糖洗脱曲线,同一洗脱峰进行合并、透析袋透析;再经Sephadex G-100柱色谱(100 cm×1.5 cm),超纯水洗脱,每5 min一管,苯酚-浓硫酸法隔管检测,490 nm波长处测吸光度,合并、冻干纯化得到的多糖。
1.3.3 纯化后多糖的一般理化性质
以葡萄糖为标准品,采用苯酚-浓硫酸法测定多糖的总糖含量[15];通过考马斯亮蓝G-250法进行蛋白质分析[16-17];参考文献[18],测定纯化后的多糖在热水、冷水以及乙醇、正丁醇、丙酮、氯仿、石油醚等有机溶剂中的溶解度,观察溶解性;进行斐林试剂反应、三氯化铁反应、碘-碘化钾反应。
1.3.4 单糖组成分析
按照文献[19]报道的多糖水解、乙酰化及色谱条件等,进行单糖组成分分析。纯化多糖8 mg在110 ℃下用2 mL 4 mol/L的三氟乙酸水解3 h得到水解产物,水解产物与8 mg盐酸羟胺和0.4 mL吡啶在90 ℃反应30 min,再用0.4 mL乙酸酐在90 ℃乙酰化30 min得到乙酰化产物。采用气相色谱法进行单糖检测。标准单糖也用同样的方法衍生得到乙酰化产物。
1.3.5 摩尔质量的测定
分离纯化得到的PPs摩尔质量采用HPLC法测定。色谱条件:Waters液相色谱仪配示差折光检测器;色谱柱为TSK G4000PWXL色谱柱(7.8 mm×300 mm,17 μm);流动相为纯净水,流速1.0 mL/min;进样量10 μL,柱温25 ℃;测定方法:分别取摩尔质量为4×104、6.4×104、1.5×105、2.5×105g/mol和5×105g/mol的葡聚糖对照品100 mg,用纯净水定容至10 mL,过0.22 μm水系膜,在上述色谱条件下进样,记录色谱峰保留时间(tR),以标准摩尔质量的对数值为纵坐标,以tR为横坐标,绘制标准曲线;样品分别以超纯水制成10 mg/mL溶液,在同样色谱条件下进样,记录样品保留时间,利用标准曲线计算样品摩尔质量。
1.3.6 多糖红外光谱测定
取适量的补骨脂纯化多糖,置于玛瑙研钵中,加入适量干燥KBr粉末,研磨混合,压片后测定红外光谱,扫描范围4 000~400 cm-1。
1.3.7 多糖NMR氢谱(1H-NMR)和碳谱(13C-NMR)分析
取15~20 mg补骨脂纯化多糖,用500 μL D2O溶解后加入核磁管中,经布鲁克400 MHz NMR波谱仪,25 ℃测定其1H-NMR和13C-NMR。
1.3.8 多糖微观结构分析
在真空溅射镀膜机中,将干燥的多糖固定在金属短柱上并喷金,用扫描电子显微镜观察补骨脂纯化多糖的微观结构,放大倍数50 000,标尺2 μm。
1.3.9 多糖对RAW264.7巨噬细胞活力的影响
采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测补骨脂纯化多糖对RAW264.7巨噬细胞的活力影响[20]。将RAW264.7巨噬细胞接种于96 孔板中(1×105/孔),CO2环境下37 ℃培养24 h。而后用一系列浓度的多糖溶液对细胞进行预处理。每孔加入10 μL MTT,活细胞线粒体中的琥珀酸脱氢酶被还原为不溶于水的蓝紫色结晶,在490 nm波长处有吸回。通过比较阴性对照组(仅培养基)的吸光度,计算细胞存活率,评价2 个多糖对RAW264.7巨噬细胞的毒性。
2 结果与分析
2.1 PPs的提取、分离与纯化
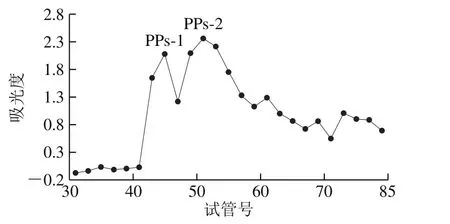
图1 补骨脂粗多糖经DEAE-52纤维素柱色谱洗脱曲线Fig. 1 Elution curve of crude polysaccharides by DEAE-52 cellulose column chromatography
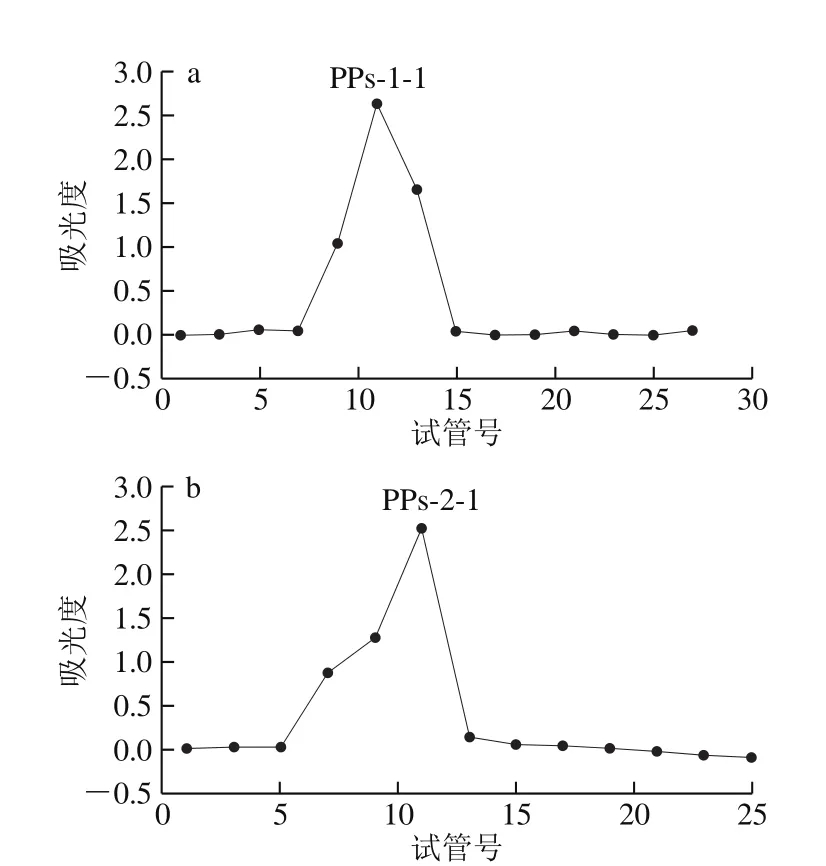
图2 PPs-1(a)和PPs-2(b)经Sephadex G-100柱色谱洗脱曲线Fig. 2 Elution curves of PPs-1 (a) and PPs-2 (b) by Sephadex G-100 column chromatography
补骨脂经石油醚脱脂、70%乙醇溶液提取、热水提醇沉、除蛋白等一系列处理后,PPs得率为1.59%,蛋白质除去率为90.74%。经DEAE-52色谱柱分离,以0.05 mol/L NaCl洗脱时,得到2 个明显主峰,洗脱曲线见图1,分别合并命名为PPs-1和PPs-2。PPs-1和PPs-2经Sephadex G-100色谱柱进一步纯化,洗脱曲线见图2。可以看出,PPs-1和PPs-2经纯化后均得到1 个对称峰,合并浓缩、透析、冻干得到白色粉末,分别命名为PPs-1-1和PPs-2-1。
2.2 多糖的一般理化性质
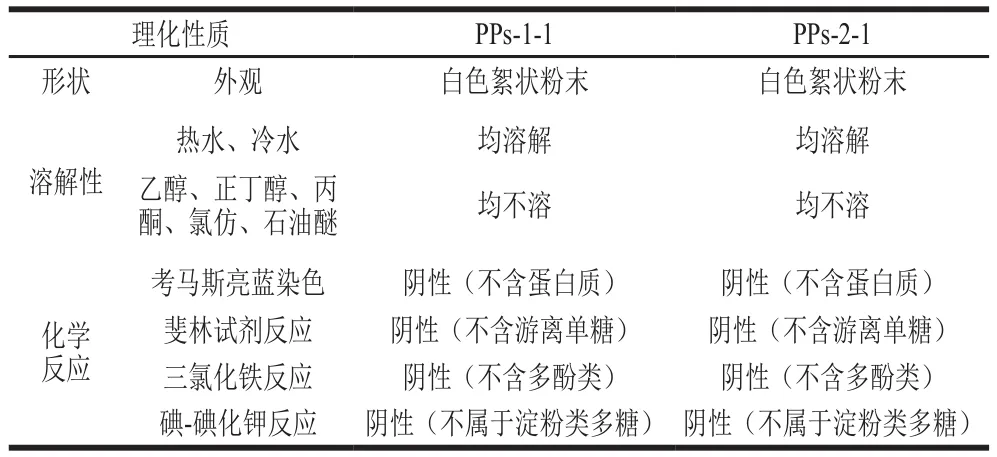
表1 PPs-1-1和PPs-2-1的一般理化性质Table 1 General physicochemical properties of PPs-1-1and PPs-2-1
从表1可以看出,PPs-1-1和PPs-2-1均具有多糖的一般理化性质[21]。以葡萄糖为标准品,采用苯酚-浓硫酸法测定2 种多糖中的总糖含量,结果显示,葡萄糖标准曲线方程为y=5.964x-0.003 6,相关系数r=0.995,其中y为吸光度,x为葡萄糖质量浓度,PPs-1-1和PPs-2-1总糖质量分数分别为(94.35±0.23)%和(95.27±0.42)%。
2.3 单糖组成成分分析
PPs-1-1和PPs-2-1经三氟乙酸水解、乙酸酐乙酰化、氯仿萃取后,样品直接进入气相色谱进行分析,与标准单糖乙酸酐乙酰化后的保留时间进行对比,结果见图3、4。结果表明,从PPs-1-1中鉴定出6 种单糖:鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖,其物质的量比为2.08∶2.43∶1.60∶1.15∶0.673∶13.90;同样,PPs-2-1中也鉴定出6 种单糖,其物质的量比为2.49∶1.14∶1.99∶0.336∶0.612∶5.72。
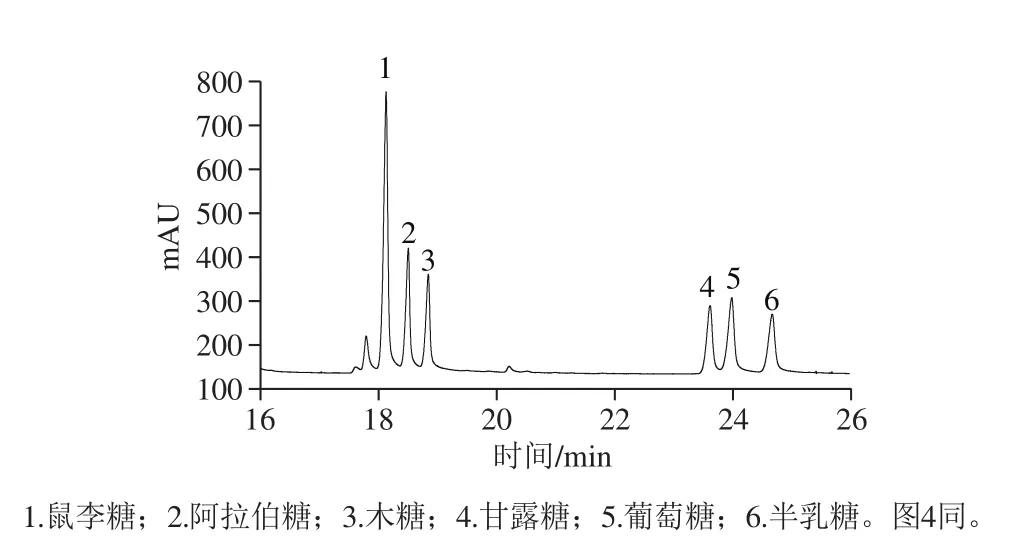
图3 混合标准单糖的气相色谱图Fig. 3 GC chromatograms of mixed standard monosaccharides
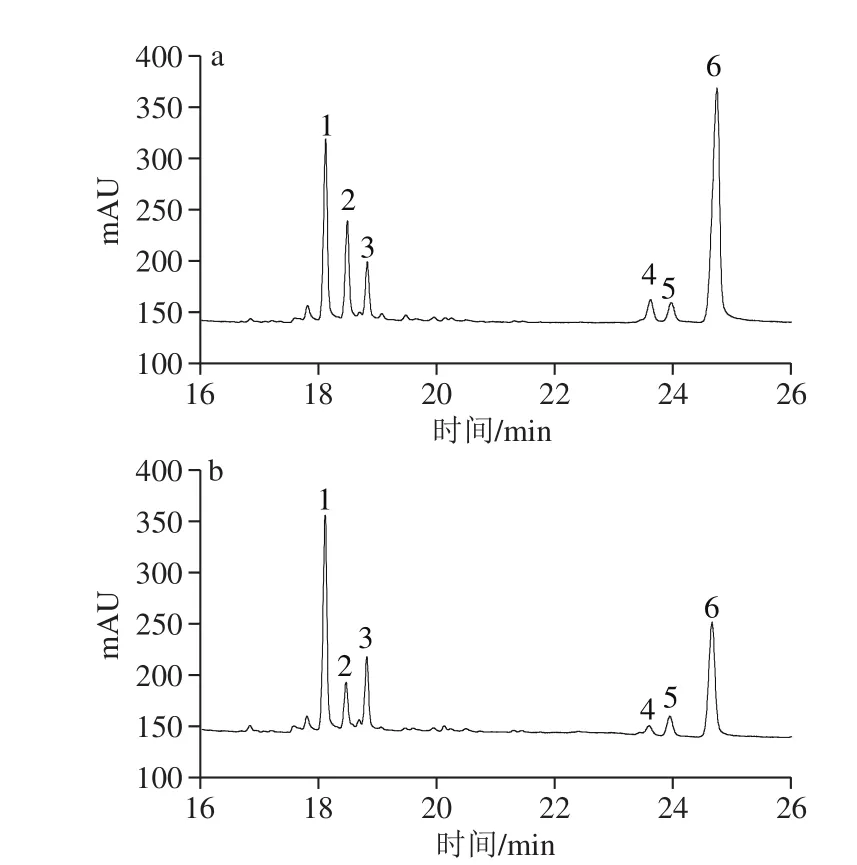
图4 PPs-1-1(a)和PPs-2-1(b)的气相色谱图Fig. 4 GC chromatograms of PPs-1-1 (a) and PPs-2-1 (b)
2.4 多糖的摩尔质量分析
利用HPLC法测定PPs-1-1和PPs-2-1摩尔质量,如图5所示,均为均一单峰。根据葡聚糖Dextran系列得到回归方程为:lgmw=-0.634tR+10.25,R2=0.974。根据保留时间计算出PPs-1-1和PPs-2-1的摩尔质量为3.98×106g/mol和4.47×106g/mol。
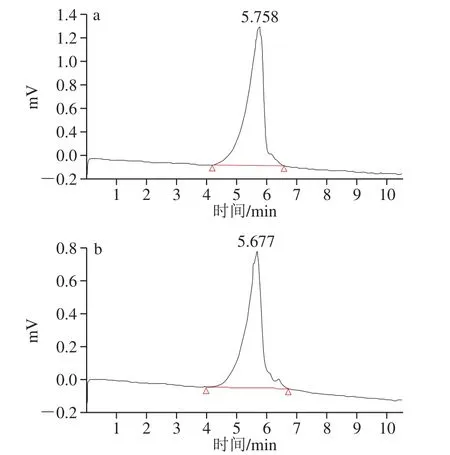
图5 PPs-1-1(a)和PPs-2-1(b)的HPLC图Fig. 5 HPLC profiles of PPs-1-1 (a) and PPs-2-1 (b)
2.5 红外光谱分析
由图6可以看出,在3 400 cm-1附近有一个宽展圆滑强吸回峰(PPs-1-1:3 405 cm-1;PPs-2-1:3 420 cm-1),为O—H伸缩振动峰,由糖分子内或分子间O—H伸缩振动引起的吸回;在2 934、2 937 cm-1处分别出现1 个很弱的特征吸回峰,即为C—H伸缩振动的吸回峰[22-23],这些区域的吸回峰是糖类的特征吸回峰;1 615 cm-1左右(PPs-1-1:1 617 cm-1;PPs-2-1:1 613 cm-1)吸回峰为C=O的伸缩振动峰,1 420 cm-1左右弱吸回峰(PPs-1-1:1 420 cm-1;PPs-2-1:1 417 cm-1)为C—H面内弯曲振动峰[24]。呋喃糖在1 100~1 010 cm-1范围内有2 个吸回峰,吡喃糖在1 100~1 010 cm-1范围内有3 个吸回峰,表明PPs-1-1和PPs-2-1分别含有呋喃和吡喃糖环[25];890 cm-1左右有弱的特征吸回,证实糖残基的连接中存在β-糖苷键,840 cm-1左右较弱的吸回信号,证实α-糖苷键的存在[26]。
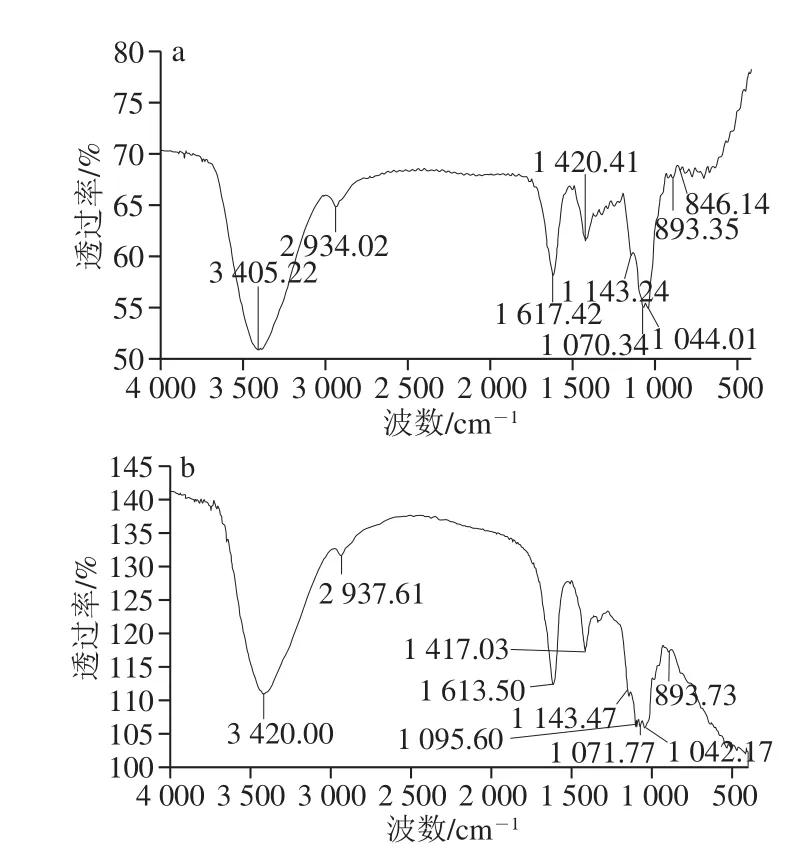
图6 PPs-1-1(a)和PPs-2-1(b)红外光谱图Fig. 6 FT-IR spectra of PPs-1-1 (a) and PPs-2-1 (b)
2.6 NMR谱图分析
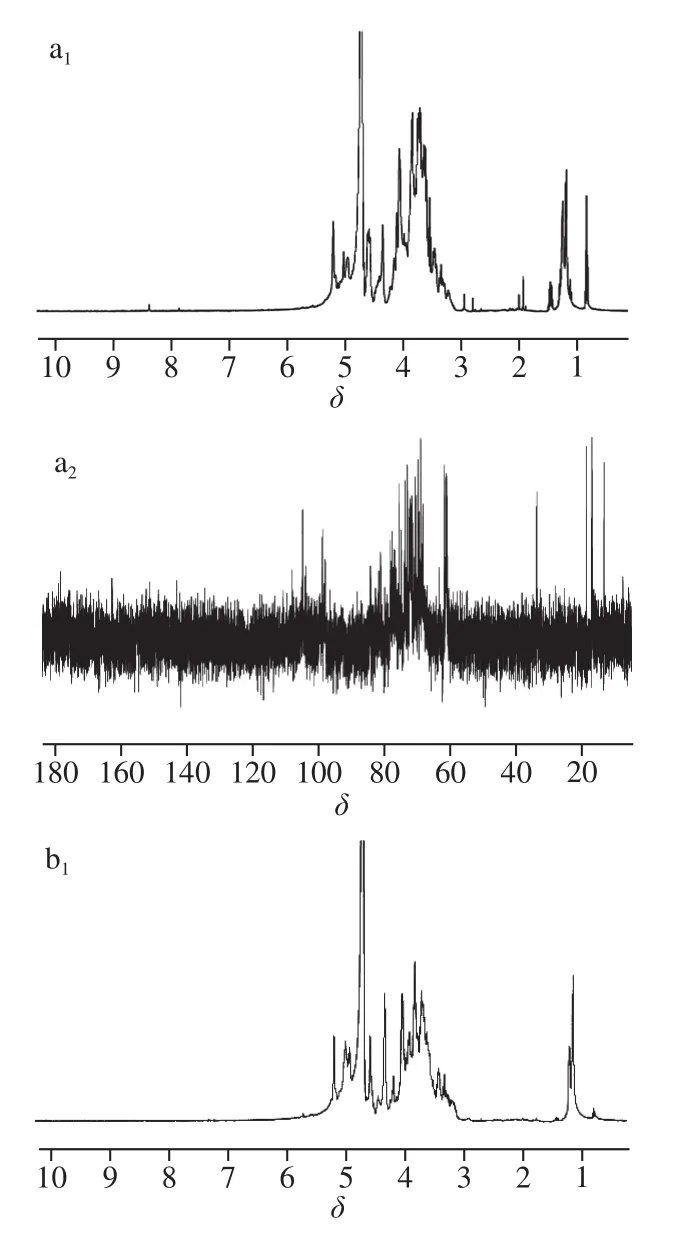

图7 PPs-1-1(a)和 PPs-2-1(b)的NMR图谱Fig. 7 NMR spectra of PPs-1-1 (a) and PPs-2-1 (b)
由图7的1H-NMR图谱可以看出,δ 5.60~4.90和δ 4.90~4.30分别归属于α-和β-构型的异头质子,而δ 4.50~3.00归属于环质子区[27],证实了骨架中存在α-糖苷键和β-糖苷键,这与红外光谱分析结果一致。由图7的13C-NMR图谱可以看出,在δ 176~170范围内的信号归属于羧基碳,说明PPs-2-1含有糖醛酸,δ 110~90归属于端基碳,δ 90~60归属于非端基碳[28]。
2.7 微观结构分析

图8 PPs-1-1(a)和PPs-2-1(b)的扫描电镜图Fig. 8 Photomicrographs of PPs-1-1 (a) and PPs-2-1 (b) as recorded by SEM
由图8可以看出,PPs-1-1呈三维层状结构,表面光滑且致密;PPs-2-1呈多层状结构,表面疏松多孔,有颗粒聚集。PPs-1-1和PPs-2-1是非晶态固体,结果与实际得到的固体一致。这种微观结构的差异可能与排斥力有关,可能导致分子聚集,另外还可能和多糖具有侧链有关[29]。
2.8 对RAW264.7巨噬细胞活力的影响
由图9可知,与空白相比,在质量浓度0.01~0.16 μg/mL范围内,PPs-1-1可增大RAW264.7巨噬细胞活力,且随着质量浓度的增加,细胞活力先增大后逐渐降低,均大于100%;与PPs-1-1相似,与空白相比,当质量浓度低于0.01 μg/mL时,PPs-2-1对RAW264.7巨噬细胞活力也具有激活作用,细胞活力大于100%。当PPs-1-1和PPs-2-1质量浓度分别大于0.16 μg/mL和0.01 μg/mL时,随着质量浓度的增大,细胞活力不断降低。可以得出,PPs-1-1和PPs-2-1在质量浓度分别低于0.16 μg/mL和0.01 μg/mL范围内,可增大RAW264.7巨噬细胞活力,表现出激活活性。

图9 PPs-1-1(a)和PPs-2-1(b)对RAW264.7巨噬细胞活力的影响Fig. 9 Effects of PPs-1-1 (a) and PPs-2-1 (b) on cell viability of RAW264.7 macrophages
3 结 论
利用热水提取乙醇沉淀、除蛋白等处理后,再经DEAE-52纤维素色谱柱0.05 mol/L NaCl溶液洗脱和Sephadex G-100柱色谱从PPs中分离纯化得到了2 种多糖(PPs-1-1和PPs-2-1),具有类似的理化性质,均是由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,但其物质的量比不同;平均摩尔质量分别为3.98×106、4.47×106g/mol;PPs-1-1具有表面光滑且致密的三维层流结构,具有α-和β-构型的呋喃糖苷,具有α-和β-糖苷键。PPs-2-1具有表面疏松多孔的层状结构,具有β-构型的吡喃糖苷。细胞活力实验表明,在PPs-1-1和PPs-2-1质量浓度分别低于0.16 μg/mL和0.01 μg/mL范围内,对RAW264.7巨噬细胞活力有激活作用。本研究可为PPs的进一步研究及开发利用提供理论依据。

