体素内不相干运动成像在乳腺癌新辅助化疗疗效评估中的应用初探
吕广洁,高佳音,徐筑津,华 彬,陈 敏,姜 蕾
(北京协和医学院研究生院 北京医院 国家老年医学中心,北京 100730)
新辅助化疗(Neoadjuvant chemotherapy,NAC)已成为部分Ⅱ期及Ⅲ期乳腺癌患者的标准治疗方案,评估化疗效果对于调整和制定个性化治疗方案至关重要。体素内不相干运动(Intravoxel incoherent motion,IVIM)成像是一种基于双指数模型的多b 值DWI,可定量评价组织扩散和微循环血流灌注两种效应,弥补了传统DWI 只能评价组织扩散特性的不足。许多研究[1-2]已经证实IVIM 成像的多个参数对于乳腺良恶性病变的鉴别及恶性肿瘤的分级和分型均有价值,但是将其用于乳腺癌NAC 疗效评价的研究较少,在NAC 第1 疗程后利用IVIM 成像预测NAC 全部疗程结束后疗效的研究更少,IVIM 成像评价及预测NAC 疗效的价值仍有争议。为此,笔者探讨了乳腺癌NAC 前中后IVIM 各参数的变化,评价IVIM 成像对于预测及评估NAC 疗效的价值。
1 资料与方法
1.1 临床资料
本研究为前瞻性研究,通过医院伦理委员会批准,所有患者检查前均签署知情同意书。搜集2015年8 月—2018 年6 月我院符合以下标准的患者:①经粗针病理活检证实的Ⅱ、Ⅲ期乳腺癌患者;②愿意并完成NAC 及手术治疗者,手术治疗前未进行放疗等其他局部治疗;③完成3 次MRI 检查,时间分别在NAC 前(病理活检1 周后)(简称T1)、NAC 第1疗程结束后(简称T2)及NAC 全部疗程结束后(简称T3)。排除标准:①有MRI 检查或对比剂应用禁忌证;②MRI 图像质量不佳;③未完成NAC、手术治疗或MRI 检查。
1.2 化疗方案及疗效评估
采用表阿霉素+环磷酰胺+多西他赛或紫杉醇联合化疗,化疗周期4 疗程,每疗程2 d,两疗程之间间隔约21 d。
由两名有经验的病理科医师根据手术后病理所见,并参照化疗前穿刺组织病理,进行化疗反应性组织学评价,参照Miller-Payne 标准[3]:1 级,整体细胞数量没有减少,单个细胞形态有或无改变;2 级,细胞数量略减少(≤30%),但整体细胞数量仍很高;3级,细胞数量减少>30%~90%;4 级,细胞数量明显减少(>90%),仅残留小簇或分散分布少量癌细胞;5级,未见恶性细胞,可见血管纤维弹性间质残留(常含巨噬细胞),但仍可残留原位导管癌(DCIS)。按照Miller-Payne 分级,将患者分为良好病理反应组(简称R 组,Miller-Payne 分级3~5)及轻微病理反应组(简称NR 组,Miller-Payne 分级1、2)。
1.3 MRI 检查
采用GE Discovery 750 3.0T 全身MR 扫描仪,体线圈作为发射线圈,相控阵8 通道乳腺专用线圈作为接受线圈。检查前训练患者呼吸配合,以减少呼吸运动及心脏搏动对图像质量的影响。主要扫描序列及参数:①快速自旋回波T2WI,水脂分离法压脂;②多b 值结合平面回波技术的自旋回波扩散加权成像(SE/EPI-DWI),扩散梯度场方向前后,TR/TE 7 800 ms/62 ms,矩形视野,矩阵200×96,层厚/间隔5 mm/1 mm,b=0、10、20、30、50、70、100、150、200、400、600、1 000及1 500 s/mm2,采集时间5~6 min;③双乳横轴位,3D 容积内插快速扰相梯度回波T1WI 平扫及增强:压脂(频率选择反转回复法),TR/TE 7.08 ms/3.56 ms,翻转角10°,层厚2 mm,视野32 cm×32 cm~34 cm×34 cm,矩阵384×256,单次采集时间约50 s,动态增强7 个时相,对比剂钆喷替酸葡甲胺,剂量0.1mmol/kg,高压注射器注射流率2.5 mL/s。
1.4 图像后处理及分析
采用GE Discovery 750 专用后处理软件。感兴趣区(ROI)放置于DWI 上病变最大层面高信号处(ADC 图低信号处),避开明显的出血坏死区,对于NAC 后病灶消失或DWI 高信号消失的病灶,ROI 仍放置于原病灶对应处。双指数模型数据分析,通过Levenberg-Marquardt 算法1 拟合计算f、D* 和D 三个参数,依据方程如下:Sb=S0(fexp(-bD*)+(1-f)exp(-bD)),其中Sb为扩散梯度参数为b 时的信号强度,S0为无扩散梯度时的信号强度,f 为灌注分数(与微循环灌注有关),D*为假性扩散系数(代表与灌注或不相干微循环有关的扩散),D 为纯扩散系数(反映真正的水分子扩散能力)。单指数模型数据分析,计算ADC 值,依据方程:Sb=S0exp(-bADC),其中ADC 为表观扩散系数。
1.5 统计学方法
采用SPSS 20.0 软件进行统计学分析。计量资料首先检验样本的正态分布性(S-W 检验),对符合正态分布的数据,采用均数±标准差()的方式进行表示,不符合正态分布的数据,则采用中位数和四分位数间距(M(QL,Qu))的方式进行表示。计算T2与T1时的ADC 差值,用△ADC 表示;同样计算△D、△f、△D*。采用两独立样本t 检验或Mann-Whitney U 检验,比较R 组与NR 组之间在3 个时间点上各参数及△ADC、△D*、△D、△f 是否有统计学差异;采用配对样本t 检验或Wilcoxon 秩和检验,分组比较T2与T1、T3与T1之间各参数是否有统计学差异。对组间差异有统计学意义的参数采用ROC分析评价参数的诊断效能,寻找疗效评估最佳参数的诊断界值并计算其敏感度、特异度。P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料统计
共搜集60 例患者(57 例单侧单发乳腺癌;1 例为双侧乳腺各一病灶;2 例患者为多发病灶,取最大病灶入组;共计入组61 个病灶)。患者均为女性,年龄(47±10)岁;病变位于左侧者32 个,右侧者29个;病变NAC 前MRI 上的最大径线为(3.7±1.7)cm;NAC 前病变在MRI 上的强化形态:肿块50 个,非肿块强化11 个;组织病理学:浸润性导管癌60 个(Ⅰ级19 个,Ⅱ级41 个,Ⅲ级0 个),浸润性小叶癌1个;腋窝淋巴结转移(病理阳性)19 例。按病理将病灶分组后,R 组21 个,NR 组40 个。
2.2 IVIM 成像各参数值的组间及组内比较
在T1、T2及T33个时间点上,R组和NR 组DWI 各参数值及组间比较见表1;△ADC、△D*、△D、△f 值见表2;图1 和2 分别是良好病理反应者和轻微病理反应者的DWI 参数图像。
组内比较,T2及T3分别与T1时间点的参数相比,R 组的f、D 及ADC 值均具有显著变化(T2时间点的f、D、ADC 值与T1的相比较,P 值分别为0.000、0.000、0.025;T3时间点的f、D 及ADC 值与T1的相比较,P 值分别为0.000、0.000、0.000),D* 值在两个时间点的变化均无统计学意义(P 值分别为0.903、0.986);NR 组仅T3与T1相比D 值有显著变化(P=0.010),T2、T3的ADC、D*、f 值与T1相比,T2与T1的D 值相比,差异均无统计学意义(P>0.05)。
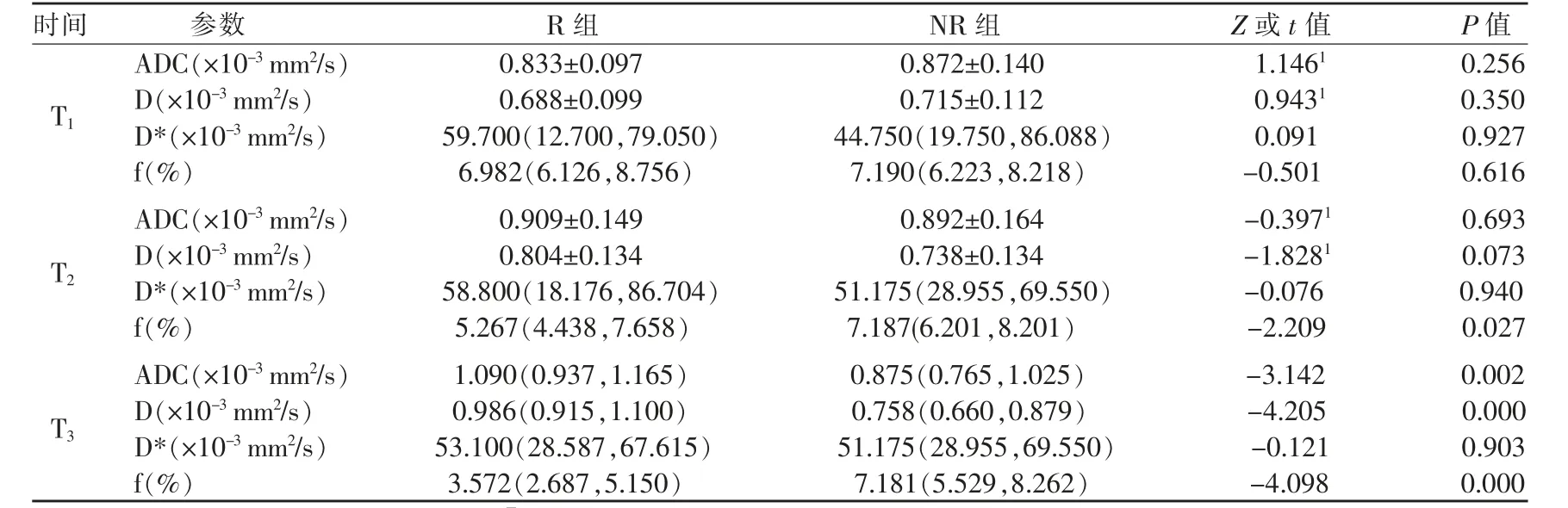
表1 T1、T2、T33 个时间点上DWI 各参数的组间比较

表2 △ADC、△D*、△D、△f 值的组间比较
2.3 f 值、△f、△D 预测乳腺癌NAC 疗效的ROC 分析
以手术病理的Miller-Payne 分级为金标准,在NAC 第1 疗程后用f 值预测疗效的ROC 曲线下面积为0.673,以f=6.118%为界值,其预测疗效的敏感度和特异度分别为61.9%、85%。△f 值的ROC 曲线下面积为0.788,以△f=-0.898%为界值,其敏感度和特异度分别为71.4%、87.5%。△D 值的ROC 曲线下面积为0.753,以△D=0.0995 为界值,其敏感度和特异度分别为52.4%、90%。f、△f、△D 的曲线下面积两两比较,差异不具有统计学意义,f 与△f、△f 与△D、△D与f比较的P值分别为0.274、0.706、0.438。
3 讨论
3.1 IVIM 成像各参数值对预测和评价乳腺癌NAC疗效的价值
3.1.1 ADC 及D 值
NAC 后由于细胞崩解坏死,细胞外间隙扩大,局部的细胞密度明显减低,水分子运动加强,进而使肿瘤的ADC 值、D 值升高。本研究结果显示,乳腺癌NAC 后早期,即NAC 第1 疗程完成后,无论R 组还是NR 组,病灶的ADC 及D 值均升高,但只有R 组的ADC 及D 值与NAC 前有显著差异,这与Archer等[4]通过病理研究发现的NAC 开始24 h 后,肿瘤细胞坏死,细胞增殖明显减低的趋势相一致,表明IVIM 技术为无创评估细胞凋亡和坏死提供了可能。
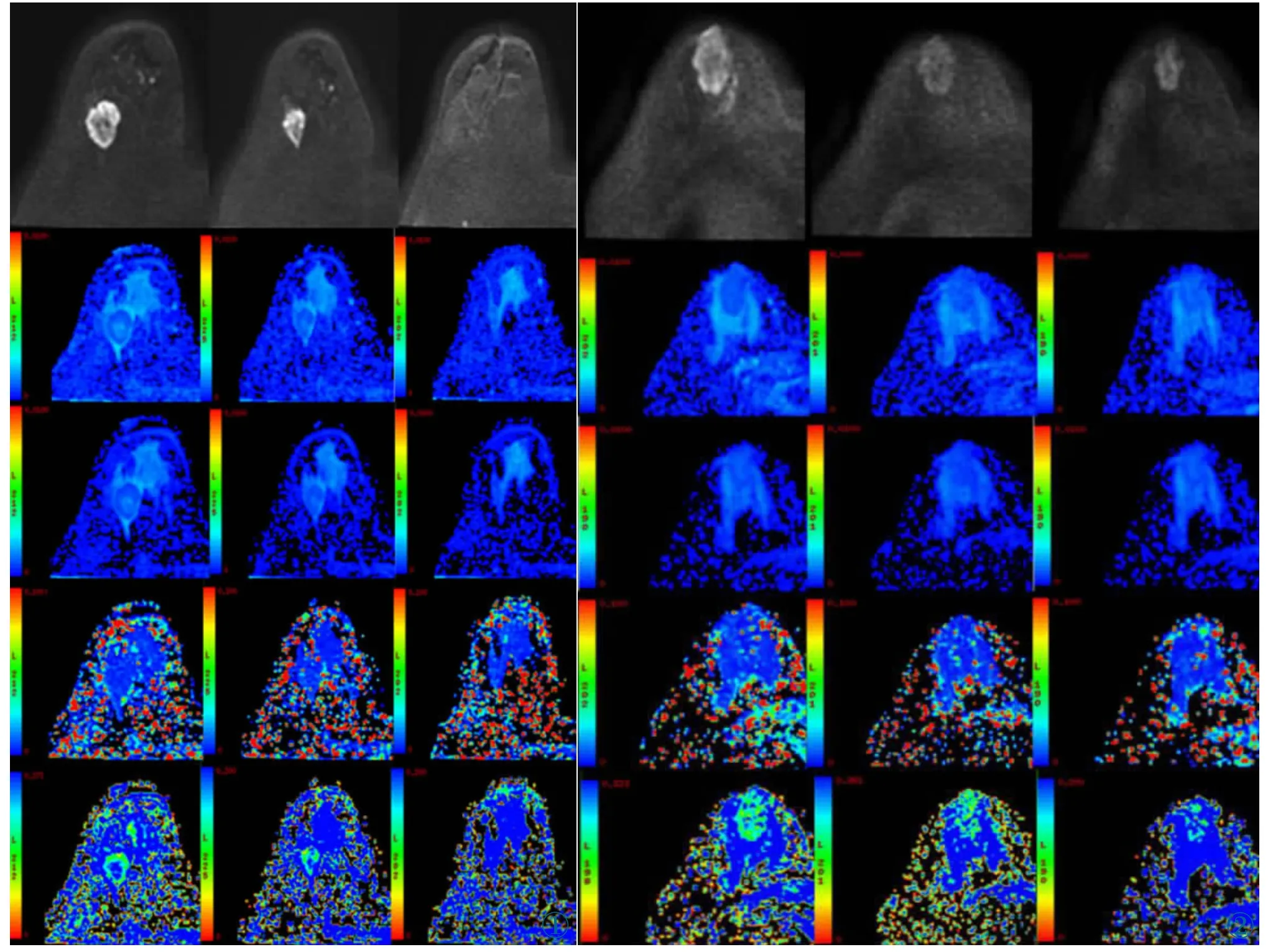
图1 浸润性导管癌患者的NAC 前、中、后IVIM 图像。患者为45 岁女性,经NAC 及手术治疗,手术病理示Miller-Payne 分级5 级。图中从上到下第1 至第5 行分别为DWI 图像(b=1 500 s/mm2)、ADC、D、D* 及f 伪彩图;图中从左至右纵列分别为NAC 前、NAC 第1 疗程后、NAC 结束后图像。图2 浸润性导管癌患者的NAC 前、中、后IVIM 图像。患者为47 岁女性,经NAC 及手术治疗,手术病理示Miller-Payne 分级2级。图中从上到下第1 至第5 行分别为DWI 图像(b=1 500 s/mm2)、ADC、D、D* 及f 伪彩图;图中从左至右纵列分别为NAC 前、NAC 第1 疗程后、NAC 结束后图像。Figure 1.IVIM images of a patient with invasive ductal carcinoma before,during,and after the NAC.The patient was a 45-year-old female who was treated with the NAC and surgery.Pathology from surgery showed Miller-Payne Grade 5.From the top to bottom row are diffusion-weighted images (b=1 500 s/mm2),ADC,D,D* and f colored maps,respectively.From the left to right column are the images of before,during and after the NAC.Figure 2.IVIM images of another patient with invasive ductal carcinoma before,during,and after the NAC.The patient was a 47-year-old female who was treated with the NAC and surgery.The histological grade was Miller-Payne 2.From the top to bottom row are diffusion-weighted images(b=1 500 s/mm2),ADC,D,D* and f colored maps,respectively.From the left to right column are the images of before,during and after the NAC.
然而,关于NAC 后何时ADC 及D 值能够预测化疗疗效尚无定论。部分研究[5-6]认为24 h 内ADC或D 值的变化尚不能预测NAC 的最终疗效,而Davis 等[5]研究发现NAC 48 h 后的ADC 或D 值与NAC 疗效有关系。Che 等[7]、Cho 等[8]研究均显示NAC第2 疗程后的ADC 值、D 值升高能够有效预测NAC 效果。本研究结果显示NAC 第1 疗程后两组间的ADC 及D 值的差异并无统计学意义,提示NAC 第1 疗程后ADC 及D 值的变化不能准确预测NAC 最终的疗效,而在4 个疗程结束后两组间的ADC 及D 值才出现明显的差异,这时二者才能对评价NAC 疗效有价值。鉴于既往研究显示最小ADC值能较好地反映肿瘤细胞密度较高区域,提供更多肿瘤预后的信息[9],为使测量值更加准确,本研究中勾画的是ADC 最低信号的区域,避开肿瘤内出血坏死区域,而这可能在一定程度上导致对NAC 疗效的低估。尽管本研究中△D 值预测NAC 疗效的诊断效能尚可,曲线下面积为0.753,但以△D=0.099 5×10-3mm2/s 为诊断界值,敏感性为90%,特异性只有52.4%,而Che 等[7]研究中利用NAC 第2疗程前后的△D 诊断效能较高,当其诊断阈值取0.261×10-3mm2/s 时,所得的诊断敏感性、特异性分别高达90.0%、89.7%。分析原因可能与本研究采集时间点早(NAC 第1 疗程后而不是第2 疗程后)及ROI 的勾画方法相关。
3.1.2 f 值
f 值代表体素内微循环灌注效应占总体扩散效应的容积率。乳腺恶性肿瘤的不成熟血管内皮细胞多、血管通透性高,因此肿瘤组织的f 值较正常组织高;化疗药物抑制乳腺癌细胞的增殖,减少肿瘤组织新生血管的生成[10],降低肿瘤的微血管密度[11],从而使病灶的f 值降低。Che 等[7]及朱蓉蓉等[12]均研究显示在NAC 第2 疗程后反应组的f 值明显降低。我们的研究结果与之相似,NAC 第1 疗程后R 组的f 值低于NR 组,差异具有统计学意义,进一步组内比较发现R 组NAC 第1 疗程后的f 值较NAC 前差异有统计学意义,而NR 组NAC 前后f 值没有显著差异。但是以NAC 第1 疗程后f 值预测NAC 疗效的诊断效能一般,曲线下面积为0.673,以f=6.118%为诊断界值,敏感性和特异性分别为61.9%、85%。以△f 值预测NAC 疗效的诊断效能虽然好于f 值,曲线下面积为0.788,但与f 值的曲线下面积相比没有统计学差异,以△f=-0.898 为诊断界值,敏感性和特异性分别为71.4%、87.5%。Che 等[7]的研究中利用△f 值预测疗效的诊断效能达0.927,朱蓉蓉等[12]的研究显示△f 值的诊断效能为0.7。
多种因素都会影响f 值的诊断效能,造成不同研究结果之间的差异。恶性病灶内的高度异质性、ROI 的勾画方法、图像采集的时间点等因素在一定程度上影响f 值的诊断效能。另外b 值的选择及回波时间均会影响f 值测量的准确性。Pang 等[13]研究发现当b 值<750 s/mm2时,f 值随b 值增加而增加,而当b 值≥750 s/mm2时,f 值会降至与良性肿瘤或正常组织相似,甚至更低,因此不能用来鉴别良恶性病变。回波时间越长,低b 值时组织信号衰减越明显,f 值就越大。NAC 后肿瘤微环境破坏导致灌注和扩散成分相混淆,继而导致双指数模型信号衰减产生偏差也会影响f 值。上述种种因素均有会导致f值诊断效能偏低,敏感性及特异性不甚理想。
3.1.3 D*值
D*值包括血流的速度信息,应理解为测量的微血管内的扩散系数,亦包含血液成分热运动的信息[14]。无论是乳腺癌[8]还是胃肠道肿瘤[15]D* 在NAC 前后均未出现显著变化,因此不能用于疗效的预测和评估,这与本研究结果一致。D*灌注测量要求较高,依赖于高信噪比,测量的精确度较难保障,由于肿瘤内部的不均质性及D*图本身噪声较大等原因[16],其测量的可重复性也较差。所以目前人们普遍认为D*比f 更难求值,应该在最优信噪比、最小运动和最小磁敏感伪影的条件下进行测量[14]。
3.2 本研究的意义
探索IVIM 成像在乳腺癌NAC 疗效评价中的价值有重要的临床意义,主要是因为常规乳腺扫描必须使用对比剂,而IVIM 成像除了能反映病变水分子扩散特性,还能在不使用对比剂的情况下就反映病变灌注情况,这对患者(尤其对使用对比剂有禁忌者)有重要意义。在NAC 疗效观察中,能在不使用对比剂的条件下就能观察到肿瘤的变化,患者检查的依从性及舒适性会明显提高。本研究中R 组的f 值在NAC 第1疗程后较NAC 前有显著变化,而且组间差异也有显著性,提示f 值是反映肿瘤灌注特性的有潜力的技术方法,值得进一步探索。另外,关于磁共振功能成像评价疗效时机的选择,目前国内外尚无统一的标准,仍处于探索中,IVIM 成像作为一种磁共振功能成像的新技术更是如此,本研究选择在NAC 第1 疗程后评价疗效正是要探索它是否能在更早期预测疗效。
3.3 本研究的局限性
本研究为前瞻性研究,要求患者完成全部NAC疗程及T1、T2、T3时间点的乳腺MRI 检查并取得最终病理结果,故病例搜集有一定的困难,入组病例数量有限,可能会对结果产生一定的影响,仍需进一步的大样本研究来验证结果;IVIM 作为一种新兴的功能成像技术,其b 值及回波时间的选择尚无统一标准,本研究中b 值选择的普遍适用性仍需进一步验证;ROI 的放置位置未能覆盖病灶全部,难以反映病灶的全部DWI 信息。
综上所述,IVIM 成像在评价NAC 疗效方面是有潜力的技术方法,f、D 尤其是f 对在NAC 第1 疗程后预测疗效及NAC 结束后评价疗效均有价值,ADC 对NAC 结束后评价疗效有价值,D* 值对评价疗效无价值。

