银耳多糖研究进展
高磊 张帆 王毅飞 叶景润 王致鹏 马岩 陈伟
摘要 银耳多糖成为新近研究热点领域之一,其具有独特的生物学活性,市场应用前景广阔。伴随着市场需求的日益增加,国内医疗健康、膳食添加、天然化妝品行业的兴起,其制备工艺及功能研究需要进一步深度发展,形成产业化体系。通过总结和比较近几年关于银耳多糖的相关研究,概括了银耳多糖的重要生物学功能、银耳的选材、不同种类的提取和纯化方法以及应用和产品开发的进展,重点指出对银耳选材研究的重要性,为银耳多糖深度研究提供一定的理论基础,逐步构建并完善产业化体系,促进其制备工艺和功能应用的开发。
关键词 银耳多糖;功能特性;选材;提取纯化;应用开发
中图分类号 Q539文献标识码 A文章编号 0517-6611(2020)24-0013-04
doi:10.3969/j.issn.0517-6611.2020.24.004
开放科学(资源服务)标识码(OSID):
Research Advances of Tremella fuciformis Polysaccharides
GAO Lei, ZHANG Fan, WANG Yifeiet al
(College of Marine Science and Engineering, Qingdao Agricultural University, Qingdao,Shandong 266237)
Abstract Tremella fuciformis polysaccharide has become one of the hot research fields recently. It has unique biological activity and has a broad market application prospect. With the increasing market demand and the rise of domestic medical and health care, dietary supplement and natural cosmetics industries, the research on its preparation process and function needs to be further developed to form an industrialization system. By summarizing and comparing the relevant research on Tremella fuciformis polysaccharides in recent years, the function of Tremella fuciformis polysaccharides, material selection, different kinds of extraction and purification methods, and their further application were summarized, the importance of the research on the material selection was pointed out,which provided certain theoretical basis for the indepth study of Tremella fuciformis polysaccharides, gradually constructed and improved the industrialization system, and promoted the development of its preparation process and functional application.
Key words Tremella fuciformis polysaccharides;Functional characteristics;Material selection;Extraction and purification;Application and development
银耳(Tremella fuciformis Berk.)又称白木耳、雪耳、银耳子,具有滋阴润肺、养胃生津的功效,对于治疗肺热咳嗽、胃炎、面部面斑、癌症肿瘤等病症均有作用,大部分的生物活性均与银耳多糖相关,是我国传统的真菌食药[1]。银耳多糖(Tremella fuciformis polysaccharides,TFPS)具有调节免疫、降血糖、降血脂、抗辐射、抗肿瘤、抗衰老、抗氧化等作用。目前,银耳多糖的提取纯化工艺日渐成熟,但未形成工业化,提取效率及产品纯度较低,存在一系列问题,产业化体系尚待完善。然而,银耳多糖存在广阔的研究空间,可以广泛应用于食品、医药、美容等各个领域,具有巨大的市场价值。不过目前相关功能研究不深,应用开发较少,市场产品不足,需要进一步开发其潜在价值。现对银耳多糖的相关研究进展进行了综述。
1 银耳多糖的功能
1.1 调节免疫作用
银耳多糖可以通过调节体液免疫、细胞免疫和免疫因子来影响机体免疫。在进行动物活体学试验和细胞试验等研究中,发现TFPS可以显著增加外周血中白细胞的数量[2],刺激脾淋巴细胞的增殖[3],逆转调控T细胞对 CD4+T 细胞增殖和极化的影响[4],抑制炎症发展[5]及治疗铜绿假单胞菌感染[6]。此外,Jiang等[2]研究银耳多糖分子质量对环磷酰胺致大鼠白细胞减少症恢复的影响,发现TFPS的分子量越小,活性越好。在临床研究中,发现TFPS可以诱导人单核细胞产生免疫因子,提高肿瘤患者外周血T淋巴细胞水平,明显改善肿瘤化疗患者骨髓毒性反应,保护骨髓,提高白细胞数量[7]。但目前临床研究相对较少。
1.2 降血糖、降血脂作用
侯建明等[8]研究发现银耳多糖能阻抑鼠类肠道对脂类的吸收并能降低血脂,可以通过吸附和束缚血液中脂类从而促進胆固醇排出,阻断其在肝肠循环,以达到降低血脂的效应。银耳多糖可以作用于特定的酶,调节糖代谢酶的活性及相关蛋白的水平,达到降血糖的目的。Bach等[9]利用腹腔注射 STZ 构建1型糖尿病大鼠模型,发现银耳胞外多糖(EPS)能增加 HDL 水平,降低 TC、TG、GPT和Urea水平。
1.3 抗辐射作用
银耳多糖对辐射损伤小鼠有保护作用,Xu等[10]研究放射线照射的小鼠用WTF-B处理,得出WTF-B有明显的放射保护作用,可作为放射防护剂。王晓琳等[11]将磷酸酯化的银耳多糖作用于模型小鼠,发现对辐射损伤小鼠的造血功能具有保护作用。韩英等[12]对银耳多糖处理的辐射损伤模型小鼠进行观察,发现其30 d的存活率明显提高,外周血液学参数保持较高水平,表明银耳多糖对辐射损伤小鼠具有保护作用。
1.4 抗肿瘤作用
银耳多糖作为干扰素诱导剂具有抗肿瘤作用,或者通过激活机体的吞噬细胞,使之增殖加速,吞噬能力增加。Chen[13]研究发现银耳多糖浓度的增加可使银耳多糖的抗肿瘤活性从73.4%提高至92.1%,对治疗自由基损伤和肿瘤疾病有一定的作用。韩英等[14]建立荷H22肝癌小鼠模型后观察发现银耳多糖肿瘤抑制率较高,抑瘤效果好,认为银耳多糖抗肿瘤作用是多靶点、多因素的作用。
1.5 抗衰老、抗氧化作用
银耳多糖具有抗衰老和抗氧化作用,可以有效保护皮肤,清除体内自由基。Shen等[15]研究TFPS通过上调SIRT1的表达促进下游信号通路来减轻过氧化氢对皮肤成纤维细胞的氧化应激反应和凋亡率,研究显示TFPS可能是一种潜在的治疗氧化应激相关皮肤病和衰老的药物。Chen[13]研究表明银耳多糖可以有效清除超氧阴离子和羟基自由基,起到抗氧化的作用,在一定范围内随着银耳多糖浓度的增加,其清除能力不断增强。Wang等[16]研究发现碱提银耳多糖(ATP)和羧甲基化的银耳多糖(CATP)均能提高O2·-和·OH的清除率,具有抗氧化活性,且CATP 的活性高于ATP。Yan等[17]对金银耳多糖进行了抗氧化研究,结果表明多糖对过氧化氢诱导的大鼠红细胞氧化损伤具有明显的保护作用,可作为一种膳食营养补充剂使用。
2 银耳多糖的制备
2.1 银耳的选材
银耳的选材工作是制备银耳多糖的首要任务,会对银耳多糖提取产生影响,在今后的制备工艺中要尤为重视。银耳发源于四川通江,分布地区广泛,主产于四川、贵州、湖北、陕西、福建、浙江等省,主要栽培方式分为袋料和段木2种栽培方式。研究表明不同产地的气候条件以及银耳培养技术等差异对于银耳多糖的积聚及活性也会产生影响。
近年来,许多学者对不同产地的银耳多糖含量和部分生物学活性进行了初步研究。陈肖珍等[18]应用水提法对8个不同地区的银耳进行多糖提取,发现不同产地银耳多糖含量均较高,但具有一定差异性,以福建古田最高、甘肃康县最低。张建军等[19]对福建、河南、四川通江3个地区的5个银耳样本进行了比较,发现不同产地的银耳多糖含量及抗氧化活性存在一定差异,四川通江的多糖得率较高。苟兴等[20]对12批通江段木培育银耳样品以及8批福建棉籽壳代料银耳进行多糖的单糖组成分析,通过分析得出不同来源和培育方式的银耳在甘露糖、葡萄糖、岩藻糖等单糖含量上存在着比较明显的差异。
2.2 银耳多糖的提取
由于银耳原料的存在形式以及提取破壁方式的不同,银耳多糖提取的方法有许多种。传统方法主要有水浴浸提法[21]、酸浸提取法[22]、碱浸提取法[23]、酶解提取法[24],新型方法主要有超声波提取法[25]、微波提取法[26]、超高压提取法[27]等,另外还有一些在前者基础上进行创新的联合辅助提取法和逆向提取法。
2.2.1 热水提取法。
热水提取法是最早研究和应用于银耳多糖提取的试验方法,是最传统的提取工艺,具备操作简单、易于提取、比较节约等优点,往往被选用作为基本提取工艺。但是,水的极性大能够将银耳多糖和非多糖组分一起浸提出来,从而加大后期多糖纯化分离的难度。另外,提取效率低且耗费时间长。Chen[13]研究得出提取温度为100 ℃,提取时间为4.5 h,溶剂与原料配比为1∶5时银耳多糖的提取率最高(3.08%),得率很低。周帅飞等[21]获得最佳工艺条件为40倍量水,90 ℃提取3 h,共提取2次,多糖提取率为16.81%。段超等[28]对试验进行优化,获得较佳工艺条件为料液比1∶60、提取时间5.57 h、提取温度97.18 ℃,多糖提取率为20.25%。陈丽娟[29]对银耳进行湿法打浆处理,增加了银耳多糖的产率,得出最佳优化条件为料液比1∶50、打浆时间7 min,加水温度80 ℃,在此最佳条件下银耳粗多糖的提取率可达40.57%。高丽萍等[30]应用亚临界水提取银耳多糖,得到最佳工艺条件为提取温度138 ℃、提取时间30 min、料液比1∶30(g∶mL),得率可达34.58%,较传统水提法有了很大的提升。
2.2.2 酸浸提取法。
酸法提取多糖时,要注意酸的用量,酸过多会在一定程度上破坏多糖的结构,导致多糖的降解,从而影响多糖的提取率。王艺涵等[22]应用酸提法,加入pH 20的柠檬酸溶液进行提取,得到酸提银耳粗多糖,其水分和多糖含量较高。目前在提取银耳多糖的试验中采取此种方法较少,在提取仙人掌、菜籽多糖等其他植物中被采取,提取效率较水提法更高。
2.2.3 碱浸提取法。
碱浸提取法是多糖的另一种常用方法之一,银耳多糖中的酸性多糖在中性条件下提取很少,在碱性条件可以使大部分酸性多糖被提取,从而大大提升多糖提取率。来吉祥等[31]对银耳多糖提取工艺进行了优化,较佳提取工艺为干银耳与去离子水质量比1∶100、pH=9.0、90 ℃下提取4 h,银耳多糖提取率最高。任清等[32]得到较佳提取工艺条件:料水质量比1∶50、pH=9.0、90 ℃提取6 h,最终的粗多糖得率为19.08%。鲍会梅[33]将银耳磨碎成粉按体积比1∶100 加入1 mol/L氢氧化钠溶液,80 ℃水浴中提取4 h,得到银耳多糖。王艺涵等[22]应用碱提法称取银耳粉30 g加入pH 9.0的NaOH溶液2 400 g,95 ℃下提取4 h,制备得到碱提银耳多糖。吴琼等[23]以食用菌银耳子实体水提残渣为试验原料,采用一定浓度的碱溶液继续提取难溶于水的酸性多糖,优选出银耳多糖的最佳提取条件为NaOH浓度0.76 mol/L、料液比1∶81.89、 提取时间3.56 h,最高得率为10.72%。
2.2.4 酶解提取法。
酶解提取法也是目前常用的提取方法,提取效果佳,提取效率高,提取质量好且活性不受影响。孙晨雨等[24]应用复合酶浸提法提取银耳多糖,得到最适提取条件用浸泡前呈粉碎状态的银耳,复合酶添加量1.5%,80倍的加水量,提取温度60 ℃,提取时间1 h,所获到银耳多糖含量最高。鲍会梅[33]优化了酶解法提取银耳多糖的提取条件,最佳条件为纤维素酶1.5%、纤维素酶0.5%、中性蛋白酶2.0%、温度50 ℃、pH 4.5、时间60 min,最高提取率为15.36%。
2.2.5 新型提取技术。
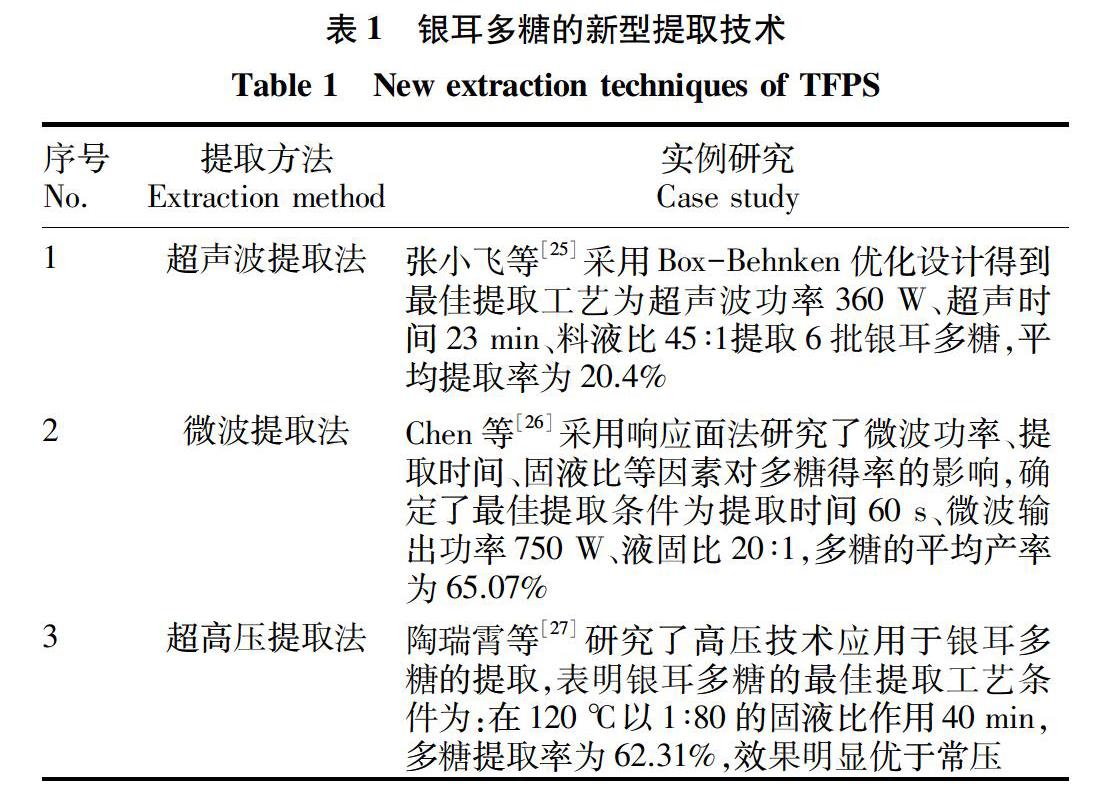
银耳新型提取技术主要有超声波提取法[25]、微波提取法[26]、超高压提取法[27](表1),主要利用物理机械作用,使银耳快速破壁且破壁效果比较彻底,提取银耳多糖的产率很高。通过表1分析可以得出,新型技术提取率都较高,提取时间较短,节省大量的试验时间,可以有效提高试验效率;另有纯度的保证,可作为以后多糖生物学活性研究的配套提取技术,有效提高试验的准确性。
2.2.6 联合提取法。
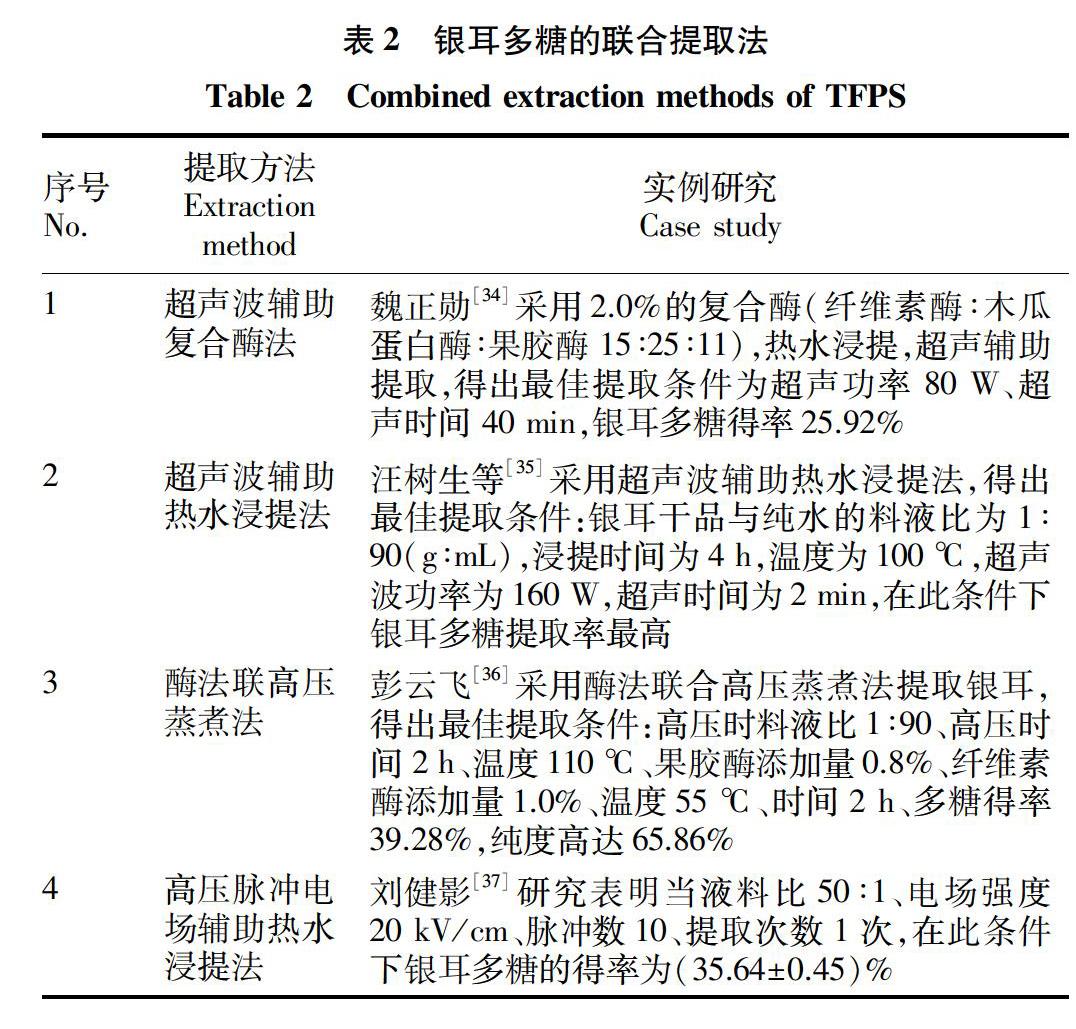
银耳多糖有多种提取方法,其原理都很类似,都是通过进行破壁处理后加以提取,每种提取方法都有其优缺点,有时可以采取几种方法联合(表2),获得更高的提取效率。通过多种提取方法的联合,可以明显提高银耳多糖提取率,可以利用多种方法的不同,探索最适的联合提取工艺,应用各种方法时注意平衡各个条件,让每种方法达到其最大效力。
2.2.7 逆向提取法。
逆向提取法借助酶或其他生物技术去除银耳脂肪、蛋白质等其他成分,从而获得银耳多糖,提取效率较高,可以作为银耳多糖提取工艺研究的重要方向。联合其他高效的多糖提取技术,可以较大程度地保证多糖提取率。刘春雷等[38]采用超临界CO2萃取脱脂技术从银耳中萃取油脂,然后对脱脂后的银耳粉采用浸提方法提取银耳多糖,得出油脂最佳萃取条件为萃取压力30 MPa,萃取温度40 ℃,萃取时间3 h,在此工艺下油脂萃取率为2.16%,脱脂后的银耳总多糖提取率为20.5%,比未脱脂的银耳多糖提取率高出了2.65%。侯建明等[39]利用酶法逆向提取工艺,采用胰蛋白酶、凝乳酶和胰脂酶,分解和清除非糖物质,最终银耳多糖得率為55%。
2.3 银耳多糖的分离纯化
银耳破壁后提取的产物大部分为多糖,但还有蛋白质、脂肪、色素、无机盐等以及一些小分子杂质,因此需要进一步纯化,提高纯度,进而研究其生物活性。目前常用的提纯分离方法为乙醇等低分子有机溶剂沉淀—脱蛋白—脱色—脱盐—多糖的各组分分离纯化。另外,罗惠波等[40]初探超滤生产银耳多糖工艺,脱除提取液中的杂质进一步浓缩,较传统生产的量和纯度都有大幅度提高。
2.3.1 低分子有机溶剂沉淀粗提。
多糖溶于水而不溶于有机试剂,可分离大部分多糖。通过多次粗提,可以得到纯度较高的多糖。不同醇沉终浓度以及醇沉时间会对银耳多糖含量产生影响,孙东[41]通过单因素试验得出最佳醇沉条件为醇沉终浓度75%、醇沉时间6 h。
2.3.2 脱蛋白处理。
目前多糖脱蛋白处理的方法有多种,包括三氯乙酸(TCA)法、盐酸(HCl)法[36]、Sevage法、HCl+Sevage法[42]、酶法、酶法联合Sevage法[39]、等电点除蛋白、酶法-等电点法除蛋白[29]等。彭云飞[36]通过TCA法、盐酸法、Sevage法和酶法联合Sevage法4种方法比较,得出Sevage法联合酶法脱蛋白在保证蛋白质大部分脱除的情况下,生物活性得到较好的保持且多糖损失率最低。吴振亚[42]分别使用Sevage法、Sevage改良法、HCl法和HCl+Sevage法进行脱蛋白处理,得出HCl+Sevage法除蛋白效率最高。陈丽娟[29]在对比等电点法、酶法、酶法-等电点法后,确定了木瓜蛋白酶法-等电点法为最合适的除去银耳粗提液蛋白的方法。
2.3.3 各组分分离纯化。
银耳多糖各组分进行分离纯化,以得到均一多糖,研究其生物活性。目前主要采用离子交换层析和凝胶过滤层析。离子交换层析常用的阴离子层析法填料的离子交换基团为二乙基氨基乙基(DEAE),基质主要有葡聚糖、纤维素和琼脂糖等,DEAE-Sepharose离子交换凝胶具有流速快、抗压能力强。凝胶过滤层析根据凝胶孔径和被分离化合物分子大小达到多糖按照分子量的大小进行分离,主要采用 Sephadex G-200 进行纯化。颜军等[43]采用DEAE-纤维素和SephadexG-200进行纯化得到均一酸性多糖TPP2。
3 银耳多糖的应用及产品开发
3.1 在医药保健方面
银耳多糖可以调节免疫系统与非免疫系统,可用于生产抗肿瘤、抗血栓、抗凝血、抗溃疡、抗突变等多种药物和一些保健品开发。市面上开发的银耳多糖药物类相关产品不多,有银耳孢糖胶囊、银耳孢糖肠溶胶囊、川贝银耳糖浆、复方银耳鱼肝油[44]等。
3.2 在食品加工方面
银耳多糖可以代替部分强化剂、抗凝剂、乳化剂、增稠剂等,利用增稠性和乳化性生产的银耳挂面、银耳饼干、酸奶及果冻等产品,根据复水性研制的方便银耳红枣羹、奶粉、豆奶、银耳燕麦片等产品[44]。银耳多糖等为原料研制保健软糖[45]、酿造营养型银耳黄酒[46]、制作银耳复合饮料[47]、开发新型卷烟[48]和银耳啤酒[49]等。
3.3 在美容护肤方面
银耳多糖的保湿效果与透明质酸相当,其可以替代透明质酸作为天然保湿剂[50]。银耳多糖具有较好的保湿能力和抗氧化能力,可添加于化妆品中用于美容保湿[32]。银耳多糖产品具有良好的酸碱稳定性、热稳定性,保湿功效优良且效果稳定,明显改善皮肤纹理度,增加皮肤弹性,可作为功效成分添加剂广泛应用于面膜、保湿乳等化妆品[31]。
3.4 在畜牧养殖方面
银耳多糖能够促进肠道内乳酸杆菌和双歧杆菌的增殖,可以促进鸡生长,改善鸡的肠道有益菌群,提高抗病毒能力和抗寄生虫的能力,能改善畜禽生产性能[51]。在仔猪中应用可以增强畜禽免疫力,添加到饲料中可以在一定程度上取代饲料添加的抗生素而不影响动物生产性能和食用安全性[52],因此,在畜牧生产中存在巨大应用潜力。
4 展望
近几年来,银耳多糖的相关研究成为热点研究领域之一,银耳多糖存在广阔的发展空间,需要进一步研究并开发其潜在生物资源价值。国内外对于银耳多糖功能性质的研究报道很多,但是对其具体功能机制方面的研究仍有待于深入开展。现今重在对其分子量、单糖组成、侧链位置、结合方式以及生理功能研究,而具体到银耳多糖的高级结构及其药理研究则较少。对于免疫调节、降糖和调脂、抗氧化和衰老、抗辐射、抗肿瘤等作用研究较为集中和深入,其他功能作用研究较为分散,以及功能作用机制之间的相互联系和影响等研究尚未明确阐述。另外,研究对象大多停留在动物或细胞层次上,临床研究较少。
综合近几年大家对于银耳的选材,发现对于银耳的选取不够重视,银耳的来源不明确,购买的渠道多样,有的购于超市或市场等,没有形成对于银耳选材概念的认识。实际上,银耳因其不同产地的气候条件以及銀耳培养技术等差异会对银耳多糖的积聚及活性也产生影响。因此,实验者在选取银耳多糖进行提取试验时要综合考虑来自不同产地的银耳,注意和重视选取银耳的品种,尽量避免在周边市场随意选取存放时间过长或者来源不明的银耳,消除由于银耳本身因素导致银耳多糖提取率差异较大的影响。关于银耳多糖的制备工艺,传统的提取方法提取效率低、产率低且耗费时间。面临银耳多糖的巨大市场需求,亟需探索工业规模化生产的提取和纯化方法。其中,生物酶催化破壁提取技术可以作为主要攻克方向进行重点研究。对纯度要求较高的药理学研究试验可以采取新型辅助提取方法和联合提取法,另外可以结合超滤工艺,优化提取纯化工艺,提高提取产率及纯度。
针对银耳多糖的应用及产品开发,未能将其药用价值很好地利用,医药产品领域开发有待深入。银耳多糖在畜牧生产研究等领域虽处于起步阶段,但存在巨大应用潜力。此外,在食品加工、美容护肤等领域已经展现出良好的市场价值和前景方面。
综上所述,未来要继续加强对银耳多糖功能及作用机理相关的研究,不断优化银耳多糖的提取纯化工艺,为银耳多糖在食品、化妆品、药品和保健品领域的产品开发提供理论指导,最终实现大规模、大范围的银耳多糖产品多样化和市场化。
参考文献
[1] 魏国志,李国光,金梅红.银耳多糖的研究进展[J].香料香精化妆品,2008(2):33-35.
[2] JIANG R Z,WANG Y,LUO H M,et al.Effect of the molecular mass of tremella polysaccharides on accelerated recovery from cyclophosphamideinduced leucopenia in rats[J].Molecules,2012,17(4):3609-3617.
[3] ZHAO X N,HU Y L,WANG D Y,et al.The comparison of immuneenhancing activity of sulfated polysaccharidses from Tremella and Condonpsis pilosula[J].Carbohydrate polymers,2013,98(1):438-443.
[4] SHI Z W,LIU Y,XU Y,et al.Tremella polysaccharides attenuated sepsis through inhibiting abnormal CD4+CD25 high regulatory T cells in mice[J].Cellular immunology,2014,288(1/2):60-65.
[5] RUAN Y,LI H,PU L M,et al.Tremella fuciformis polysaccharides attenuate oxidative stress and inflammation in macrophages through miR155[J].Analytical cellular pathology,2018,2018:1-10.
[6]SHI X L,WEI W F,WANG N.Tremella polysaccharides inhibit cellular apoptosis and autophagy induced by Pseudomonas aeruginosa lipopolysaccharide in A549 cells through sirtuin 1 activation[J].Oncology letters,2018,15(6):9609-9616.
[7] 庞良芳.银耳孢糖提高肝癌化疗患者生存质量的研究[J].湖北中医药大学学报,2014,16(4):85-86.
[8] 侯建明,陈刚,蓝进.银耳多糖对脂类代谢影响的实验报告[J].中国疗养医学,2008,17(4):234-236.
[9] BACH E E,COSTA S G,OLIVEIRA H A,et al.Use of polysaccharide extracted from Tremella fuciformis berk for control diabetes induced in rats[J].Emirates journal of food and agriculture,2015,27(7):585-591.
[10] XU W Q,SHEN X,YANG F J,et al.Protective effect of polysaccharides isolated from tremella fuciformis against radiationinduced damage in mice[J].Article in journal of radiation research,2012,53(3):353-360.
[11] 王晓琳,杨萍,孔令钰,等.磷酸酯化银耳多糖对辐射损伤小鼠造血功能的保护作用[J].中草药,2013,44(13):1811-1813.
[12] 韩英,沈秀,徐文清,等.银耳多糖辐射防护作用的研究[J].中国辐射卫生,2012,21(2):132-133.
[13] CHEN B.Optimization of extraction of Tremella fuciformis polysaccharides and its antioxidant and antitumour activities in vitro[J].Carbohydrate polymers,2010,81(2):420-424.
[14] 韩英,徐文清,楊福军,等.银耳多糖的抗肿瘤作用及其机制[J].医药导报,2011,30(7):849-852.
[15] SHEN T,DUAN C,CHEN B D,et al.Tremella fuciformis polysaccharide suppresses hydrogen peroxidetriggered injury of human skin fibroblasts via upregulation of SIRT1[J].Molecular medicine reports,2017,16(2):1340-1346.
[16] WANG X M,ZHANG Z S,ZHAO M X.Carboxymethylation of polysaccharides from Tremella fuciformis for antioxidant and moisturepreserving activities[J].International journal of biological macromolecules,2015,72:526-530.
[17] YAN Y L,YU C H,CHEN J,et al.Ultrasonicassisted extraction optimized by response surface methodology,chemical composition and antioxidant activity of polysaccharides from Tremella mesenterica[J].Carbohydrate polymers,2011,83(1):217-224.
[18] 陈肖珍,曾灶昌.不同产地银耳的多糖含量及体外透皮吸收性能研究[J].广州中医药大学学报,2018,35(6):1084-1088.
[19] 张建军,谢丽源,赵树海,等.不同产地银耳抗氧化活性物质及抗氧化能力分析[J].西南农业学报,2015,28(1):333-338.
[20] 苟兴,赵树海,李先天,等.不同来源银耳中银耳多糖差异分析[J].中国现代中药,2017,19(6):828-832,848.
[21] 周帅飞,毛淑敏,秦红岩,等.银耳多糖的提取工艺研究[J].安徽农业科学,2013,41(27):11148-11149.
[22] 王艺涵,吴琴,迟原龙,等.酸碱法和酶法辅助提取银耳粗多糖的特性研究[J].食品科技,2019,44(4):200-204.
[23] 吴琼,郑成,宁正祥,等.碱溶性银耳粗多糖的提取及其清除自由基作用的研究[J].食品科学,2007,28(6):153-155.
[24] 孙晨雨,王飞,张建玲,等.银耳多糖最适提取工艺条件探析[J].农产品加工,2018(8):27-29.
[25] 张小飞,果秋婷,孙静.Box-Benhnken响应面法优化超声波辅助提取银耳多糖工艺的研究[J].中国药师,2016,19(6):1055-1058.
[26] CHEN Y Z,ZHAO L,LIU B G,et al.Application of response surface methodology to optimize microwaveassisted extraction of polysaccharide from Tremella[J].Physics procedia,2012,24:429-433.
[27] 陶瑞霄,贾冬英,姚开,等.高压提取银耳多糖研究[J].食品科技,2015,40(6):229-233.
[28] 段超,王昌涛.银耳多糖提取工艺优化及对人体细胞毒性检测[J].日用化学工业,2016,46(2):101-105.
[29]陈丽娟.银耳多糖快速提取及可控降解的研究[D].广州:华南理工大学,2017.
[30] 高丽萍,郑光耀,闫林林,等.响应面法优化亚临界水提取银耳多糖工艺研究[J].江苏农业科学,2016,44(7):339-342.
[31] 来吉祥,何聪芬,赵进,等.银耳多糖工业化提取工艺优化及护肤功效研究[J].日用化学工业,2010,40(4):259-262.
[32] 任清,李守勉,李丽娜,等.银耳多糖的提取及其美容功效研究[J].日用化学工业,2008,38(2):103-105,109.
[33] 鲍会梅.酶解法提取银耳多糖的工艺及稳定性研究[J].食品研究与开发,2015,36(11):17-21.
[34] 魏正勋.银耳子实体多糖的提取分离、结构鉴定及生物活性研究[D].杭州:浙江工业大学,2015.
[35] 汪树生,苏玉春,孙雪菲,等.超声波辅助提取银耳多糖的工艺研究[J].黑龙江畜牧兽医,2017(6):154-157.
[36] 彭云飞.银耳多糖酶法提取及生物活性研究[D].福州:福建农林大学,2017.
[37] 刘健影.银耳多糖提取工艺优化及其在饮料中的应用[D].长春:吉林农业大学,2015.
[38] 刘春雷,李丹,彭彪.超临界CO2萃取脱脂技术在银耳多糖提取中的应用[J].宁德师范学院学报(自然科学版),2015,27(3):252-256.
[39] 侯建明,蓝进,郭树兴,等.酶法逆向提取银耳多糖的工艺研究[J].中国疗养医学,2009,18(4):292-293.
[40] 罗惠波,左勇.超滤生产银耳多糖工艺初探[J].四川食品与发酵,2003,39(1):34-37.
[41] 孙东.银耳多糖提取工艺优化及其性质的研究[D].天津:天津科技大学,2015.
[42] 吴振亚.银耳多糖的提取纯化、理化性质及抗氧化活性研究[D].雅安:四川农业大学,2015.
[43] 颜军,徐光域,郭晓强,等.银耳粗多糖的纯化及抗氧化活性研究[J].食品科学,2005,26(9):169-172.
[44] 陈岗.银耳多糖的功能特性及其应用[J].中国食品添加剂,2011(4):144-148.
[45] 杨熹珠,段贤源,洪栋,等.银耳多糖软糖的研制[J].价值工程,2017,36(11):135-137.
[46] 林勇毅.營养型银耳黄酒生产关键技术及产品开发研究[J].江西食品工业,2012(1):26-30.
[47] 原德树,周文凤,牛小明.银耳莲子汁饮料加工技术及配方研究[J].中国食品添加剂,2011(1):172-177.
[48] 伊勇涛,鹿洪亮,张峰,等.银耳浸提液在卷烟中的应用研究[J].食品工业,2013,34(8):118-119.
[49] 于娓娉.银耳多糖啤酒的研制[J].酿酒,2011,38(3):67-68.
[50] 刘卉,何蕾.银耳多糖与透明质酸的保湿性能比较[J].安徽农业科学,2012,40(26):13093-13094.
[51] GUO F C,KWAKKEL R P,WILLIAMS B A,et al.Effects of mushroom and herb polysaccharides on cellular and humoral immune responses of Eimeria tenellainfected chickens[J].Poultry science,2004,83(7):1124-1132.
[52] 杨永生,邓惠中,罗佳捷,等.银耳多糖的生理功效及其在畜牧生产中的应用[J].中国饲料,2011(21):9-11.

