非小细胞肺癌患者化疗后血浆循环肿瘤DNA水平与预后的相关性
龙 涛 郎 松
(中国人民解放军陆军军医大学附属新桥医院肿瘤科,重庆市 400037,电子邮箱:longtao198406@sina.com)
肺癌是全球癌症患者死亡的主要原因[1],每年造成约130万人死亡[2],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺部恶性肿瘤的80%以上,并且大多数患者在发病时已处于疾病晚期[3]。尽管手术及放化疗技术在不断进步,但NSCLC患者的5年生存率仍低于20%[4]。因此,如何对NSCLC的临床疗效及预后进行评估,是目前亟待解决的问题。循环肿瘤DNA(circulating tumor DNA,ctDNA)是一种基于血液的敏感生物标记物,在监测晚期癌症中具有较高的临床价值[5]。ctDNA水平可反映肿瘤负荷,有助于监测肿瘤对治疗的反应;此外,ctDNA突变也可以反映肿瘤对特定化疗药物的敏感性[6]。本研究分析NSCLC患者化疗后ctDNA水平与预后的相关性,现将结果报告如下。
1 资料及方法
1.1 临床资料 纳入2017年1月至2018年1月于我院进行化疗的77例NSCLC患者。纳入标准:原发性NSCLC患者,经病理学诊断明确。排除标准:(1)合并其他部位肿瘤;(2)合并心、脑、肾等脏器严重病变;(3)合并各种急、慢性感染;(4)严重精神疾病、神经系统疾病患者。根据肿瘤是否进展将患者分为进展组29例及无进展组48例。两组患者的年龄、性别等一般资料比较,差异均无统计学意义(均P>0.05),见表1。
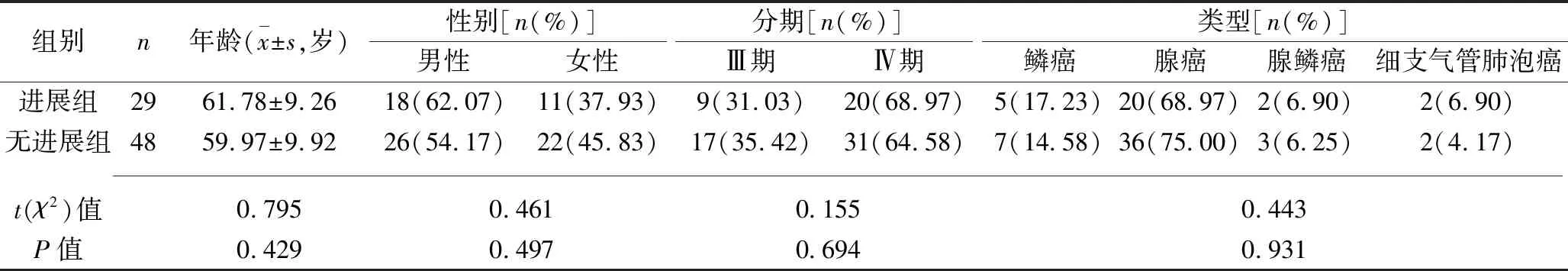
表1 两组患者一般资料比较
1.2 观察指标 所有患者均予NSCLC标准化疗方案,如顺铂或卡铂联合吉西他滨等一线化疗方案,于化疗方案结束后1周检测患者以下指标。
1.2.1 癌胚抗原、糖类抗原125、神经元特异烯醇化酶水平测定:所有患者均于清晨抽取空腹静脉血4 mL,混匀后以3 000 r/min离心10 min,分离血清,放置于-20℃冰箱内备用;采用电化学发光免疫分析法检测癌胚抗原、糖类抗原125、神经元特异烯醇化酶(neuron-specific enolase,NSE),仪器为i2000型全自动化学发光免疫分析仪(美国雅培公司),试剂为同厂配套产品(批号:S20160241),操作过程严格按照说明书进行。
1.2.2 ctDNA水平测定:(1)样本收集。所有患者均于清晨抽取空腹静脉血2 mL,于标本采集后2 h内进行离心(3 000 r/min,10 min),将上清血浆部分吸至洁净离心管,继续离心(3 000 r/min,10 min)完全去除血细胞成分后置于干燥洁净冻存管中,置于-80℃冰箱保存备用。(2)血浆ctDNA抽提及纯化。严格按照QIAamp DNA Blood Mini Kit(德国Qiagen公司)试剂盒的操作步骤进行血浆DNA的抽提,每2 mL血浆可获得300 μL的DNA。(3)ctDNA定量分析。采用pH 7.0~8.5的缓冲液将荧光染料SYBR Green Ⅰ(美国Molecular Probes公司)稀释成1 ∶3 000的浓度备用。取10 μL血浆DNA置于透明载板上,与1 ∶3 000荧光染料SYBR Green Ⅰ等比例稀释并充分混匀后置于紫外与可见光成像分析系统(美国赛默飞公司)中,在激发光波长为345 nm、吸收波长500 nm的条件下,摄影获取图像,经软件系统分析读取其发光强度。将不同样本DNA的发光强度代入根据标准含量DNA 的发光强度所做的回归方程(Y=133.17+39.458X),分别计算其相应的DNA 浓度。如果样本发光强度超过标准DNA发光强度范围,则将样本稀释后再进行定量,直到所测值在标准浓度范围内。每次对同一血浆样本检测3次,取其平均值。
1.3 随访 化疗结束后对所有患者进行随访。前6个月内每2个月进行1次门诊随访,之后每6个月进行1次门诊随访(主要复查肺CT)。随访截止日期为2019年1月。若患者病情出现复发、转移或死亡则记为疾病进展;记录患者的疾病进展情况。
1.4 统计学分析 采用SPSS 20.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;应用Cox回归模型分析患者疾病进展的独立危险因素;应用受试者工作特征(receiver operating characteristic,ROC)曲线评估不同指标预测患者疾病进展的效能,采用DeLong法比较曲线下面积(area under the curve,AUC)的差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组化疗后癌胚抗原、糖类抗原125、NSE及ctDNA水平比较 化疗后,进展组患者的癌胚抗原、糖类抗原125、NSE及ctDNA水平均高于未进展组(均P<0.05),见表2。

表2 两组化疗后血癌胚抗原、糖类抗原125、NSE及ctDNA水平比较(x±s)
2.2 NSCLC患者化疗后疾病进展的影响因素 以癌胚抗原、糖类抗原125、NSE及ctDNA水平为自变量(均为连续变量),以疾病进展为因变量(无进展=0,进展=1),进行多因素Cox回归。结果显示,癌胚抗原、糖类抗原125、NSE及ctDNA水平升高均是NSCLC患者化疗后疾病进展的独立危险因素(均P<0.05),见表3。
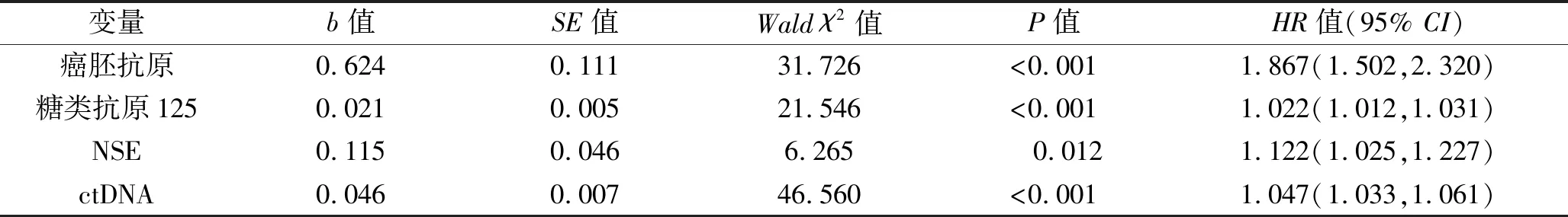
表3 NSCLC患者化疗后疾病进展的影响因素分析
2.3 不同指标预测NSCLC患者化疗后疾病进展的诊断效能 应用ctDNA预测NSCLC患者化疗后疾病进展的AUC高于癌胚抗原、糖类抗原125、NSE(z=3.198,P=0.001;z=3.657,P<0.001;z=4.978,P<0.001)。其中,ctDNA的最佳截点为29.50 μg/L,此时其预测NSCLC患者化疗后发生进展的敏感性为100.00%,特异性为97.92%,均高于其余指标。见图1及表5。
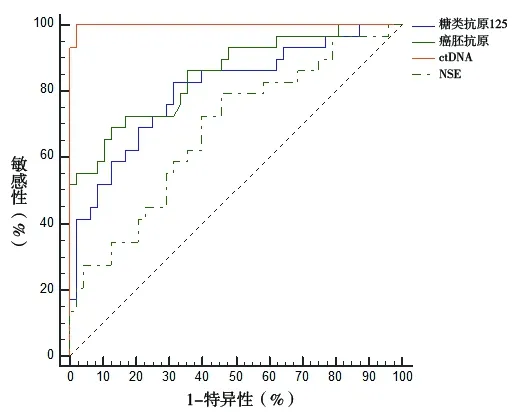
图1 不同指标预测NSCLC患者化疗后疾病进展的ROC曲线
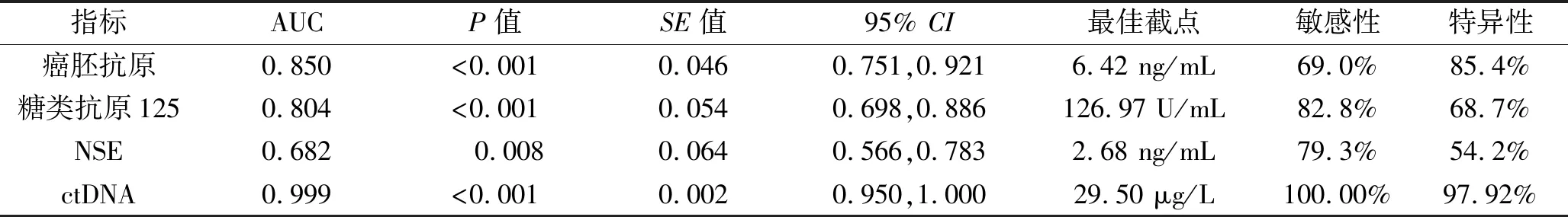
表5 不同指标预测NSCLC患者化疗后疾病进展的效能
3 讨 论
肺癌是导致世界上癌症相关死亡人数最多的恶性肿瘤,其中大多数肺癌为NSCLC(占85%)[7]。尽管肿瘤学科在不断发展,手术及放化疗等治疗技术在不断完善,NSCLC患者的预后仍不乐观,NSCLC患者的总体5年生存率仍然很低,约为16%[8]。目前NSCLC的治疗仍以手术、放化疗治疗为主,其中NSCLC术后5年生存率不足15%[9]。
目前,临床常用癌胚抗原、糖类抗原125、NSE等血液学指标对NSCLC患者治疗的临床疗效及预后进行预测。癌胚抗原是多种癌症中最常用的肿瘤标志物[10]。癌胚抗原相关细胞黏附分子5在各种恶性肿瘤中持续过度表达,与患者的不良临床结果和总体存活率降低相关,因此其成为一种突出的临床癌症生物标志物,广泛用于早期诊断[11]。但癌胚抗原相关细胞黏附分子5的敏感性和特异性不高,且临床适用性相对有限[12]。糖类抗原125是一种黏液性糖蛋白,与NSCLC疾病发生、发展相关[13]。Díez等[14]曾报告,术前血清糖类抗原125水平与可手术的NSCLC患者的TNM分期有关,可提供额外的预后信息,且血清糖类抗原125水平是监测肿瘤复发和术后播散的指标。NSE是一种糖分解烯醇酶,由神经元及神经内分泌细胞分泌,在NSCLC中具有较好的敏感性及特异性,目前被认为是NSCLC预后不良的标志,部分NSCLC患者NSE水平升高,而这可能与预后不良有关[15]。然而上述指标的诊断效能较低,故目前临床提出通过监测ctDNA对患者的预后进行评估。
ctDNA是肿瘤细胞释放到血液中的单链或双链DNA,携带有原始肿瘤的突变基因。已知的ctDNA的基因组谱与相应肿瘤的基因组谱匹配度高,并由于其检测具有可再现、非侵入性和易于获得等特征,在肺癌的管理中起着至关重要的作用[16]。近年来的研究表明,ctDNA筛查可显著改善目前的肿瘤诊断系统,甚至有助于肿瘤的早期诊断[17]。ctDNA水平的波动与多种因素相关,其中包括肿瘤类型、进展、治疗效果和转移扩散[18]。近期,Chen等[19]发现,ctDNA能够实时敏感地反映NSCLC患者的肿瘤基因突变信息及肿瘤负荷,可用于监测患者术后微小病灶的残留,并评估肿瘤复发的相关风险。本研究结果显示,化疗后进展组患者的癌胚抗原、糖类抗原125、NSE及ctDNA水平均高于未进展组(均P<0.05),且癌胚抗原、糖类抗原125、NSE及ctDNA水平升高均是化疗后NSCLC患者疾病进展的独立危险因素(均P<0.05)。这提示ctDNA与临床常用的血液肿瘤标志物均可用于化疗后NSCLC患者的预后评估。而进一步ROC曲线分析结果显示,应用ctDNA预测NSCLC患者疾病进展的AUC达0.999,敏感性为100.00%,特异性为97.92%,均高于癌胚抗原、糖类抗原125和NSE,表明ctDNA对化疗后NSCLC患者预后的预测效能较高,且优于传统的血液肿瘤标志物。
综上所述,ctDNA在评估化疗后NSCLC患者预后方面具有较高的效能,值得临床使用。但ctDNA检测价格相对较高,且检验程序复杂,难以做到临床推广。此外,本研究仅纳入我院化疗的NSCLC患者,且仅对单一指标进行相关性分析。因此,还应继续行大样本、多中心的临床试验,并应进一步比较多种指标联合检测与ctDNA单一检测在评估NSCLC化疗患者预后方面的效能及价值。

