肠道病毒71型感染手足口病发病机制的研究
王春荣
王春荣,济南市疾病预防控制中心病毒性疾病检验所 山东省济南市250021
核心提要:本文从肠道病毒71型(enterovirus 71,EV71)基因重组和突变、宿主基因及受体位点等方面探讨了EV71感染手足口病(hand-foot-mouth disease,HFMD)的影响因素,并通过EV71感染模型探究HFMD的发病机制,阐明EV71疫苗研究中存在的问题,为疾病的防控、临床治疗和疫苗研究提供参考.
0 引言
肠道病毒71型(enterovirus 71,EV71)是引起手足口病(hand-foot-mouth disease,HFMD)的主要病原体之一.EV71感染以5岁以下的婴幼儿为主,引起的HFMD多为自限性,但有些感染可引起严重的神经系统疾病,如无菌性脑膜炎、脑干脑炎和脊髓灰质炎样的麻痹性疾病,甚至死亡[1-3],已引起高度关注.目前尚无有效的EV71治疗方法.
EV71属小RNA病毒科肠道病毒属,基因组为单股正链RNA,长度约为7.4 kb.基因组两端为5’和3’非编码区(untranslated region,UTR),中间为连续的开放阅读框,编码含有约2194个氨基酸的多聚蛋白(图1)[4],依据VP1核苷酸序列的差异,可将EV71分为A、B、C 3个基因型[5].目前EV71感染HFMD的发病机制仍未明确,病毒基因结构与保证其生存、循环和逃避免疫等因素之间的关系尚不清楚.本文就EV71病毒和宿主相互作用机制的影响因素进行概述,通过EV71感染动物模型的研究探讨HFMD的发病机制,为HFMD的防控、开发治疗EV71的新型药物或有效疫苗提供参考.
1 EV71基因重组与突变
1962年,有学者在脊髓灰质炎病毒研究中报告了第一例RNA重组,此后许多研究[6,7]表明重组在肠道病毒进化中具有重要意义并经常发生.通过种内和种间50个非翻译区域的重组,肠道病毒的进化和演变也已被证实[8].以往研究显示,当从严重HFMD患者分离的EV71亚基因型C4毒株与从轻度患者分离的毒株进行比较时,大多数突变位于50-NTR和VP1区域,有的仅在VP1中观察到10个突变[9-12].然而,当将2株EV71亚基因型C4a与C4进行比较时,突变几乎跨越了整个基因组,从50-NTR到30-NTR[13,14].通过量化每一个突变基因所赋予的毒力程度来研究这些毒株的毒力,可以更好地了解它们究竟如何发挥作用,这将是非常有说服力的.
有趣的是,当对2000年新加坡严重HFMD暴发中分离出的致命EV71株进行分析时,发现它与非致命株仅在核苷酸5262处有所不同:致命株在基因组的5262位携带一个苏氨酸,而非致命株中该 位置为丙氨酸[15].为了鉴定这个位置的苏氨酸是否导致了该毒株的致死性,Yee等[16]通过核苷酸的定点诱变对致命株(C41)和非致命株(C10)的毒力进行了量化;与致命株相比,5262位(A5262G)的突变导致非致命株RNA拷贝数减少75%,斑块形成能力降低90%.
为了进一步评估EV71亚基因型B4株基因组的特异性突变对毒力的影响,Yee等[16]在其基因组多位点(158、475、486和487)诱导突变并缺失50-NTR区域475-486核苷酸部位的11个碱基对,结果显示突变体475(C475T)和缺失体PD(50-NTR中475到486)表现出明显的低细胞病变效应和极低的RNA拷贝数;然而,对RNA拷贝数的分析表明,突变体A486G在RD细胞中仍能产生高水平的RNA,而突变体G487A在RD细胞中的拷贝数降低.这些数据为EV71亚基因型B4株毒力的影响因素提供了佐证.
以往研究表明,国内分离的致命和非致命毒株之间存在氨基酸差异[10,14,17,18].这是否意味着某些毒力较高的毒株能够引起大规模的疫情爆发?然而,EV71病毒每次复制时出现错误的可能性很大,这也提出了另一个问题,即单个基因突变是否真是致死的根本原因,或者更确切地说,携带多个氨基酸替换的突变群体是否增加了病毒种群的适应性,从而赋予其更高的致病性?在正常情况下,病毒基因组复制并产生数百种子代病毒,这些子代病毒可能因一个位置的氨基酸替代而有所不同,在接下来的几轮复制中,可能产生更复杂的突变体而与原始序列有显著差异,这些突变体的集合还可能形成一个准物种[18].关于重组和/或自发突变导致的EV71致命毒株是否是HFMD暴发的唯一理由,或是否可能存在具有不同毒力的不同准种之间的合作,这些问题都有待证实.
在以小鼠为感染模型的研究中,发现EV71 VP1的145位氨基酸或VP2的149位氨基酸的点突变是新生小鼠能否成功感染EV71适应株的决定性因素[20].除编码序列外,非编码区域序列如内部核糖体进入位点(internal ribosome entry site,IRES)的突变也影响EV71对小鼠的感染毒性[9].而感染组织倾向性也可能与病毒序列变异有关,从呼吸道、胃肠道、中枢神经系统和血液标本中分离的EV71序列的比较显示,不同来源的EV71核苷酸存在差异.进一步的研究表明,EV71 VP1的97位氨基酸与病毒的嗜神经组织特性有关[21].近期研究显示,EV71 VP1突变体L97R被认为更具毒性,可能是因为它能更好地与硫酸肝素结合[22],而硫酸肝素是许多病毒(包括EV71)的常见附着受体[23].与此相反的是,VP1突变体145G与硫酸肝素的结合比突变体145E更好,其神经毒力却被认为比后者小[24],可能是因为硫酸肝素优先吸附在大量非靶细胞上,导致突变体VP1-145G的捕获衰减.但EV71 VP1的硫酸肝素结合特性与病毒毒力是否呈正相关或负相关,目前并没有确切结论.
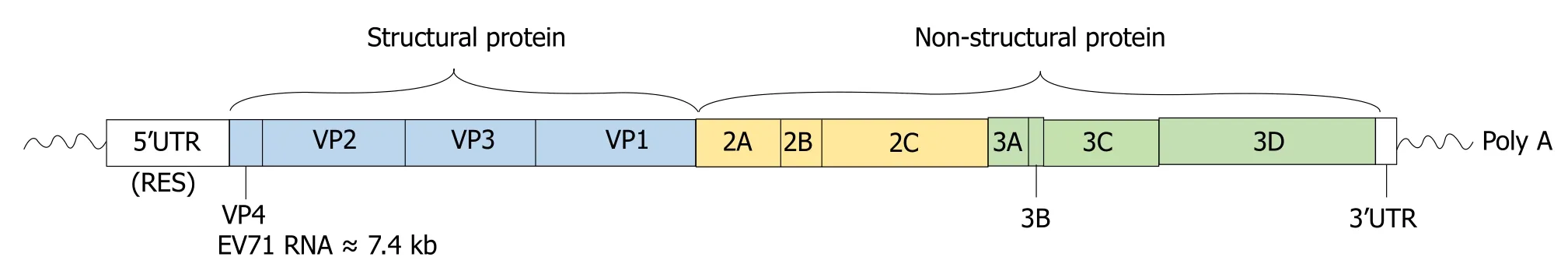
图1 肠道病毒71型基因组结构[4].
2 宿主基因
同种同亚型的EV71病毒在不同的宿主会产生不同的临床症状,地区分布不同临床表现也不同[25],这除了与病毒的毒力差别有关外,还可能决定于不同的宿主对病毒的反应不同.人类白细胞抗原(human leukocyte antigen,HLA)基因是一种免疫相关基因,在亚洲人中多见,表型频率分布可达17%-35%,而在白人中少见(表型频率分布仅0%-1%).据此,中国台湾学者通过病例对照研究,发现HLA-A33基因与病毒的易感性相关,并发现HLA-A2基因与肺水肿的发生相关[26].根据该基因在不同人群分布的差异或许可以解释在过去为什么EV71多在中国台湾、马来西亚以及中国内地、日本等亚太地区爆发.细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte antigen 4,CTLA-4)是T细胞毒性和耐受性的重要调节因子,其多态性与EV71感染儿童脑炎有关[27].其他遗传多态性,如肿瘤坏死因子和干扰素受体1[28,29],在EV71患者中也被发现与疾病严重程度相关.
EV71所致HFMD,不同个体的临床表型复杂多样,这除了与病毒因素有关外,更重要的是由病毒和宿主的相互作用决定的,尤其是不同个体对病毒发生的免疫反应不同.EV71感染首先通过与宿主细胞表面的特异性受体结合而吸附于宿主细胞表面,然后进入宿主细胞并将病毒核酸释放入细胞进行繁殖扩增,属于细胞内感染.与体液免疫功能比较,细胞免疫与非体液免疫功能对EV71感染患儿的影响更大[30,31].在免疫应答过程中,众多细胞因子在机体内通过旁分泌、自分泌或内分泌等方式发挥作用,具有多效性、重叠性、拮抗性、协同性等多种生理特性,形成了十分复杂的细胞因子调节网络[3],而宿主的遗传因素通过控制某些细胞因子的产量或反应性调控免疫状态.
3 宿主受体位点
宿主细胞表面的受体在病毒感染和侵入机体的过程中发挥关键性作用,决定了病毒的宿主和组织嗜性.目前报道的较为明确的EV71受体包括溶酶体整合膜蛋白2(lysosomal integral membrane protein 2,SCARB2)和P选择素糖蛋白配体1(P-selectin glycoprotein ligand 1,PSGLl).SCARB2是一种双链跨膜蛋白,主要分布于溶酶体及基质,参与细胞膜运输、内含体和溶酶体的重组等过程.EV71可通过VPl区结合游离的SCARB2受体而进入细胞内,这个过程能被SCARB2的抗体所抑制[32].此外,SCARB2受体蛋白的表达能使那些对EV71不易感的细胞变得有利于病毒的繁殖[33].Chen等[34]研究证实,EV71通过其五聚体周围的“口袋”区与SCARB2结合使病毒颗粒构象改变,导致病毒释放基因组RNA完成感染过程.PSGLl主要存在于白细胞表面,在炎症早期与EV71结合引起炎性因子的释放[35].也有研究发现,Toll样受体作为重要的病原模式识别受体能够识别EV71,与宿主抵抗病毒感染和炎性反应等有直接关系,可能参与介导EV71感染所致混合性拮抗反应综合征[36],另有研究报告了几种EV71的替代受体[23,37,38].
4 EV71感染模型
4.1 体外系统 最常见的EV71感染细胞系是横纹肌肉瘤起源的人恶性胚胎横纹肌瘤细胞(rhabdomyosarcoma,RD)细胞系[39].这种RD细胞株能产生大量的病毒颗粒,因此常被用于动物实验[40]和病毒结构研究[41]中EV71的扩增.除RD细胞外,用于脊髓灰质炎病毒感染的各种细胞株,如HELA和HEK293,也易受EV71感染和转染[42,43].这些细胞系常被用作病毒蛋白功能研究的平台.一些神经细胞系,包括sk-n-sh、nsc-34和sf268,已被用于研究宿主对EV71的反应[44]、系统发育分析[45]和抗病毒药物鉴定[46].
除RD细胞外,许多细胞系被用于EV71分子病毒学、病毒-宿主相互作用或药物筛选的研究,如THP-1和人PBMC被用于研究EV71感染的先天性免疫[43].到目前为止,RD细胞系似乎是文献中最常用的金标准,部分原因可能是它具有不同EV71基因型的高产率[47].随着越来越多的实验室使用相同的RD细胞系,未来更容易交叉比较来自不同实验室的结果.由于这些细胞系模型在某种程度上与人类自然感染相似,因此还需要另一种方法来验证通过细胞培养系统获得的发现,在这方面,动物模型可以为研究者对EV71体内感染和发病机制的理解提供更加完整和有说服力的证据.
4.2 体内系统 从细胞培养系统中获得的实验结果需要在动物模型和人类临床试验中进行验证.目前有四种小鼠感染模型[48],这些模型正被积极地用于抗病毒研究.在这些模型中,有一个共同点就是经常使用肢体瘫痪和死亡率来评估疾病的严重程度.
4.2.1 依赖于EV71适应性毒株的小鼠模型:成人通常对EV71感染拥有抵抗力,同样成年小鼠也不容易感染EV71临床分离株.为了解决这个问题,研究人员在ICR小鼠模型中开发出适合小鼠感染的EV71毒株MP4[49-51].将亲本EV71注射到一天龄ICR小鼠体内,从脑组织中分离的适应性EV71毒株被再次用于连续的注射适应循环,第四轮循环得到的EV71被指定为MP4[50].与其亲本EV71株相比,MP4的细胞毒性更强,产生的斑块更大.由于EV71是一种具有准物种性质的RNA病毒,小鼠适应性毒株往往会积累一些突变,而这些适应性突变在人类自然感染过程中不容易被发现.除了MP4,免疫缺陷的nod/scid小鼠模型中也产生了适应性EV71毒株[52].对临床分离株与小鼠适应株的氨基酸序列进行比较,发现两者在VP1、VP3和蛋白酶2A等结构蛋白存在显著差异[52].因此,目前还不能确定用EV71适应株感染小鼠得到的研究结果是否可以扩展到人类对自然毒株感染情况.
4.2.2 免疫缺陷小鼠模型:宿主的免疫系统对病毒感染起着至关重要的作用[53].免疫缺陷小鼠,即使没有携带任何人类病毒感染受体,也可以支持EV71临床分离株的感染,而不是依赖于小鼠适应株.
有研究显示宿主体内的干扰素是防止EV71感染和发病的必要条件[54].AG129小鼠,由于缺乏干扰素或干扰素受体,当通过静脉注射或口服途径感染非小鼠适应性EV71时,会出现肢体瘫痪和死亡,在肠道和口腔感染的中枢神经系统中都能检测到病毒蛋白[55].与小鼠AG129相似,小鼠A129(缺乏干扰素受体)也可感染小鼠非适应株EV71[56].此外,stat-1是干扰素信号传导过程中的关键转录因子,stat-1基因敲除小鼠G129(缺乏干扰素受体)通过粪-口途径可成功感染B型和C型EV71临床分离株,感染的小鼠后肢瘫痪,中枢神经系统中含有丰富的病毒蛋白[40],支持干扰素信号在保护中枢神经系统免受EV71感染机制中的重要作用.
除先天免疫外,体液免疫在EV71感染和发病中也起着重要作用.缺乏T和B淋巴细胞的nod/scid小鼠可以感染小鼠适应性EV71[52].然而,既然小鼠适应EV71也可以感染具有免疫活性的小鼠[50],nod/scid小鼠模型中缺失的T淋巴细胞和B淋巴细胞是否真正对免受小鼠适应EV71感染的保护中起作用?进一步研究显示,nod/scid小鼠接种EV71临床分离株发生了肢体麻痹,上述问题得到解决.尽管肢体瘫痪已被用作小鼠模型中评估EV71发病机制的常见标志,但在人类自然感染中,急性弛缓性麻痹的发生频率不如HFMD.有趣的是,在nod/scid模型中,首次在感染了临床分离株的小鼠模型中观察到一种类似HFMD的皮疹表型.此外,炎症性因子IL-23/IL-17轴似乎在感染的nod/scid小鼠模型中被激活.这些有趣的现象是否在nod/scid模型具有特异性,或者可以推广到其他小鼠模型或人类患者,还有待观察.
此外,干扰素-γ诱导蛋白-10(interferon-gammainducible protein-10,IP-10)是EV71患者高表达的趋化因子[57].与野生型对照小鼠相比,IP-10敲除小鼠感染小鼠适应性EV71后的死亡率更高,表明IP-10在EV71感染和发病机制中的保护作用[58].
4.2.3 转基因小鼠模型:近年来,许多EV71感染过程中的细胞受体[33,35,37,59]被提出,这些受体促进了非敏感细胞系如小鼠成纤维细胞L929对EV71的感染.然而,表达人PSGL-1的转基因小鼠不能支持EV71临床分离株的感染[60].在这些报道的细胞受体中,迄今为止只有人scarb2(hscarb2)被证明支持体内EV71感染.
以往报道有两种不同的hscarb2-tg小鼠模型.在ef-1a-hscarb2模型[61]中,ef-1a启动子被用来驱动C57b/6小鼠背景中hscarb2的表达;在sc2-hscarb2模型[62]中,一个天然的hscarb2启动子在人scarb2-bac克隆中驱动c57b/6小鼠背景中的转基因表达.这两种模型都能感染EV71,发展成肢体瘫痪,并在肌肉和神经组织中检测到病毒蛋白.然而,上述hscarb2Tg小鼠模型还不能有效支持口腔感染[61,62],而这对于儿童是一个重要的传播途径.
4.2.4 杂交小鼠模型:如上所述,hscarb2受体和免疫缺陷都有助于EV71感染和发病.因此,将转基因hscarb2和宿主免疫缺陷结合可能会进一步提高感染效率.事实上,通过杂交培育hscarb2-tg和stat-1ko小鼠产生了一个新的杂交小鼠模型.与其亲本小鼠相比,该杂交小鼠模型更易于应用.例如,杂交小鼠在2 wk大的时候,仍然可以感染不同基因型的EV71,需要的滴度(pfu)比亲本小鼠低1000倍[63].EV71感染的杂交小鼠在中枢神经系统(如中脑和脊髓)中表现出高密度的病毒蛋白.与stat-1ko模型一样,尽管EV71感染的杂交小鼠出现肢体瘫痪,但在肌肉组织中没有检测到病毒RNA和蛋白.这表明,瘫痪完全源于中枢神经系统损伤,而不是肌肉破坏.这种新的混合(hscarb2-tg/stat-1-ko)模型可以作为一个评估药物或疫苗疗效的平台[63].
尽管这种杂交小鼠模型对研究EV71相关的神经病变和抗病毒治疗是一个更为敏感的系统,但由于缺乏干扰素信号,不能成为研究免疫调节剂治疗的良好模型.
5 EV71疫苗
EV71一般通过密切的人与人接触传播,因此,疫苗接种可能是控制EV71感染的最佳方法.目前研究的EV71疫苗有多种类型,包括灭活病毒疫苗[64-66]、病毒样颗粒疫苗[67]、DNA疫苗[68]、亚单位疫苗[69]和减毒活疫苗[70].
灭活病毒EV71疫苗的开发进展迅速,是目前EV71疫苗中最先进的候选疫苗[65,66,71-73],健康儿童接种灭活EV71疫苗5年后的免疫持续性仍然较高[74].2015年12月,中国食品药品监督管理局批准了两种预防HFMD的灭活EV71疫苗[75].由于灭活的EV71疫苗不能复制,因此出于安全考虑,它们比减毒活疫苗更受欢迎.然而,灭活疫苗的生产成本和潜在的供应问题使其在实际应用中受到了限制[76].
病毒样颗粒(VLPS)疫苗与灭活EV71疫苗不同,VLPS疫苗的优点是能够同时以其天然构象呈现EV71衣壳蛋白的所有表面表位[75,77].尽管VLPS疫苗的效力低于灭活疫苗,但实验动物模型研究表明,VLP能产生保护性中和抗体,并对疫苗中不存在的多种亚型产生交叉反应[77].与VLP相关的问题是其稳定性、净化和生产成本.其他类型的EV71疫苗(DNA疫苗、亚单位疫苗和减毒活疫苗)尚处于早期发展阶段,目前正在对小鼠和非人类灵长类动物进行临床前试验[75].
6 结论
EV71感染在亚太地区引起了大规模的HFMD暴发,已引起社会各界的高度关注.但是,目前尚无有效的EV71治疗药物,EV71感染发病机制的研究也没有确切结论,还有很多问题需要解决.EV71疫苗是保护儿童免受感染的有效方法,然而,目前没有一种EV71疫苗能提供有效的保护作用来防止其他肠道病毒的感染,开发能覆盖多种肠道病毒的疫苗仍是一种前瞻性的选择.
在今后的研究中,(1)应建立一个全球性EV71感染监测网络,持续的监测有助于识别和发现新的EV71变种;(2)迫切需要有效的抗病毒药物来对抗亚洲和世界各地频繁发生的EV71感染;(3)应深入研究EV71感染模型中病毒种群的行为及其与发病机制的关系,因为目前还不清楚致命感染是由单一毒株导致,还是由人群中携带不同突变的病原体的合作引起,对这个问题的解答可以为设计一种有效的EV71疫苗铺平道路;最后,应进一步寻找新的特异性EV71受体,特别是加强嗜神经性受体的研究,可为特效的靶向药物的研究提供科学依据.

