磷营养对水稻籽粒锌生物有效性的影响及其与植酸等磷酸肌醇谱含量的关系
苏 达 吴良泉 Søren K. Rasmussen 周庐建 潘 刚 程方民,*
磷营养对水稻籽粒锌生物有效性的影响及其与植酸等磷酸肌醇谱含量的关系
苏 达1,2吴良泉2Søren K. Rasmussen3周庐建4潘 刚4程方民4,*
1福建农林大学农学院 / 作物遗传育种与综合利用教育部重点实验室, 福建福州 350002;2福建农林大学国际镁营养研究所, 福建福州 350002;3哥本哈根大学植物与环境科学系, 丹麦哥本哈根;4浙江大学农业与生物技术学院, 浙江杭州 310058
作物籽粒锌缺乏所导致的“隐性饥饿”已威胁到全世界1/3人群的健康。为明确磷对水稻籽粒锌的生物有效性的影响, 利用大田磷肥长期定位试验, 并结合稻穗离体培养技术, 探讨了不同外源磷浓度下水稻籽粒锌的生物有效性的变化及其与籽粒植酸等磷酸肌醇谱含量的关系。试验表明高磷处理显著增加水稻籽粒中植酸磷和总磷的含量, 以及不同价位磷酸肌醇(InsP1-6)含量, 其中以高价磷酸肌醇(InsP4-6)在磷供给下的增幅最为显著。与籽粒植酸的变化趋势相反, 高磷水平降低了稻米中锌的含量及其有效性。稻穗离体培养中, 高磷(P12)处理相比无磷(P0)对照, 籽粒锌的有效性降幅高达81.3%。因此, 过量磷肥投入会通过显著提高水稻籽粒中的植酸及高价磷酸肌醇含量, 在同步降低籽粒锌含量的同时, 进一步显著降低其在水稻籽粒中的生物有效性。
磷; 植酸; 锌生物有效性; 磷酸肌醇; 稻米品质
锌是作物生长发育所必需的微量营养元素, 参与作物光合、逆境胁迫、激素合成、种子萌发以及细胞膜建成等多个生理过程[1-2]。全世界范围内土壤缺锌均较为普遍, 碱性石灰土壤中锌虽然不是一个限制因子, 但往往会与碳酸钙结合或被土壤团粒吸附, 降低其被作物吸收利用的有效性[2]。此外, 锌在人体生理代谢中也发挥着重要作用[3], 食源锌摄入不足, 即所谓的“隐性饥饿”, 已经威胁到世界1/3人口的健康, 其中以发展中国家面临的挑战最为严峻[4]。
水稻是重要的粮食作物, 全国有65%的人口以稻米为主粮。与其他禾谷类和豆科作物相比, 水稻籽粒中的锌、铁含量普遍较低, 且集中分布于表皮及糊粉层中[5]。受传统饮食习惯的影响, 水稻籽粒在去麸加工成精米的过程中会造成锌(27%~45%)、铁(60%~76%)等矿质元素的进一步流失[2,6]。而植酸(C6H18O24P6, InsP6, 六磷酸肌醇)作为水稻籽粒中磷的最主要贮存形式, 往往还会与稻米中的锌、铁、钙和镁等矿质营养元素络合, 形成难溶性的植酸盐, 从而降低它们的生物有效性[2]。因此, 生物强化的实现, 除需培育和筛选锌、铁富集的优质作物资源, 还应同时降低作物籽粒中植酸等“抗营养元素”的水平。
磷素对水稻籽粒中锌和植酸的合成和积累都有显著的调控效应[7-9]。首先, 磷素是稻米中植酸积累最直接的调控因子。前人在不同作物(小麦、燕麦、玉米、水稻、大豆等)中已广泛证明外源磷供应对作物籽粒植酸的积累有显著促进作用[10-13], 且籽粒不同部位的植酸积累对外源磷的响应还存在一定的空间区位特异性[14-15]。其次, 磷也是影响作物籽粒中锌含量的重要环境生态因子[16], 但由于磷肥对作物籽粒锌的调控同时还受到土壤特性、土壤中菌根数量、根系形态特征、作物类型以及气候条件等因子互作的影响[9,17], 使得磷肥对作物籽粒锌积累的影响规律还存在不一致甚至相互矛盾的地方。尤其是在目前集约化栽培体系下, 施磷量普遍较高[16], 过量磷肥投入在可能影响稻米植酸含量的同时, 对籽粒锌含量以及锌的生物有效性的影响, 目前还少见相关报道。
本研究利用大田磷肥长期定位试验, 结合稻穗离体磷培养, 旨在阐明磷营养对籽粒锌的生物有效性的影响及其与籽粒不同价位磷酸肌醇含量之间的关系, 为稻米品质改良及合理磷肥运筹提供理论依据。
1 材料与方法
1.1 大田磷肥长期定位试验
大田试验地点是浙江省海宁市杨渡村浙江省农业科学院肥料长期定位试验基地。该基地从2011年起开始连续用于磷肥长期定位试验, 土壤类型为水稻土类、黄松田土属。2016年水稻播种前土壤速效氮和速效钾含量分别为126.6 mg kg–1和135.9 mg kg–1, 2017年水稻播种前土壤速效氮和速效钾含量分别为151.7 mg kg–1和126.5 mg kg–1。供试水稻材料为秀水134。采用随机区组设计, 设3个磷肥处理水平, 分别为不施磷处理(0 kg hm–2, LP)、中磷处理(75 kg hm–2, MP)和高磷处理(150 kg hm–2, HP)。磷肥于水稻播种前一次性基施, 设每个磷处理3个重复小区, 小区面积30 m2。其中, 不施磷处理的3个小区土壤速效磷的本底值为43.2 mg kg–1(2016年)和37.4 mg kg–1(2017年), 中磷处理的3个小区土壤速效磷的本底值为151.5 mg kg–1(2016年)和146.7 mg kg–1(2017年), 高磷处理的3个小区土壤速效磷的本底值为206.3 mg kg–1(2016年)和214.6 mg kg–1(2017年)。在2016和2017年的试验期间, 不同磷肥处理小区的氮肥(尿素)和钾肥(氯化钾)用量一致, 分别为180 kg hm–2和120 kg hm–2。其中, 氮肥按基肥∶分蘖肥∶穗肥比例5∶2∶3施用, 分蘖肥于移栽后7 d一次性施用, 穗肥于倒四叶时期施用。钾肥分别于移栽前和穗肥期等量施入。各小区之间用水泥埂隔开, 并包被防水薄膜, 独立排灌。播种日期分别是2016年5月20日和2017年5月21日, 采用常规湿润育秧, 25 d左右的秧龄时手工移栽于大田, 栽插密度为25 cm × 13 cm, 每穴2株苗。水稻大田生长期间田间进行常规水分管理, 及时防治病虫杂草。待水稻生长至齐穗期, 选同日开花的单穗挂牌标记, 并在水稻成熟收获时取标记稻穗籽粒。
1.2 稻穗离体培养试验
为进一步明确外源磷与水稻籽粒锌的生物有效性及植酸磷等磷酸肌醇谱含量之间的关系。我们在大田磷肥长期定位试验的基础上, 利用多磷梯度水平的稻穗离体培养试验, 对其调控规律做了进一步探讨。稻穗离体培养试验在浙江大学紫金港校区控温培养室进行。供试水稻品种为秀水110, 单季稻种植, 播种日期与田间试验一致, 6月中旬单本插栽于大田, 常规高产水作管理。参照已授权发明专利(专利授权号: CN103355169B)的稻穗离体培养方法。抽穗期选择生育时期一致(长势、生育进程及外观)的水稻主茎进行培养。离体主茎需保留2个完整节间, 同时保留5 cm长旗叶和旗叶鞘。暴露于培养瓶中的主茎部位需依次用70%乙醇和1%次氯酸钠分别消毒45 s和15 min。其后迅速转移至已灭菌的培养基及培养瓶中, 并用无菌脱脂棉包裹固定, 便于与外界环境隔绝, 离体培养过程中培养瓶内部全程保持无菌。将培养瓶统一置1~2℃冰台的浅层冷水浴中。由室内控温控湿控光装置调控, 穗层温度为24~26℃, 湿度为75%。16 h光照/8 h黑暗, 光强为300 µmol m–2s–1。培养过程每6 d更换一次培养基, 并重复前期稻株和培养基的灭菌过程。离体培养试验以NaH2PO4·2H2O为磷源, 设0、1、3、6和12 mmol L–1五个磷梯度处理(分别标记为P0、P1、P3、P6、P12)。不同处理间除磷水平差异外, 培养基的其他成分保持一致。
1.3 籽粒不同磷组分(植酸磷、不同价位磷酸肌醇谱、总磷)含量分析
风干水稻籽粒样品经去离子水冲洗3次并吸干水分, 于60℃烘干至恒重后, 人工去壳, 用研钵手工研磨成米粉, 并过0.25 mm筛后放入聚乙烯离心管中低温保存, 用于品质相关的理化指标分析。籽粒植酸含量采用Liu等[18]和Bi等[19]铁沉淀法分析, 植酸磷含量 = 植酸含量 × 0.2815; 总磷含量参照Wilcox等[20]方法测定。不同价位磷酸肌醇含量参照Zhou等[21]方法利用HPLC-ESI-MS测定。
1.4 籽粒锌含量及锌的生物有效性分析
籽粒锌含量参照Wei等[22]的电感耦合等离子体质谱法(ICP-MS)分析。
锌的生物有效性(TAZ)参照Miller等[23]的三元模型分析:

其中, 每日摄入锌的生物有效性(TAZ, mg Zn d–1), 即有效锌指数, 将根据每日膳食中植酸(TDP, mmol PA d–1)和锌(TDZ, mmol Zn d–1)的含量拟合后获得。与肠内锌稳态和生物利用率相关的3个常数为MAX(最大锌吸收) = 0.091;R(Zn受体结合反应的平衡解离常数) = 0.680;P(Zn和PA结合反应的平衡解离常数) = 0.033。以平均每日稻米摄入量400 g作为Zn和PA的来源[24]。
此外, 用能谱扫描电镜分析籽粒中磷和锌的空间分布, 参照戴云云等[25]方法, 直接用镊子掰断稻穗离体培养的典型磷处理的糙米样品(P0、P3、P12), 保留自然状态下断裂的横截面, 朝上将样品沾于铜样台上, 用离子溅射喷镀仪对断面镀金处理后, 在场发射扫描电子显微镜(XL30 ESSM-TMP)上观察照相。
1.5 数据统计分析
采用Microsoft Excel 2016对数据进行录入、整理和计算, 运用SPSS 16.0 (SPSS, Inc., Chicago, IL, USA)软件对试验数据进行方差分析, 以Turkey多重比较分析处理间差异显著性, 显著水平设定为=0.05 (One-way ANOVA, Turkey’s Multiple Range Test), 以GraphPad Prism软件绘图。并用R统计软件进行相关性分析(R分析包为pheatmap)。最终结果以平均数±标准差表示。
2 结果与分析
2.1 大田长期磷肥定位试验中不同磷肥处理对水稻籽粒植酸、锌含量和锌生物有效性的影响
由图1可见, 磷肥施用量对水稻籽粒植酸磷含量和总磷含量有显著的影响。其中, 籽粒植酸磷含量和总磷含量均随磷肥施用量的增加呈上升趋势, 且高磷(HP)处理 > 中磷(MP)处理 > 不施磷(LP)处理(其中2017年中磷和高磷处理的籽粒植酸磷含量差异不显著), 但籽粒植酸磷与总磷的比值(PAP/TP)在高磷处理(HP)却呈下降趋势, 2年大田试验的数据规律基本一致。上述现象说明, 磷肥施用量的增加会引起水稻籽粒中植酸磷和总磷含量的显著提升, 其中总磷相比植酸磷含量受磷肥处理的影响更为显著。
水稻籽粒中的锌和铁含量随磷肥施用量增加呈明显下降趋势(图2)。2年数据中, 与LP相比, HP处理下水稻籽粒中锌含量降低了9.0%~10.7%, 铁含量降低了15.4%~17.1%。磷肥处理对水稻籽粒中锰含量的影响效应不明显, 而籽粒铜含量在年际间的变化不一致。受籽粒植酸磷和锌含量共同变化的影响, 不同磷肥处理下水稻籽粒锌的有效性的变异系数进一步加大(其中, 2016和2017年间植酸和锌的变异系数分别为4.0%~5.7%和4.4%~5.2%, 而锌的生物有效性的变异系数为8.7%~9.8%)。与LP处理相比, HP处理下籽粒锌的生物有效性降低了18%~20%。

图1 大田磷肥处理对水稻籽粒植酸磷、总磷含量以及植酸磷/总磷比值的影响
标以相同小写字母的柱值差异未达到0.05的显著水平。LP: 低磷处理; MP: 中磷处理; HP: 高磷处理; PAP: 植酸磷; Total P: 总磷; PAP/total P: 植酸磷/总磷。
Bars indicated by the same letter among treatments are not significantly different at the 0.05 probability level. LP, MP, HP mean the low phosphorus level, medium phosphorus level, and high phosphorus level. PAP: phytic acid-phosphorus; Total P: total phosphorus; PAP/total P: phytic acid-phosphorus/total phosphorus.

图2 大田磷肥处理对水稻籽粒锌、铁、锰、铜含量以及锌的生物有效性的影响
标以相同小写字母的柱值差异未达到0.05的显著水平。LP: 低磷处理; MP: 中磷处理; HP: 高磷处理。TAZ: 锌的生物有效性。
Bars indicated by the same letter among treatments are not significantly different at the 0.05 probability level. LP, MP, HP mean the low phosphorus level, medium phosphorus level, and high phosphorus level, respectively. TAZ represents Zn bioavailability.
2.2 稻穗离体培养条件下外源磷处理对水稻籽粒植酸磷、不同价位磷酸肌醇谱、锌含量及其生物有效性的影响
随外源磷处理浓度的上升, 水稻籽粒中的植酸磷和总磷含量呈逐渐增加的趋势(图3)。但外源磷处理浓度对水稻籽粒PAP/TP比值影响不显著。利用能谱扫描电镜对典型磷处理浓度(P0、P3和P12)下水稻籽粒样品磷元素分布观测也表明, 随外源磷水平的上升, 水稻籽粒的表皮及糊粉层、籽粒内部淀粉层的磷积累量均明显增加(图4)。考虑到植酸是籽粒磷的最主要贮存形式, 能谱电镜扫描下籽粒在不同空间的磷分布可近似代表籽粒植酸的变化, 说明外源磷供给对水稻籽粒不同部位的植酸磷积累都有一定的促进作用。

图3 外源磷处理对水稻籽粒植酸磷、总磷含量以及植酸磷/总磷的比值的影响(稻穗离体培养)
标以相同小写字母的柱值差异未达到0.05的显著水平。P0、P1、P3、P6、P12分别代表0、1、3、6和12 mmol L–1的5个NaH2PO4·2H2O浓度梯度处理。PAP: 植酸磷; Total P: 总磷; PAP/total P: 植酸磷/总磷。
Bars indicated by the same letter among treatments are not significant at the 0.05 probability level. P0, P1, P3, P6, P12mean the P (NaH2PO4·2H2O ) levels of 0, 1, 3, 6, and 12 mmol L–1, respectively. PAP, total P, PAP/total P mean phytic acid-phosphorus, total phosphorus, and phytic acid-phosphorus/total phosphorus, respectively.
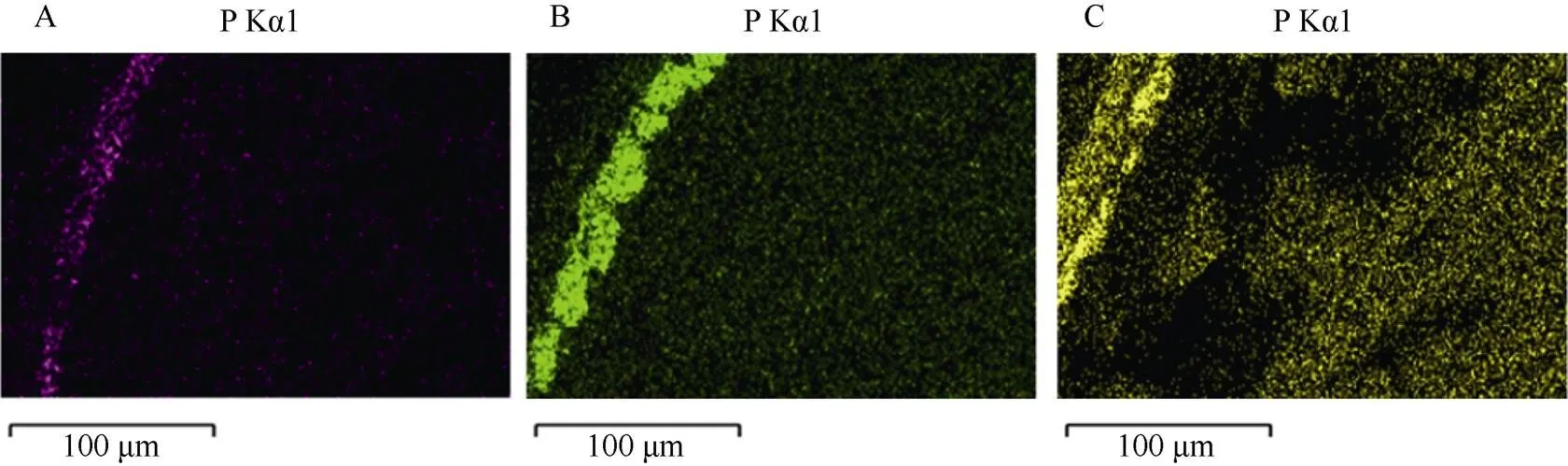
图4 稻穗离体培养体系中不同磷浓度水平下水稻籽粒中的磷分布(5000倍光镜下稻米横断面扫描, 100 μm)
A: P0处理; B: P3处理; C: P12处理。
A, B, C represent P0, P3, and P12treatments, respectively.
利用HPLC-ESI-MS对水稻籽粒中植酸合成过程中不同价位的磷酸肌醇谱(InsP1、InsP2、InsP3、InsP4、InsP5、InsP6)含量进行测定(图5), 表明外源磷处理影响水稻籽粒植酸磷与总磷含量的同时, 对水稻籽粒中的不同价位的磷酸肌醇谱的含量也会产生显著的影响。随外源磷处理浓度的上升, InsP6、InsP5和InsP4含量(mg g–1)呈明显上升趋势。与低价磷酸肌醇衍生物(InsP1、InsP2)相比, 高价磷酸肌醇(InsP4-6)在不同磷浓度处理下的差异幅度更大。此外, 水稻籽粒中的不同价位磷酸肌醇在不同磷浓度处理下的相对比例均表现为InsP6> InsP5> InsP4> InsP(1-3)。其中, InsP6、InsP5和InsP4分别占水稻籽粒总磷酸肌醇含量的70%~79%、17%~20%和2%~8%, 但外源磷处理对水稻籽粒不同价位磷酸肌醇组分所占比例的影响规律不显著(图6)。

图5 外源磷处理对水稻籽粒不同价位磷酸肌醇含量的影响(稻穗离体培养)
P0、P1、P3、P6、P12分别代表0、1、3、6和12 mmol L–1的5个NaH2PO4·2H2O浓度梯度处理。
P0, P1, P3, P6, P12mean the P (NaH2PO4·2H2O) levels of 0, 1, 3, 6, and 12 mmol L–1, respectively.

图6 外源磷处理下水稻籽粒中不同价位磷酸肌醇占总磷酸肌醇含量的比例(稻穗离体培养)
A: P0; B: P1; C: P3; D: P6; E: P12.
稻穗离体培养下, 外源磷供给对水稻籽粒锌的积累也有显著影响。对最适磷浓度处理(P3)和极端磷处理样品(无磷, P0; 极高磷, P12)的能谱扫描电镜分析显示, 高磷浓度处理下, 籽粒中锌的含量在籽粒不同的横切面都表现为显著降低(图7)。ICP-MS的定量分析结果也表明(图8), 相较于适宜P浓度处理(P3), 高磷浓度水平(P12)下水稻籽粒中锌的含量降低了26.4%。由于极高磷(P12)水平相比无磷处理(P0)籽粒植酸磷含量增加了4.5倍, 因此受籽粒植酸磷和锌含量共同变化的影响, 高磷浓度水平下锌的生物有效性相比无磷处理(P0)降低了81.3%。说明籽粒锌的生物有效性相比籽粒锌含量受外源磷的影响更为显著(图8)。
2.3 不同磷素处理下各种指标之间的相关性
大田磷肥试验表明(图9左), 籽粒植酸磷和总磷之间呈极显著正相关(0.944**), 与籽粒锌的生物有效性之间呈极显著负相关(−0.692**)。综合田间长期磷肥定位试验和稻穗离体培养进行相关性分析(图9右)表明, 籽粒植酸磷和锌的生物有效性之间呈现极显著的负相关(−0.780**)。说明外源磷处理可显著增加水稻籽粒植酸磷和总磷含量, 同时降低籽粒锌的生物有效性。

图7 稻穗离体培养体系中不同磷浓度水平下水稻籽粒中锌的分布(5000倍光镜下稻米横断面扫描, 标尺为100 μm)
A: P0处理; B: P3处理; C: P12处理。
A, B, C represent P0, P3, and P12treatment, respectively.

图8 外源磷处理水稻籽粒锌的含量及其有效性的影响(稻穗离体培养)
标以相同小写字母的柱值差异未达到0.05的显著水平。P0、P1、P3、P6、P12分别代表0、1、3、6和12 mmol L–1的5个NaH2PO4·2H2O浓度梯度处理。TAZ: 锌的生物有效性。
Bars indicated by the same letter among treatments are not significant at the 0.05 probability level. P0, P1, P3, P6, P12mean the P (NaH2PO4·2H2O) levels of 0, 1, 3, 6, and 12 mmol L–1, respectively. TAZ: Zn bio-availability.
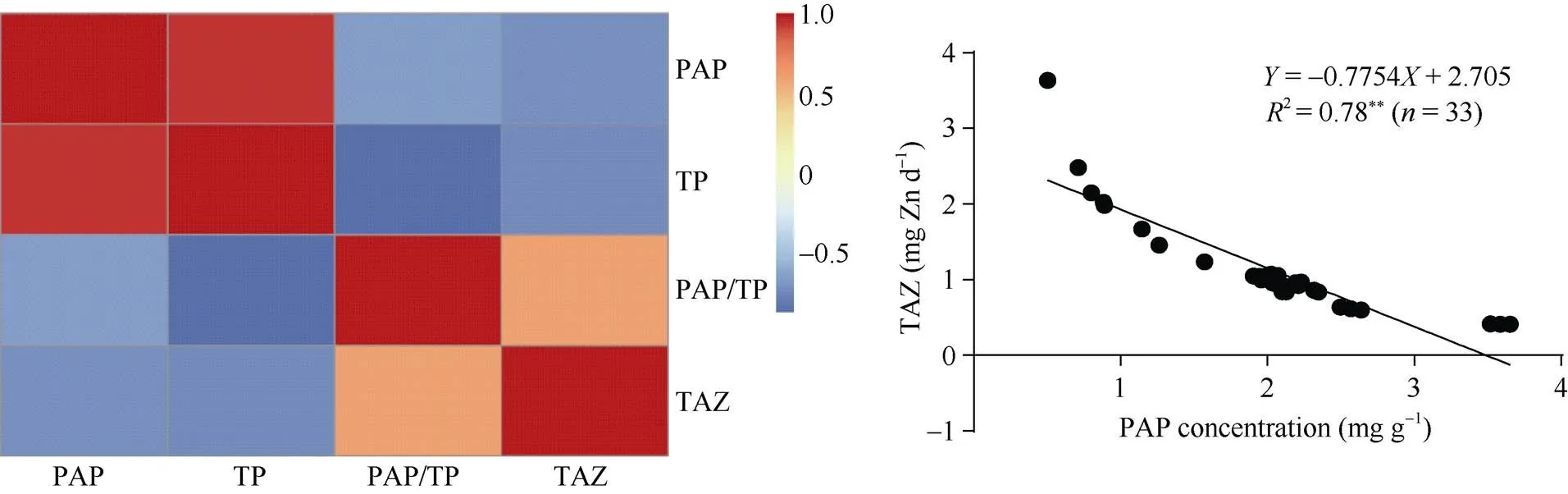
图9 不同磷肥处理水平下水稻籽粒磷组分和锌的生物有效性之间的相关性分析(左: 大田试验; 右: 大田试验+稻穗离体培养试验)
PAP: 植酸磷; TP: 总磷; TAF: 锌的生物有效性。
PAP: phytic acid phosphours; TP: total phosphours; TAF: Zn bio-availabiity.**< 0.01.
3 讨论
针对水稻和小麦等大宗粮食作物籽粒锌、铁的生物强化, 是目前农业研究中作物品质改良以及对抗“隐性饥饿”的主要方向。实现生物强化的目标, 除要通过育种和栽培管理措施提高籽粒微营养含量外,还需要同步降低以植酸为主的“抗营养元素”水平, 只有这样才能保障或提高锌等微营养在人体内的真正有效吸收。本试验在大田磷肥梯度长期定位试验的基础上, 进一步利用稻穗离体培养体系, 通过拉大外源磷梯度效应和精确控制区分“源”中磷素供应量, 试图进一步明确外源磷素对水稻籽粒锌的生物有效性的影响及其与籽粒植酸等磷酸肌醇谱含量之间的关系。
与前人关于外源磷调控籽粒植酸合成的研究结果相似[16,26], 本试验也表明外源磷(肥)可显著提高籽粒中植酸磷和总磷的含量(图1、图3、图4和图5), 大田和离体培养试验的结果相似。然而大田磷肥调控下, 水稻籽粒中总磷含量的增幅相比植酸磷变化更为显著, 使得高磷处理水平(HP)下水稻籽粒植酸磷与总磷的比值(PAP/TP)显著降低, 说明植酸磷、无机磷以及其他磷组分在高磷处理下的变化规律并不完全一致。Sompong等[27]对绿豆籽粒磷组分含量相关的QTL分析表明, 控制籽粒不同磷组分含量的基因位点不一致。其中, 有3个位点参与植酸磷(PAP)的合成, 另有2个和1个位点分别控制总磷、无机磷的合成。Taliman等[28]研究表明, 对低植酸大豆品系(LP-F10)而言, 高磷浓度处理下籽粒无机磷含量的显著提高是总磷含量升高的主要原因, 植酸磷对外源磷浓度的响应不显著。而常规品种(Enrei)的植酸磷和其他磷组分表现为同步增加, 无机磷变化不显著。说明磷(肥)对作物籽粒中不同磷组分的影响, 可能同时还受到籽粒植酸遗传背景、磷肥梯度以及基因型差异等综合因素的影响。此外, 长期磷肥定位试验中, 施入土壤中的磷肥有效性除与肥料投入量密切相关外, 还受到土壤特性和土壤菌根数量的影响[29-30], 这可能是不同磷水平调控下, 籽粒磷的不同形态及其比例变化不一致的原因之一。同时, 大田栽培和离体培养体系中, 水稻在磷吸收、运转过程中的差异也可能是本试验PAP/TP在高磷浓度水平下变化规律不一致的原因之一。
前人已广泛证明氮肥可显著促进作物籽粒锌、铁积累[31-32]。Kutman等[33]对硬粒小麦的研究表明, 氮素营养无论是对锌获取还是锌向籽粒中的转运都起到关键的作用。然而目前关于磷肥对作物锌等微营养品质影响的结论尚不完全一致。Bolland等[34]的结果表明, 缺磷土壤补充磷肥后, 小麦籽粒中锌含量变化并不显著。Orabi等[35]的结果表明, 磷肥促进锌从叶片向籽粒的转运, 并增加籽粒锌的积累。而Zhang等[36]研究表明, 磷肥会限制茎鞘中的锌积累, 继而减少锌向籽粒的转运, 成熟期小麦锌含量降幅可达17%~56%, 但在Zhang等[16]的研究中这种抑制效应在磷梯度超过100 kg hm–2时变化开始不显著, 说明高磷对籽粒锌吸收的抑制效应还与具体的磷水平设置有关。此外, Ova等[9]认为外源磷供应降低小麦根系锌吸收、营养器官锌转移以及籽粒中的锌积累, 主要与土壤中的菌根种类和数量有关。在缺乏菌根的培养基中没有发现籽粒磷与锌的负向调控效应。本试验结果表明(图2、图7和图8), 磷(肥)供应下水稻籽粒中锌含量显著降低。不同的磷供应试验(大田和离体培养)的结果一致。说明菌根种类和数量的差异并不是磷素抑制籽粒锌积累的唯一原因, 相关磷锌互作的生理机制有待进一步研究。
由于锌在人体和非反刍动物体内最终被吸收的量(即锌的生物有效性)同时还会受胃肠分泌的影响, 并不仅仅只是一个简单的量的吸收过程[37]。传统以植酸和锌的摩尔比([PA]/[Zn])来表征锌的有效性的方法, 在高植酸背景研究中因其高抑制效应不具有真实评价意义。同时也忽略了其他高价磷酸肌醇盐(InsP4和InsP5)对以锌为主的矿质元素的络合效应。因此, 本研究在外源磷调控籽粒锌相对含量的基础上, 利用三元模型, 通过模拟锌在人/单胃动物肠胃内的消化吸收过程, 进一步分析不同磷浓度处理下籽粒锌的生物有效性的变化。大田试验和稻穗离体培养结果均表明高磷处理会显著降低锌的生物有效性。其中长期磷肥定位试验在相对较小的磷肥梯度水平内, 锌的生物有效性降低了18%~20% (图2)。而稻穗离体培养体系通过拉大磷供应梯度, 极高磷浓度梯度(P12)相较无磷(P0)处理, 籽粒中锌的生物有效性降幅高达81.3% (图8)。相关性分析结果也表明, 植酸磷和籽粒锌的生物有效性之间呈极显著负相关(图9)。因此从稻米营养品质角度考量, 过量磷水平会显著降低人体对锌的有效吸收。
水稻籽粒植酸合成是以光合产物葡萄糖-6-磷酸(G-6-P)为起始底物不断顺序磷酸化的过程[15]。在不同价位的磷酸肌醇中间产物(InsP1-6)中, 低价磷酸肌醇的磷酸基团较少, 络合矿质离子的能力相对较弱。而高价磷酸肌醇(InsP4, InsP5)具有与植酸(InsP6)相似的多羟基生化结构, 同样可以络合矿质离子并降低它们的生物有效性[15,37-39]。前人关于植酸对矿质元素有效性影响的定量分析, 往往只关注磷酸肌醇合成的终产物, 即植酸(InsP6, 六磷酸肌醇)的含量水平, 忽略了其他高价磷酸肌醇(InsP4-5)对锌等矿质元素的络合效应。基于这样的研究背景, 本研究首次利用HPLC-ESI-MS分析了外源磷对不同价位磷酸肌醇含量/比例的影响, 试图进一步明确外源磷素调控下籽粒植酸等磷酸肌醇谱系的分布变化特征。试验结果表明, 不同磷处理水平下, 磷酸肌醇谱系中均表现为高价磷酸肌醇的含量显著高于低价磷酸肌醇, 总体表现为InsP6> InsP5> InsP4> InsP1-3, 其中籽粒植酸InsP6占到了磷酸肌醇总含量的70%以上(图2)。外源磷处理可以显著提高不同价位的磷酸肌醇含量, 其中以高价磷酸肌醇(InsP4-6)对外源磷的响应最为显著。本试验中高磷浓度处理下高价磷酸肌醇(InsP4和InsP5)的相对高比例(19%~24%), 说明高磷浓度处理下籽粒锌的生物有效性, 即真正被人体有效吸收的锌比例, 可能被普遍低估。因此, 在保障水稻产量优势的同时适当降低磷肥投入, 对改善作物以锌为主的微营养品质, 解决“隐性饥饿”具有重要的借鉴意义。
4 结论
外源磷可显著提高作物籽粒的植酸磷、不同价位磷酸肌醇以及总磷含量, 同时降低籽粒锌含量。外源磷供应下稻米植酸磷和锌含量的同步变化, 最终导致锌的生物有效性进一步显著降低。过量磷肥投入对籽粒锌营养的负向调控效应显著。
[1] Noulas C, Tziouvalekas M, Karyotis T. Zinc in soils, water and food crops., 2018, 49: 252–260.
[2] Hefferon K. Biotechnological approaches for generating zinc-enriched crops to combat malnutrition., 2019, 11: 253.
[3] Maqbool M A, Beshir A. Zinc biofortification of maize (L.): Status and challenges., 2019, 138: 1–28.
[4] Jaksomsak P, Tuiwong P, Rerkasem B, Guild G E, Palmer L J, Stangoulis J C, Promuthai C. The impact of foliar applied zinc fertilizer on zinc and phytate accumulation in dorsal and ventral grain sections of four Thai rice varieties with different grain zinc., 2018, 79: 6–12.
[5] Li W, Huang J, Zhao H, Tan Y, Cui H, Poirier Y, Shu Q. Production of low phytic acid rice by hairpin RNA- and artificial microRNA-mediated silencing ofin seeds., 2014, 119: 15–25.
[6] Liang J, Li Z, Tsuji K, Nakano K, Nout M J R, Hamer R J. Milling characteristics and distribution of phytic acid and zinc in long-, medium- and short-grain rice., 2008, 48: 83–91.
[7] Perera I, Seneweera S, Hirotsu N. Manipulating the phytic acid content of rice grain toward improving micronutrient bioavailability., 2018, 11: 4.
[8] Julia C, Wissuwa M, Kretzschmar T, Jeong K, Rose T J. Phosphorus uptake, partitioning and redistribution during grain filling in rice., 2016, 118: 1151–1162.
[9] Ova E A, Kutman U B, Ozturk L, Cakmak I. High phosphorus supply reduced zinc concentration of wheat in native soil but not in autoclaved soil or nutrient solution., 2015, 393: 147–162.
[10] Saneoka H, Koba T. Plant growth and phytic acid accumulation in grain as affected by phosphorus application in maize (L.).,2003, 48: 485–489.
[11] Miller G A, Youngs V L. Environmental and cultivar effects on oat phytic acid concentration.1980, 57: 189–191.
[12] Raboy V, Dickinson D B. Effect of phosphorus and zinc nutrition on soybean seed phytic acid and zinc.1984, 75: 1094–1098.
[13] Noack S R, Mclaughlin M J, Smernik R J, Mcbeath T M, Armstrong R. Phosphorus speciation in mature wheat and canola plants as affected by phosphorus supply., 2014, 378: 125−137.
[14] Su D, Zhou L J, Zhao Q, Pan G, Cheng F M. Different phosphorus supplies altered the accumulations and quantitative distributions of phytic acid, zinc, and iron in rice (L.) grains., 2018, 66: 1601–1611.
[15] Raboy V. Seeds for a better future: ‘low phytate’, grains help to overcome malnutrition and reduce pollution., 2001, 6: 458–462.
[16] Zhang W, Liu D, Liu Y, Chen X, Zou C. Overuse of phosphorus fertilizer reduces the grain and flour protein contents and zinc bioavailability of winter wheat (L.)., 2017, 65: 1473–1482.
[17] Imran M, Rehim A, Sarwar N, Hussain S. Zinc bioavailability in maize grains in response of phosphorous–zinc interaction., 2016, 179: 60–66.
[18] Liu Z H, Cheng F M, Cheng W D, Zhang G P. Positional variations in phytic acid and protein content within a panicle ofrice., 2005, 41: 297–303.
[19] Bi J, Liu Z, Lin Z, Alim M A, Rehmani M I A, Li G, Wang Q S, Wang S H, Ding Y F. Phosphorus accumulation in grains ofrice as affected by nitrogen fertilizer., 2013, 369: 231−240.
[20] Wilcox J R, Premachandra G S, Young K A, Raboy V. Isolation of high seed inorganic P, low-phytate soybean mutants., 2000, 40: 1601−1605.
[21] Zhou L, Ye Y, Zhao Q, Du X, Zakari S A, Su D, Pan G, Chen F M. Suppression of ROS generation mediated by higher InsP3level is critical for the delay of seed germination inrice., 2018, 85: 411−424.
[22] Wei Y Y, Shohag M, Wang Y Y, Lu L L, Wu C Y, Yang X. Effect of zinc sulfate fortification in germinated brown rice on seed zinc concentration, bioavailability, and seed germination., 2012, 60: 1871−1879.
[23] Miller L V, Krebs N F, Hambidge K M. A mathematical model of zinc absorption in humans as a function of dietary zinc and phytate., 2007, 137: 135−141.
[24] Brombach C, Manorut P, Kolambage-Dona P P P, Ezzeldin M F, Chen B, Corns W T, Feldmann J, Krupp E M. Methylmercury varies more than one order of magnitude in commercial European rice., 2017, 214: 360−365.
[25] 戴云云, 丁艳锋, 刘正辉, 王强盛, 李刚华, 王绍华. 花后水稻穗部夜间远红外增温处理对稻米品质的影响. 中国水稻科学, 2009, 23: 414−420. Dai Y Y, Ding Y F, Liu Z H, Wang Q S, Li G H, Wang S H. Effects of elevated night temperature by far-infrared radiation at grain filling on grain quality of rice., 2009, 23: 414−420 (in Chinese with English abstract).
[26] Coelho C M M, Santos J C P, Tsai S M, Vitorello V A V C. Seed phytate content and phosphorus uptake and distribution in dry bean genotypes., 2002, 14: 51−58.
[27] Sompong U, Somta P, Raboy V, Srinives P. Mapping of quantitative trait loci for phytic acid and phosphorus contents in seed and seedling of mungbean [(L.) Wilczek]., 2012, 62: 87−92.
[28] Taliman N A, Dong Q, Echigo K, Raboy V, Saneoka H. Effect of phosphorus fertilization on the growth, photosynthesis, nitrogen fixation, mineral accumulation, seed yield, and seed quality of a soybean low-phytate line., 2019, 8: 119.
[29] Park M, Singvilay O, Shin W, Kim E, Chung J, Sa T. Effects of long-term compost and fertilizer application on soil phosphorus status under paddy cropping system., 2004, 35: 1635−1644.
[30] Zhang W, Liu D, Li C, Cui Z, Chen X, Russell Y, Zou C. Zinc accumulation and remobilization in winter wheat as affected by phosphorus application., 2015, 184: 155−161.
[31] Zhang J, Wu L H, Wang M Y. Iron and zinc biofortification in polished rice and accumulation in rice plant (L.) as affected by nitrogen fertilization., 2008, 58: 267−272.
[32] Xue Y F, Yue S C, Zhang Y Q, Cui Z, Chen X, Yang F, Cakmak I, McGrath S P, Zhang F S, Zou C Q. Grain and shoot zinc accumulation in winter wheat affected by nitrogen management., 2012, 361: 153−163.
[33] Kutman U B, Yildiz B, Cakmak I. Effect of nitrogen on uptake, remobilization and partitioning of zinc and iron throughout the development of durum wheat., 2011, 342: 149−164.
[34] Bolland M D A. Residual value of superphosphate and Queensland rock phosphate measured using yields of serradella, burr medic and subterranean clover grown in rotation with wheat and bicarbonate-extractable soil phosphorus., 1993, 24: 1243−1269.
[35] Orabi A A, Mashadi H, Abdallah A, Morsy M F. Effect of zinc and phosphorus on the grain yield of corn (L.) grown on a calcareous soil., 1981, 63: 291−294.
[36] Zhang Y, Deng Y, Chen R, Cui Z L, Chen X P, Yost R, Zhang F S, Zou C Q. The reduction in zinc concentration of wheat grain upon increased phosphorus-fertilization and its mitigation by foliar zinc application., 2012, 361: 143−152.
[37] Liang J, Han B, Nout M J, Hamer R J. Effects of soaking, germination and fermentation on phytic acid, total andsoluble zinc in brown rice., 2008, 110: 821−828.
[38] Bohn L, Josefsen L, Meyer A A, Rasmussen S K. Quantitative analysis of phytate globoids isolated from wheat bran and characterization of their sequential dephosphorylation by wheat phytase., 2007, 55: 7547−7552.
[39] 苏达, 吴良泉, Søren K R, 周庐建, 程方民. 低植酸水稻种质资源筛选、遗传生理调控与环境生态适应性研究进展. 中国水稻科学, 2019, 33: 95−107. Su D, Wu L Q, Søren K R, Zhou L J, Cheng F M. Research advances on the low phytic acid rice breeding and their genetic physiological regulation and environmental adaptability., 2019, 33: 95−107 (in Chinese with English abstract).
Influence of phosphorus on rice (L.) grain zinc bioavailability and its relation to inositol phosphate profiles concentration
SU Da1,2, WU Liang-Quan2, Søren K. Rasmussen3, ZHOU Lu-Jian4, PAN Gang4, and CHENG Fang-Min4,*
1Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops / College of Agriculture, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China;2International Magnesium Institute, Fuzhou 350002, Fujian, China;3Department of Plant and Environmental Sciences, Section of Plant and Soil Science, University of Copenhagen, Copenhagen, Denmark;4College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058, Zhejiang, China
The hidden hunger caused by grain zinc (Zn) deficiency in crop poses a potential threat to the health of nearly two billion people worldwide, especially in developing countries. In this study, the long-term phosphorus fertilizer experiment anddetached rice panicle culture systems with varied phosphorus levels were conducted to investigate the effect of phosphorus on rice grain Zn bioavailability and its relation of grain inositol phosphates profiles (phytic acid related metabolic derivatives) concentration. In our results, compared with low phosphorus level, high phosphorus supply increased grain phytic acid phosphorus and total phosphorus concentration (mg g–1). Moreover, high phosphorus supply also increased different grain inositol phosphate profile concentrations (InsP1-6), especially for InsP4-6. On the contrary, grain Zn concentration decreased with phosphorus supply. Both the decrement of Zn and increment of phytic acid phosphorus induced by the higher phosphorus supply in rice grain led to the significant decrement of grain Zn bioavailability. Indetached panicle culture system, the Zn bioavailability in P12treatment decreased by 81.3% relative to P0treatment. In conclusion, higher phosphorus input could significantly decrease grain Zn bioavailability through increased grain phytic acid phosphorus and inositol phosphates derivatives concentration, in addition to the decrement of grain Zn concentration.
phosphorus; phytic acid; zinc bioavailability; inositol phosphate; rice quality
本研究由国家重点研发计划项目(2016YFD0300502), 国家自然科学基金项目(31571602), 福建省自然科学基金项目(2019J01374), 福建省中青年教师教育科研项目(JAT170156)和国家留学基金委项目资助。
This study was supported by the National Key Research and Development Project (2016YFD0300502), the National Natural Science Foundation of China (31571602), the Fujian Province Natural Science (2019J01374), the Education and Scientific Research Project for Middle-aged and the Young Teachers in Fujian Province (JAT170156), and the Foundation for China Scholarship Council.
10.3724/SP.J.1006.2020.92032
程方民, E-mail: chengfm@zju.edu.cn, Tel:0571-86771117
E-mail: littlepest@126.com, Tel: 0591-83722796
2019-06-03;
2019-08-09;
2019-09-10.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190910.1316.010.html

