静脉注射针与自制PE-50管针头用于大鼠阴茎海绵体内压测定的比较
叶妙勇,赵凡,马轲,张利棕,方明笋,寿旗扬,马寅锋,黄文杰,吕伯东,6*
(1. 浙江中医药大学第二临床医学院,杭州 310053; 2. 南通大学附属医院泌尿男科,江苏 南通 226001; 3. 浙江中医药大学动物实验研究中心,杭州 310053; 4. 浙江中医药大学附属第二医院中心实验室,杭州 310005; 5. 浙江中医药大学附属第二医院泌尿外科,杭州 310005; 6. 浙江中医药大学泌尿男科研究所,杭州 310053)
勃起功能障碍(erectile dysfunction,ED)是男性常见性功能障碍疾病之一,指男性患者难以持续性的达到或保持足够的阴茎勃起以完成令人满意的性表现[1],当男性患者长期无法完成满意的性生活,将会影响家庭的和睦,并对身心造成难以避免的伤害。随着年龄的增长及众多基础疾病发生、发展将会损害勃起功能,二十世纪末期,全球超过1.52亿男性患者罹患ED,预估在2025年,将会新增1.7亿男性患者受到ED困扰[2]。
阴茎勃起受到神经血管复杂的调控作用,根据各类型ED的病因,国内外学者们构建了常见的相关ED的动物模型(包括神经源性ED、血管源性ED、内分泌源性ED等)用于阴茎勃起功能的研究[3]。啮齿类动物ED模型与兔、猫、狗及灵长类动物ED模型比较,具有易饲养、易操作、经济实惠等优势,是目前ED动物模型中首选的实验动物。
阴茎海绵体内压(intracavernsal pressure,ICP)测定实验是目前评估啮齿类动物ED模型勃起功能生理指标的首选检测方式[4-8],其主要过程包括阴茎海绵体置管、电刺激海绵体神经、生理信号经换能器向电信号转换等[9]。阴茎海绵体置管过程中,研究者主要采用自制聚乙烯(polyethylene,PE)管针和静脉输注针(venoclysis needle,VN)两种材料,ICP经上述材料传递到生理信号换能器进行生理信号的转换。糖尿病患者日益增多并且半数以上男性糖尿病患者遭受到ED困扰[10],因此本文采用糖尿病ED大鼠模型。目前尚无文献比较两种材料对ICP测量数据结果的影响进行比较,结合糖尿病ED大鼠模型对换能过程中的两种材料进行比较,以讨论其中哪种阴茎海绵体置管材料更适用于测定ICP。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年雄性SPF级SD大鼠36只,7~8周龄,体重(180 ± 200)g,购于由上海西普尔-必凯实验动物有限公司提供【SCXK(沪)2013-0016】,饲养于浙江中医药大学医学实验动物中心【SYXK(浙)2013-0184】,浙江中医药大学实验动物伦理审查委员会通过(伦理审批号:2018-145),室温20℃左右。照明/黑暗为12 h/12 h恒温环境下圈养,标准饲料,自由饮水,直至试验的当天。所有涉及到实验动物的使用与操作均遵循3R原则。
1.1.2 仪器和耗材
MP160型16通道生理记录分析系统购于美国BIOPAC公司;Master-8可编程刺激器购于以色列AMPI;阿扑吗啡(apomorphine,APO)购于美国APExBIO公司(批号:B6936);生理盐水购于山东齐鲁制药有限公司;Masson三色染色试剂盒购于南京建成科技有限公司(批号:D026-1-3);聚乙烯PE50导管购于英国Smith Medical公司;25-G静脉输注针购于江西洪达医疗器械集团有限公司。外科及显微外科常规手术器械。
1.2 方法
1.2.1 动物分组与模型建立
36 只正常SPF级雄性Sprague-Dawley(SD)大鼠,随机抽取其中16 只作为正常对照组(normal control group,NC),其余20 只归为糖尿病ED组(diabetes mellitus group,DM),DM组大鼠腹腔注射硫脲佐菌素(streptozotocin, STZ)60 mg/kg溶液构建糖尿病ED模型。8周后,连续3 d抽尾静脉血检测大鼠血糖,筛选出16只随机血糖均超过16.7 mmol/L的大鼠行阿扑吗啡(apomorphine,APO)实验。APO实验在ICP测定实验前两天进行,筛选DM模型大鼠,使用100 μg/kg APO(50 μg/mL)一次性注射施用大鼠皮下颈部区域。APO实验时,观察并记录两组大鼠的勃起次数进行数据统计分析。
1.2.2 ICP测定及海绵体神经刺激
造模结束后,使用3%戊巴比妥钠对大鼠进行麻醉,麻醉后仰卧位固定动物于手术板。对大鼠行腹部正中切口,大小约5 cm,逐层剪开并分离腹部皮肤及肌肉,暴露腹腔后使用棉花签进行逐层剥离前列腺组织和粘膜。盆神经节(major pelvic ganglia,MPG)贴附于前列腺左、右侧叶前外侧表面,MPG发出的海绵体神经(cavernous nerve,CN)血管束贴附前列腺向下走行经尿道支配阴茎(图1a、b)。眼科镊分离CN后,取一小段PE-10管置于分离空隙处[11](图1b、c),定位CN并且便于后续电刺激。电刺激参数:5 V,15 Hz,5 ms,60 s,刺激持续时间1 min,每次刺激间隔5 min。
阴茎海绵体插管:阴茎皮肤行纵切口暴露阴茎头部,分离皮肤与白膜,暴露双侧阴茎海绵体后,分别使用自制PE50管(10 mL注射器针头折断,前后两端连接PE-50管)以及25-G静脉输注针刺入阴茎海绵体,针头内压力经过两种材质传导后连入压力换能器。
1.2.3 平均动脉压(mean arterial pressure,MAP)测定
大鼠腹腔注射戊巴比妥钠(45 mg/kg),取颈部正中切口,使用镊子逐层钝性分离开颈部肌肉,暴露出左侧颈总动脉,眼科剪剪小口后置入PE-50管,并连接到压力换能器记录数据。
1.2.4 Masson三色染色
大鼠勃起功能测定实验结束后,取大鼠阴茎组织,PBS冲洗,4%多聚甲醛溶液固定,常规石蜡包埋,5 μm切片分为两组,一组用于HE染色,另一组用于Masson染色。Masson染色前先用蒸馏水润湿玻片30 s,核染液染色60 s,丢弃,冲洗液冲洗30 s。浆染液染色30 s,丢弃,冲洗液冲洗30 s。黄色分色液分色8 min左右弃去分色液,直接用蓝色复染液染色5 min左右,丢弃,使用无水乙醇冲洗干净,载玻片吹干后使用封片剂封片,显微镜下观察。
1.2.5 阿扑吗啡实验
阿扑吗啡评估勃起功能实验参照Yang等[12]报道的方法,ICP测定实验前2 d,大鼠喂食后置于环境安静房间的观察笼中,观察房间的灯光亮度调暗至可以肉眼观察的,等待10 min使大鼠适应新环境。于大鼠颈部皮下注射阿扑吗啡(100 μg/kg),注射后30 min内观察并记录阴茎勃起情况,阴茎末端出现充血的阴茎头部记录为一次勃起。正常组的大鼠与糖尿病模型组大鼠进行统计比较。
1.3 统计学分析
2 结果
2.1 阴茎海绵体内压检测主要流程及海绵体神经解剖位置
海绵体神经分支向尿道方向走行(图1a),使用眼科镊分离出海绵体神经并套如PE-10管(图1b、c),分别用两种置管材料进行插针(图1d、e),刺激海绵体神经后可见压力换能管内有明显血液回流(图1f)。
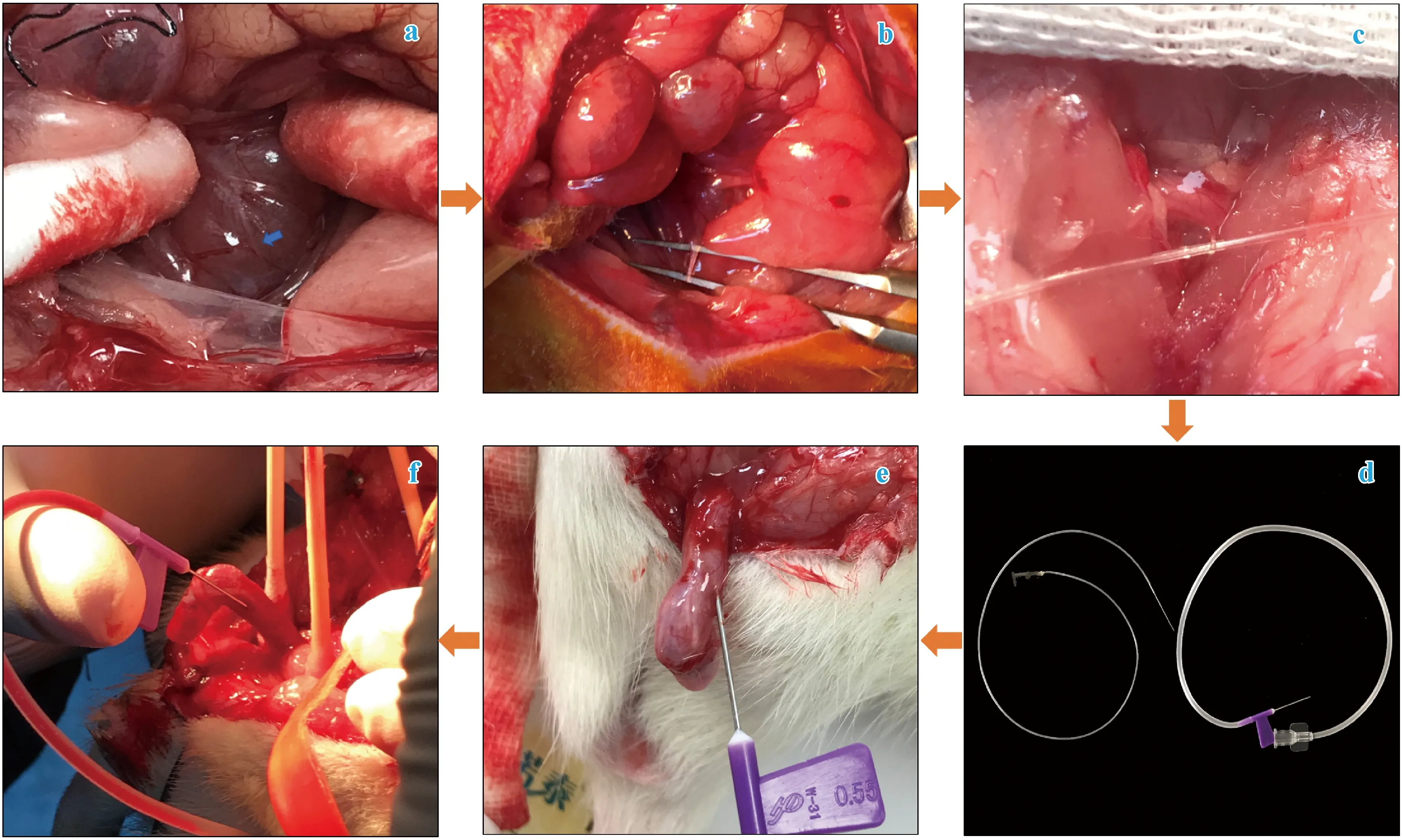
注:a、b:海绵体神经定位;c:PE-10分离海绵体神经;e、f:阴茎海绵体置管。图1 ICP检测流程及海绵体神经解剖位置Note. a, b,Localization of cavernous nerve. c, PE-10 separation of cavernous nerve. e, f, Pin insert into the cavernosum.Figure 1 Operation process of ICP detection and anatomical site of the cavernous nerve
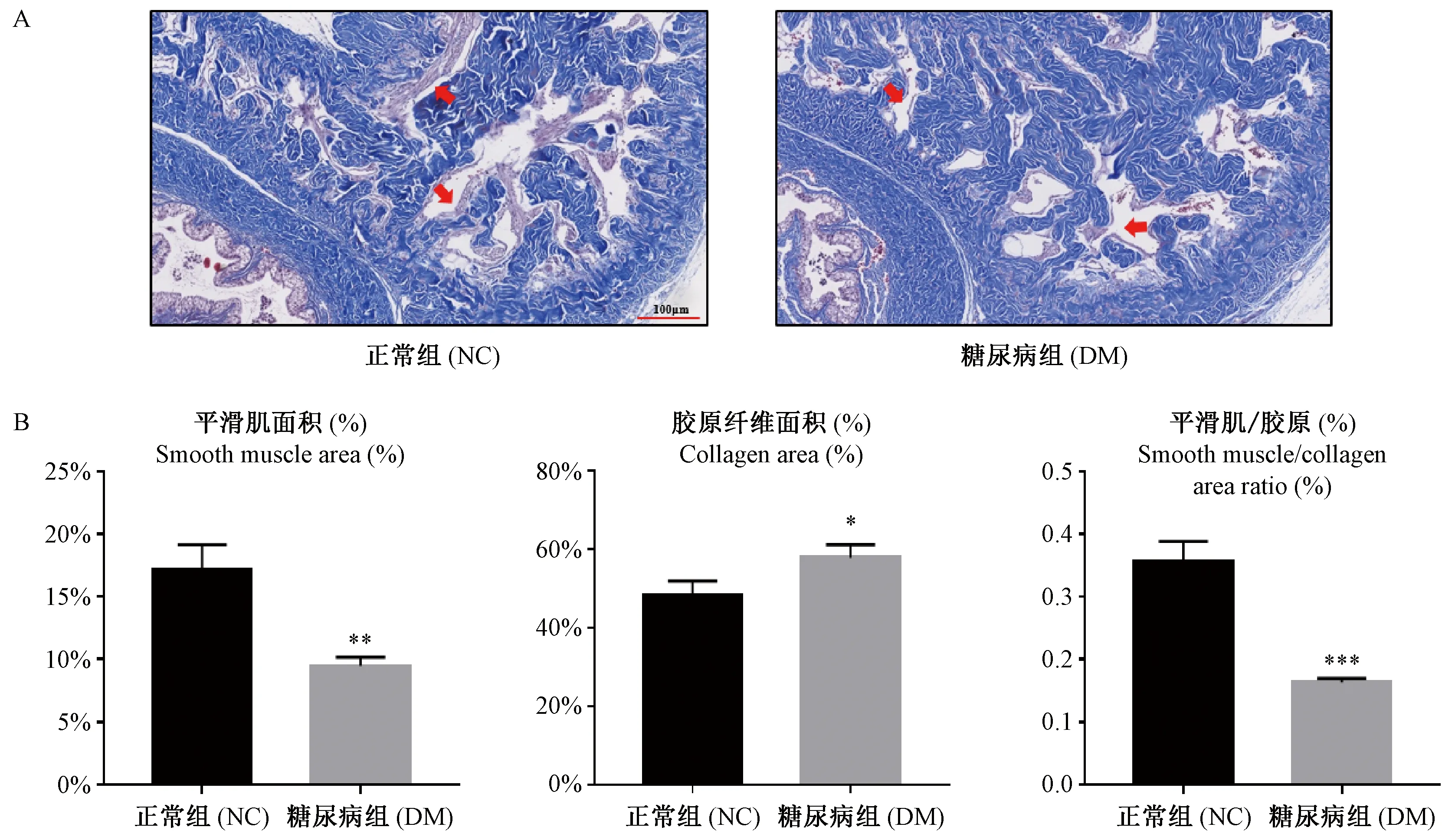
注:红色箭头:平滑肌厚度。与正常组比较,*P< 0.05,**P< 0.01,***P< 0.001。图2 Masson三色染色显示大鼠阴茎海绵体组织中平滑肌和胶原纤维含量(n=5)Note. Red arrow: thickness of smooth muscle. Compared with the normal control group,*P< 0.05,**P< 0.01,***P< 0.001.Figure 2 Smooth muscle and collagen contents in the cavernous tissues of rat penises showed by Masson’s trichrome staining (n=5)
2.2 大鼠阴茎海绵体组织Masson三色染色
DM组与NC组大鼠阴茎海绵体组织Masson三色染色,DM组中海绵窦内平滑肌厚度和含量明显减少(图2A:红色箭头)。此外,DM组中大鼠阴茎海绵体中胶原纤维含量显著增加,纤维密度致密(图2A)。如图2B所示,DM组与NC组比较,平滑肌百分比面积明显减少(P< 0.01),胶原纤维百分比面积增加(P< 0.05),平滑肌与胶原纤维百分比显著减少(P< 0.001)。
2.3 阿扑吗啡实验
对DM组大鼠造模情况使用APO实验进行验证。两组大鼠在注射APO后均出现打哈欠、躁动、骨盆前推、包皮后退和阴茎勃起等生理活动现象。结果显示,DM组大鼠勃起次数与正常对照组相比具有显著差异(P< 0.05)(图3)。
2.4 大鼠阴茎海绵体内压评估勃起功能
NC组与DM组使用海绵体内压插管记录勃起功能相关数据,同NC组相比,DM组大鼠ICP/MAP与曲线下面积(AUC)具有显著统计学差异(P< 0.01),表明大鼠糖尿病模型造模成功,与阿扑吗啡实验结果相一致。正常组大鼠使用PE与VN记录的ICP/MAP与AUC差异无显著性(P=0.1386,P=0.0692)。DM组ED大鼠使用PE与VN记录的ICP/MAP与AUC差异无显著性(P=0.1386,P=0.2121)(图4)。
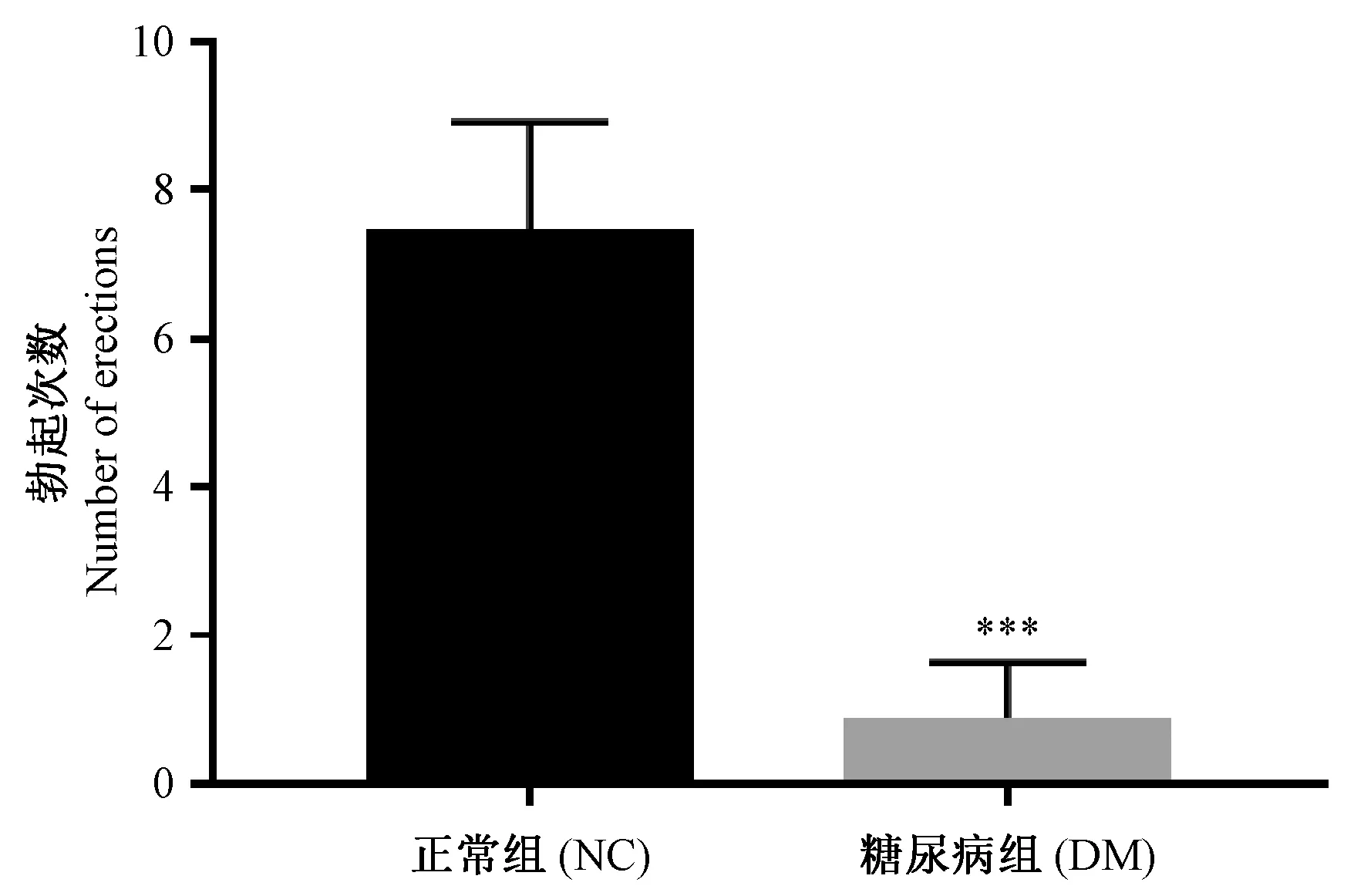
注:与正常组相比,***P< 0.001。.图3 阿扑吗啡实验评估两组大鼠勃起功能(n=8)Note. Compared with the normal control group,***P< 0.001.Figure 3 Apomorphine experiments are performed to evaluate the erectile function in the two groups (n=8)
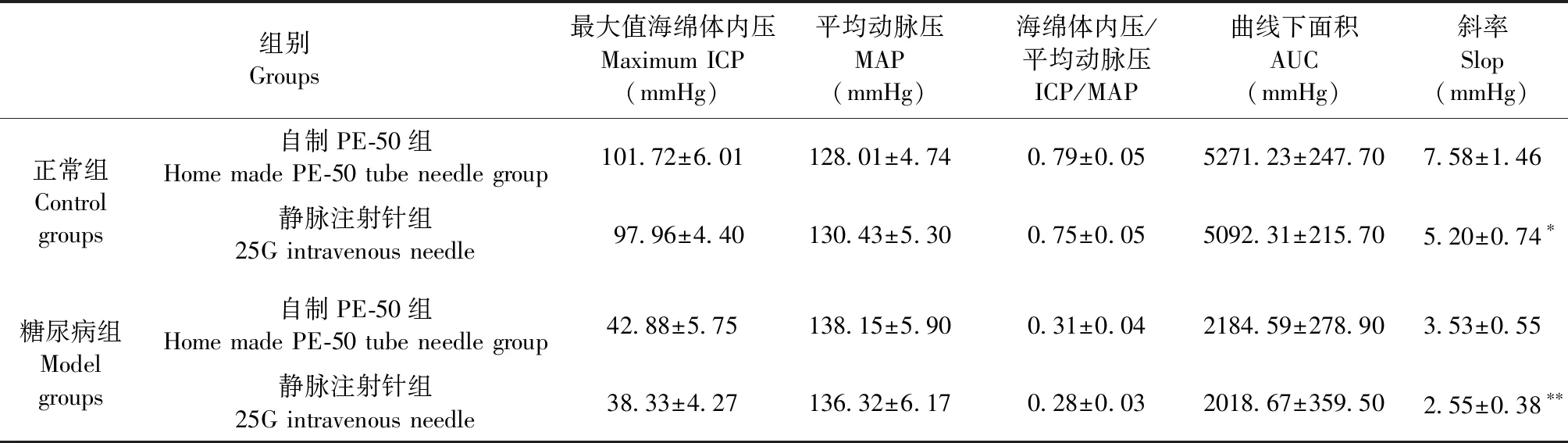
表1 两组大鼠中使用PE-50与VN记录数据比较Table 1 Comparison of PE-50 and VN recorded data in the two groups of rats
注:和相应分组里对照组比较,*P< 0.05,**P< 0.01。
Note.Compared with the control group in the same grouping,*P< 0.05,**P< 0.01.
3 讨论
1863年Eckhardt首次在犬类动物模型中证实了盆神经节支配勃起生理反应,而1968年Lewist等首次对公牛进行阴茎海绵体测压,结合上述的生理功能测试以及动物的生理解剖,继而,更多的学者将实验动物模型转向啮齿类动物[12-14]。主要是由于大鼠勃起生理反应和人类具有许多相似性,并且大鼠饲养及操作性等方面具有显著的优势,20世纪末Quinlan等[14]首次提出了啮齿类动物模型作为研究勃起功能的模型,通过选取适当的频率电刺激CN诱发勃起,途经换能装置处理并记录ICP变化,奠定了大鼠模型作为研究勃起功能动物模型和电刺激CN时记录ICP差异作为评估勃起功能生理指标的实验基础[15-16]。电刺激ICP测定与交配实验、直接性行为观察、生理遥测等测定方法相比,具有压力测定装置低廉、实验结果主观性少且结果可重复等优势[3,8-9]。因此,在一定程度上将电刺激ICP测定视作ED实验研究中的首选评估方案对治疗方法及药物进行评估分析,建立具有可操作性、重复性、客观性的ICP测定实验方法,对于深层次研究治疗勃起功能障碍相关生理药理具有重要意义。
测量ICP时,连接刺入阴茎海绵体针头的材料通常有PE管和VN[9,11]。VN在其持针处具有蝶形捏持处,因此在进行插管时操作的便利性相较于自制PE管具有优势。VN在临床上使用普遍,其获取方便并且价格低廉。而PE管是由高密度聚乙烯构成,在测量血压等生理数据时对血流有良好的抗冲击性,是动物实验中连接压力换能装置的首选材料。本研究比较两种材质对ICP测量数据结果的影响以及实验的便捷性进行初步探讨。勃起功能数据显示使用PE-50管针头与VN针头记录的数据(表1),最大值ICP、ICP/MAP和AUC作为评估勃起功能障碍最常用的指标[17],在NC组及DM组中使用两种材质统计得出数据均无显著统计学差异(P>0.05),而在使用VN在NC组和DM组中测得的起峰斜率指标与PE-50管测得指标具有统计学差异(P< 0.05与P< 0.01)。VN的起峰斜率指标与PE-50管的相比具有差异性,由于材质密度没有PE管材质致密,对于压力的升高存在缓冲作用。因此若将起勃时间作为评估勃起功能障碍的一项指标,应当首选PE-50管针材质的传导材料。
结合实验过程,本课题组对ICP测定过程提出以下建议:①电刺激环节,可由操作者手持双极电刺激钩,轻微提拉暴露充分的CN处于悬空状态1 min,同时记录 ICP数据。②双极电刺激钩刺激时需注意不能触碰到盆腔肌肉,以避免肌肉收缩对ICP的影响。主要是由于电刺激电压与频率过高时会诱发盆底肌肉收缩,而盆底肌肉的收缩会导致勃起反应时最大值ICP的异常增加[17]。若直接放置双极刺激头于刺激部位进行刺激,势必直接触碰并刺激到盆底肌肉进而影响测量结果。③双极电刺激钩刺激神经多次后,电刺激钩顶端会有血凝块包裹刺激钩,需及时对电钩顶端进行清理,保证释放出的电刺激参数不受干扰。④针对阴茎海绵体插管实验不熟练的操作者,建议使用具有握柄的静脉输注针操作测量ICP,能进一步提高置管的成功率。⑤使用眼科镊分离出CN后,采用材质较软的PE-10管进行定位,避免大鼠肌肉意外抽动时崩断CN。
综上所述,基于前面研究者们的ICP检测步骤并结合自己的实验步骤对实验操作过程提出优化,以期为更多从事ED方向研究的研究者提供经验,同时对PE管和VN两种置管材质测量数据比较后,两者均可用于ICP的检测。

