基于Biolog ECO板技术的小麦内生菌多样性研究
何玲敏 蔡新 毛鑫鑫 李楠 马晓杰 张俊辉 吴秋芳 游新勇


摘要 采用Biolog ECO板法研究小麦不同生育期、不同器官的内生菌多样性。结果表明,小麦整个生长周期中,叶部内生菌多样性水平显著高于根、茎部位;扬花期小麦内生菌多样性水平较高,其次是苗期和成熟期;且各组织部位内生菌种群丰度和均一度均较高。该研究了解了小麦各生育期、各器官内生菌的多样性,为小麦内生菌多样性与宿主关系的进一步研究奠定基础,同时为小麦病虫害的生物防治提供材料。
关键词 小麦;内生菌;Biolog ECO;生物多样性
中图分类号 S 182文献标识码 A
文章编号 0517-6611(2019)23-0157-04
doi:10.3969/j.issn.0517-6611.2019.23.045
开放科学(资源服务)标识码(OSID):
Biodiversity Research of Wheat Endophytic Bacteria Based on Biolog ECO Plate Method
HE Ling min,CAI Xin,MAO Xin xin et al (College of Biology and Food Engineering,Anyang Institute of Technology, Anyang,Henan 455000)
Abstract The endophytic bacteria diversity in different growth stages and organs of wheatwas studied using Biolog ECO plate method.The results showed that the diversity of endophytic bacteria in leaves was significantly higher than that in roots and stems during the whole growth phase of wheat.The diversity of endophytic bacteria in wheat was the highest in the flowering stage,followed by that in the seedling stage and mature stage.Moreover,the abundance and uniformity of endophytic bacterial species were all high.This study discussed the diversity of endophytic bacteria in different growth stages and organs of wheat,which laid a foundation for further research on the relationship between endophytic bacteria diversity and the host plant,and provided materials for biological control of wheat diseases and pests.
Key words Wheat;Endophytic bacteria;Biolog ECO;Biodiversity
小麥是我国重要粮食作物之一,其体表和体内寄居着多种微生物。小麦在生长过程中与内生菌形成和谐共生的微生态体系,内生菌次生代谢产物具有抗病、防虫与促生等重要作用[1]。随着植物微生态学的发展,人们更加重视利用微生物进行小麦病害生物防治的研究和应用。
植物内生菌种类多样,普遍存在于各种水生和陆生植物中[2]。目前已在苔藓[3]、藻类[4]、地衣[5]、蕨类[6]以及大量的裸子植物[7]和被子植物[8]中分离到内生菌。在所有植物中尤其以高等植物中的内生菌最为丰富。植物内生菌主要分布于植物的根、茎、叶、叶鞘、花、种子等器官的细胞间隙或组织间隙。不同植物由于受到株龄、种类、基因型、生长地点、生育期、气候条件、周围其他植物类群等条件的影响,其内生菌的数量、种类和分布往往不同,研究证明寄主植物与内生细菌组成和多样性存在密切关联[9-10]。同时,同种农作物内生菌在不同器官的分布有很大差异,而且内生菌在植物体内并不是永远稳定的,它会随着环境变化而改变[11]。在植物不同生长阶段,其内生菌的数量会有所差异。随着植物的不断生长,其组织内部的生理特征、外部表型特征发生改变,导致不同内生细菌种群特征和分布也随之发生变化。
Biolog ECO板是一种包含31种碳源和一个空白对照,共3个平行的96孔板。当微生物利用孔中的碳源进行呼吸代谢时,包含在碳源中的四唑紫染料会发生还原反应,孔的颜色随之发生变化。Biolog ECO板技术操作简便、灵敏度高,且可最大限度地保留微生物群落原有的代谢特征,常用于环境微生物活性和功能多样性的研究[12]。小麦内生菌对小麦生长、发育和抗逆过程起着至关重要的作用,且在植物病害生物防治中具有重要地位[13]。因此,研究小麦不同生育期、不同器官的内生菌多样性,可为小麦内生菌多样性与宿主关系的进一步研究奠定基础,同时为小麦病虫害的生物防治提供材料。
1材料与方法
1.1 材料
1.1.1 小麦品种。供试小麦品种为安阳工学院培育的AG1218。
1.1.2 培养基及组成。
内生细菌分离培养基为胰蛋白胨大豆琼脂(TSA);配方:胰蛋白胨 15.0 g/L,大豆蛋白胨 5.0 g/L,氯化钠 5.0 g/L,琼脂 15.0 g/L,pH 7.3。
内生真菌分离培养基为马铃薯葡萄糖琼脂(PDA);配方:马铃薯浸粉 3.0 g/L,葡萄糖 20.0 g/L,琼脂 14.0 g/L,pH 5.6。
1.1.3 试剂。75%乙醇,95%乙醇,0.1%升汞,次氯酸钠(有效氯3.0%)。
1.2 方法
1.2.1 小麦样品采集及处理。
分别在小麦苗期、扬花期、成熟期,采用5点取样法,每点取10株。采集样本时将小麦植株连根拔起(保持根部完整)轻轻抖落根部的大块土壤后装入无菌自封袋,并做好标记,放入冰盒冷藏。带回实验室后立即处理,或置于-80 ℃冰箱保藏备用。
1.2.2 小麦植株体表最适消毒方法的建立。
消毒方法1:材料在75%乙醇中浸泡l min后,用无菌水冲洗3次,然后用次氯酸钠浸泡(各部位时间不同:根50 s~4 min,茎50 s~3 min,叶50 s~3 min,籽粒3~5 min),再用75%乙醇浸泡30 s,之后用无菌水清洗3次,用无菌滤纸吸干表面水分[14]。
消毒方法2:将材料浸入95%乙醇溶液中30 s,再转入消毒剂(95%乙醇∶次氯酸钠溶液=1∶1)中浸泡10 min取出,无菌水冲洗3次[15]。
消毒方法3:称取小麦根、茎、叶、籽粒各1.5 g(鲜重),用自来水冲洗干净,75%乙醇表面消毒30 s后,再用0.1%升汞进行表面消毒(根部6~8 min,茎4~5 min,叶2~3 min),无菌水冲洗5~6次后晾干[16]。
1.2.2.1 小麦内生菌菌悬液的制备。
取2 g表面消毒后的小麦样本,转入盛有5 mL无菌水的灭菌研钵中,充分研磨,静置5 min,上清液即为小麦内生菌混合菌悬液。
1.2.2.2 小麦内生菌的分离和培养。
取上述菌悬液1 mL,梯度稀释10-1~10-6,取100 μL不同浓度梯度的稀释液分别涂布于TSA平板(分离细菌)和PDA平板(分离真菌)上,每处理重复5次,倒置于28 ℃恒温箱中培养,3 d后进行菌落观察,并统计菌落数量和形态。
1.2.2.3 小麦体表消毒效果检验。
将消毒后的组织置于5 mL无菌水中振荡1 min,取100 μL悬浮液涂布于分离培养基上,倒置于28 ℃恒温箱中培养3 d,记录是否有菌落生长。
1.2.3 Biolog ECO板法测定小麦内生菌多样性。
当微生物利用孔中的碳源进行呼吸代谢时,孔的颜色随之发生变化。微生物的整体活性用每孔颜色平均变化率(average well color development,AWCD)来描述,碳源利用程度越大,AWCD值越大。用McIntosh指数、Shannon指数和Simpson指数对小麦各生长期、各组织部位内生菌的功能多样性、种群丰度和均匀度进行评估。McIntosh指数、Shannon指数和Simpson指数的具体描述及计算公式见表1。
取10-3稀释液接种至Biolog ECO板上,每孔接种量为150 μL。将生态板于25 ℃恒温培养7 d,期间每隔24 h用Biolog自动读板仪在590 nm下读取OD值,根据表1中的公式计算各指数。由AWCD值、McIntosh指数、Shannon指数和Simpson指数共同评估不同生长期、不同组织部位小麦内生菌的群落多样性。
2 结果与分析
2.1 小麦植株体表最适消毒方法
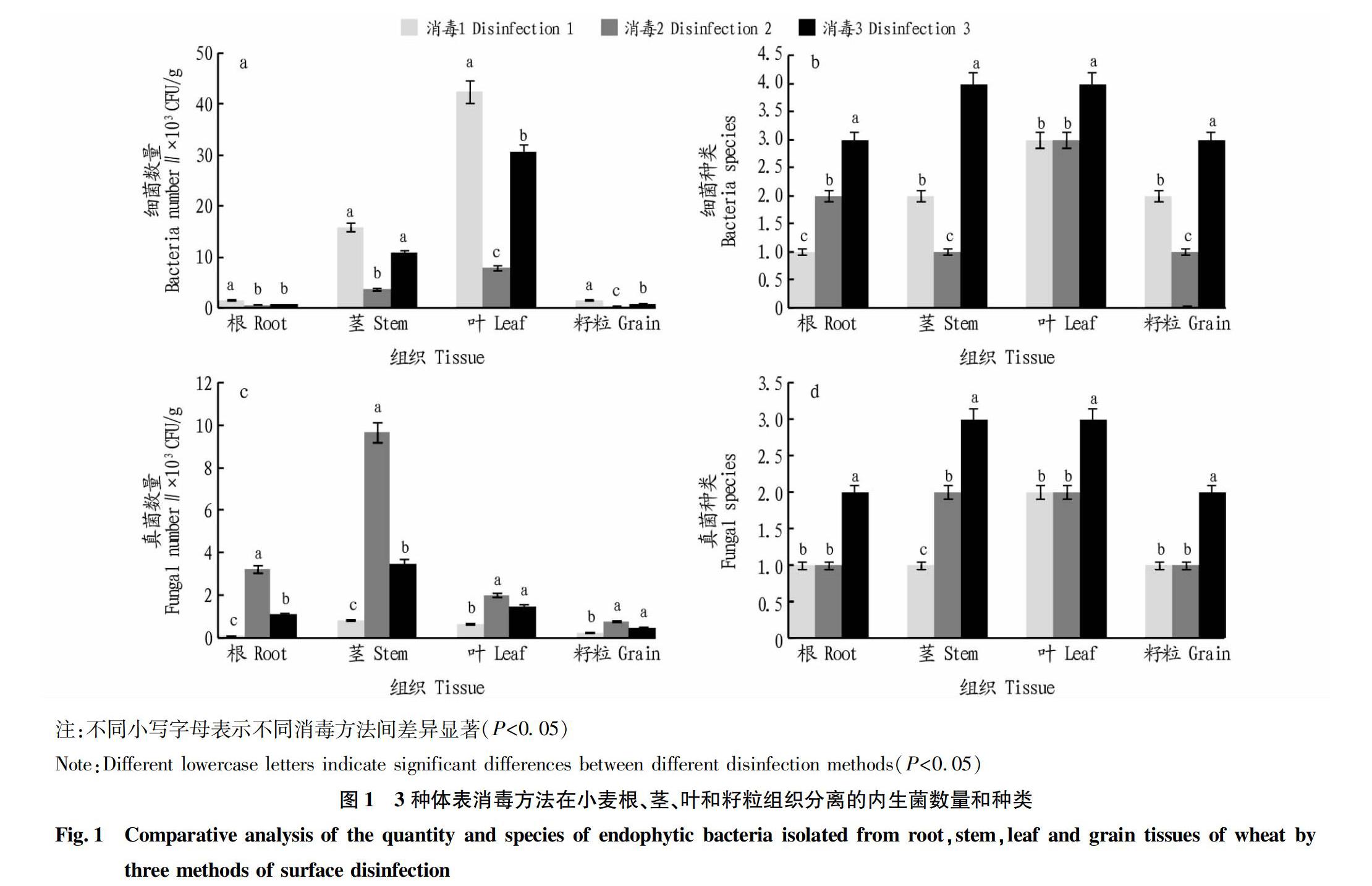
通过对常用的3种小麦组织表面消毒方法进行比较,筛选出小麦根、茎、叶、籽粒组织部位的最适表面消毒方法。用IBM SPSS Statistics 20.0软件对平板菌落数量及种类进行多重比较分析(Tukey检验法,P<0.05)。
由图1a和1c可知,无论是小麦根、茎、叶部位还是籽粒部位,采用消毒方法3消毒小麦植株体表,平板涂布法分离得到的小麦内生细菌和内生真菌的数量均介于消毒方法1和消毒方法2之间。消毒方法1分离得到的内生细菌数量最多,而消毒方法2筛选得到的内生真菌数量最多。
由图1b和1d可知,小麦根、茎、叶、籽粒组织,采用消毒方法3分离得到的细菌种类和真菌种类均显著高于消毒方法1和消毒方法2。
综上所述,消毒方法3的消毒能力和作用时间分离得到的小麦内生细菌和内生真菌的数量和种类均较优。因此,采用消毒方法3对小麦体表进行消毒,从而准确评估小麦各生长期、各器官内生菌的多样性。
2.2 小麦内生菌多样性评估
利用Biolog全自动微生物鉴定仪测定小麦各生长期、各器官内生菌的多样性。由图2可知,小麦整个生长周期中,叶部内生菌的多样性水平远高于根、茎部位,而根、茎部位内生菌多样性水平较接近且变化幅度较小;而扬花期叶部内生菌多样性水平较高,其次是苗期和成熟期。
用McIntosh指数、Shannon指數和Simpson指数对小麦各生长期、各器官内生菌的功能多样性、种群丰度和均匀度进行评估。由图3可知,小麦各生长期叶部的McIntosh指数和Shannon指数均显著高于根部和茎部,而根、茎、叶和籽粒部位的McIntosh指数、Shannon指数和Simpson指数差异不大。由此可知,在小麦整个生长周期中,叶部内生菌多样性水平最高,且各组织部位内生菌种群丰度和均一度均较高。
3 结论与讨论
在小麦内生菌分离过程中,表面消毒方法很关键。植株表面消毒方法不当,可能混入部分体表菌,导致内生菌的数量或种类偏多;或使部分内生菌被杀死,导致内生菌的数量或种类偏少。因此,使用合适的表面消毒方法对保证小麦内生菌的分离效果非常必要[17]。该研究对小麦体表消毒方法进行了筛选,得到最适的小麦体表消毒方法:称取小麦根、茎、叶、籽粒各1.5 g(鲜重),用自来水冲洗干净,75%乙醇表面消毒30 s后,0.1%升汞消毒(根部6~8 min,茎4~5 min,叶2~3 min),无菌水冲洗5~6次后晾干,然后进行组织研磨、平板涂布。整个消毒过程均在无菌操作台中进行。
随着小麦的不断生长,其组织内部的生理特征、外部表型特征、环境变化等,导致不同内生菌种群特征和分布也随之发生变化。该研究采用Biolog ECO板技术评估小麦品种AG1218的内生菌多样性,结果表明,在小麦整个生长周期中,叶部内生菌多样性水平显著高于根、茎部位,而根、茎部位内生菌多样性水平较接近且变化幅度较小;扬花期小麦内生菌多样性水平较高,其次是苗期和成熟期;且各组织部位内生菌种群丰度和均一度均较高。该研究结果与前人相关研究结果一致[13-14,16]。
小麦抽穗扬花期是小麦由营养生长完全转化为生殖生长的标志,也是决定麦穗籽粒多少的关键期。该阶段是小麦需水、肥的高峰期,水肥供应充足,小麦内生菌也会快速增殖,故在小麦扬花期时内生菌多样性水平较高。小麦扬花期叶片部位存在大量的内生菌,这可能与叶片光合作用有关。
同时,在对小麦品种AG1218内生菌多样性研究中,还筛选到几株对小麦赤霉病菌有较强拮抗作用的内生菌。下一步将对这些拮抗菌株的生防能力及对小麦赤霉病的生防效果进行研究,深入探讨拮抗菌对小麦赤霉病的生物防治机理,旨在为小麦赤霉病的生物防治提供候选菌株。
参考文献
[1] 赵芹,邓渊钰,李伟,等.小麦幼苗内生菌多样性的宏基因组分析[J].植物病理学报,2017,47(3):313-324.
[2] 邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.
[3] 张鑫.苔藓内生菌的分离、鉴定及其代谢产物作用研究[D].济南:山东轻工业学院,2012:65.
[4] LIGRONE R,POCOCK K,DUCKETT J G.A comparative ultrastructural study of endophytic basidiomycetes in the parasitic achlorophyllous hepatic Cryptothallus mirabilis and the closely allied photosynthetic species Aneura pinguis (Metzgeriales)[J].Canadian journal of botany,1993,71(5):666-679.
[5] 葛慈斌,刘波,车建美,等.武夷山地衣表生和内生芽孢杆菌种群的多样性[J].微生物学报,2015,55(5):551-563.
[6] SATI S C,BELWAL M.Aquatic hyphomycetes as endophytes of riparian plant roots[J].Mycologia,2005,97(1):45-49.
[7] 马长乐,黄晓霞,艾星梅,等.云南榧内生菌的分离及抗植物病原菌活性筛选[J].西部林业科学,2014,43(4):10-14.
[8] GAGN S,RICHARD C,ROUSSEAU H,et al.Xylem-residing bacteria in alfalfa roots[J].Canadian journal of microbiology,1987,33(11):996-1000.
[9] MCINROY J A,KLOEPPER J W.Studies on indigenous endophytic bacteria of sweet corn and cotton[M]//OGARA F,DOWLING D N,BOESTE B.Molecular ecology of rhizosphere microorganisms:Biotechnology and the release of GMOs.New York:VCH,2007.
[10] GERMIDA J,SICILIANO S.Taxonomic diversity of bacteria associated with the roots of modern,recent and ancient wheat cultivars[J].Biology and fertility of soils,2001,33(5):410-415.
[11] 王瑶瑶,韩烈保,曾会明.禾本科植物内生菌研究进展[J].生物技术通報,2008(3):33-38.
[12] 秦华,林先贵,陈瑞蕊,等.DEHP对土壤脱氢酶活性及微生物功能多样性的影响[J].土壤学报,2005,42(5):829-834.
[13] 乔宏萍,黄丽丽,康振生.小麦内生细菌及其对根茎部主要病原真菌的抑制作用[J].应用生态学报,2006,17(4):690-694.
[14] 苗文莉.小麦内生真菌多样性及其与宿主关系研究[D].郑州:郑州大学,2011:58.
[15] 刘丽.小麦内生菌的分离与鉴定[J].沈阳师范大学学报(自然科学版),1998,16(4):41-46.
[16] 庞发虎.小麦内生细菌的种群多样性调查及其在小麦条锈病生物防治中的利用研究[D].南宁:广西大学,2016:161.
[17] 何佳,刘笑洁,赵启美,等.植物内生真菌分离方法的研究[J].食品科学,2009,30(15):180-183.

