昆仙胶囊对IgA肾病大鼠的肾保护作用及系膜细胞增殖的影响
曾佳丽 姜雪 余瑾


[摘要] 目的 本實验通过建立IgA肾病大鼠模型及大鼠肾小球系膜细胞体外实验,进行药物干预,探讨昆仙胶囊的肾保护作用和对系膜细胞增殖的影响。 方法 48只雌性SD大鼠随机均分为正常组、IgAN模型组、缬沙坦组、昆仙胶囊组,每组12只,造模第5周开始灌胃给药,分别于第10周、16周每组每次随机挑选6只大鼠,检测24 h尿蛋白定量、血肌酐、尿素氮,观察大鼠肾脏IgA免疫荧光和病理学改变。同时,选择IgA1刺激大鼠系膜细胞,将系膜细胞分为正常组、模型组、缬沙坦高低剂量组和昆仙胶囊高中低剂量组,CCK8检测药物干预后细胞增殖及抑制情况。 结果 第10周、16周昆仙胶囊组IgAN大鼠24 h尿蛋白定量、肾功能指标较模型组有显著性差异(P<0.05),与缬沙坦组比较无明显统计学差异(P>0.05)。同时肾组织病理均提示昆仙胶囊组病变程度较模型组轻。细胞实验提示经IgA1刺激后可引起系膜细胞增殖,药物干预后昆仙胶囊能够明显抑制IgA1诱导的大鼠系膜细胞增殖。 结论 本实验说明昆仙胶囊能减少IgAN大鼠尿蛋白,延缓肾功能进展,减缓肾组织病理改变,其机制可能是通过抑制系膜细胞增殖而达到的。
[关键词] 昆仙胶囊;IgA肾病;肾功能;肾小球系膜细胞
[中图分类号] R691.3 [文献标识码] A [文章编号] 1673-9701(2019)31-0038-05
Renal protection effect of kunxian capsule on rat with IgA nephropathy and its influence on mesangial cell proliferation
ZENG Jiali JIANG Xue YU Jin TANG Xuanli LIN Xing GE Shanshan CHEN Hongyu
Guangxing Hospital Affiliated to Zhejiang University of Traditional Chinese Mechicine, Hangzhou Hospital of Traditional Chinese Medicine, Hangzhou 310007, China
[Abstract] Objective To investigate the renal protection effect of kunxian capsule on rats with IgA nephropathy and its influence on mesangial cell proliferation through establishing a rat model of IgA nephropathy and rat mesangial cells in vitro experiment for drug intervention. Methods Forty-eight female SD rats were randomLy divided into the normal group, IgAN model group, valsartan group and kunxian capsule group, with 12 rats in each group. The drugs were intragastrically administered from week 5 of modeling. Six rats were selected from each group and each time in week 10 and week 16 to detect the 24 hour urine protein quantitation, serum creatinine and urea nitrogen and observe the IgA immunofluorescence and pathological changes of rat kidney. Meanwhile, IgA1 was selected to stimulate rat mesangial cells, and the mesangial cells were divided into the normal group, model group, valsartan high-low dose group and Kunxian capsule high-medium-low dose group. CCK8 was used to detect the cell proliferation and inhibition after drug intervention. Results In week 10 and week 16, there were significant differences in the 24 hour urine protein quantitation and renal function indicators between the kunxian capsule group and the model group(P<0.05), but there was no statistically significant difference between the kunxxia capsule group and the valsartan group(P>0.05). At the same time, it was suggested by renal tissue pathology that the degree of lesions in the kunxian capsule group was lower than that in the model group. It was suggested by cellular experiment that mesangial cell proliferation could be induced by IgA1 stimulation and kunxian capsule could significantly inhibit IgA1-induced proliferation of rat mesangial cells. Conclusion This experiment demonstrates that kunxian capsule can reduce the urine protein of IgAN rats, delay the progression of renal function and slow down the pathological changes of renal tissues. The mechanism may be achieved by inhibiting the proliferation of mesangial cells.
[Key words] Kunxian capsule; IgA nephropathy; Renal function; Mesangial cells
IgA肾病(IgA nephropathy,IgAN)是免疫复合物性肾炎,临床表现为蛋白尿、血尿和肾功能恶化等,其主要病理机制是多聚IgA1分子(pIgA1)及其免疫复合物在肾小球系膜区沉积,引起肾小球系膜细胞(glomerular mesangial cells,GMCs)增生、扩张,系膜基质增加[1-3]。GMCs是肾小球中最活跃的固有细胞成分,是多种细胞因子作用的靶点[4],持续的免疫复合物沉积、GMCs活化及过多的细胞外基质沉积,引起GMCs增殖过度,健存肾单位进行性减少,导致渐进性的肾小球硬化和不可逆的肾功能受损。因此,抑制GMCs增殖对于减轻IgAN肾小球硬化、延缓疾病进展具有十分重要的意义。昆仙胶囊具有祛风湿益肾的功效,本研究拟通过动物及细胞实验证实,其对IgA肾病有肾保护作用,机制可能是通过抑制系膜细胞增生达到。
1 材料与方法
1.1 动物及细胞
清洁级SD雌性大鼠48只,体重180~220 g,由上海西普尔必凯实验动物有限公司提供,生产许可证号:SCXK(沪)2013-0016;饲养于浙江中医药大学动物实验研究中心,动物实验条件合格证:SYXK(浙)2013-0184;大鼠肾小球系膜细胞(以下简称GMCs)细胞株由北京协和医院提供。
1.2 药物与试剂
昆仙胶囊,规格0.3 g/胶囊(广州陈李济药厂,国药准字Z20060267)。雷公藤甲素(HPLC≥98%),淫羊藿苷(HPLC≥98%),购自中国药品生物制品检定所。缬沙坦胶囊(代文,北京诺华制药,国药准字H2004 0217,规格80 mg/片)。缬沙坦原药由北京诺华制药有限公司提供。牛血清白蛋白(BSA)(Amresco公司);脂多糖(LPS,Sigma公司);异硫氰酸荧光素(FITC)标记的兔抗鼠IgA抗体(LSBio公司);IgA1(Sigma公司);Cell Counting Kit-8试剂(Dojindo Laboratorie公司)。
1.3 动物造模及给药
48只雌性SD大鼠适应性喂养1周后,随机分为四组,即正常组、IgAN模型组、缬沙坦组、昆仙胶囊组。采用免疫诱导联合继发病变造模[5-6]:牛血清白蛋白(BSA)600 mg/kg隔日灌胃共10周+每周1次皮下注射四氯化碳(CCl4)0.1 mL混合蓖麻油0.3 mL共10周+第6周尾静脉注射脂多糖(LPS)0.05 mg/只1次。正常组均以等体积生理盐水替代进行灌胃、尾静脉注射及皮下注射。造模第5周开始灌胃给药,药物剂量按照体表面积公式推算,昆仙胶囊用量为450 mg/(kg·d),缬沙坦组用量为16.8 mg/(kg·d),模型组和正常组按等体积蒸馏水灌胃。饲养期间提供标准普通饲料,自由摄食摄水。
1.4 实验动物检测指标
分别于第10周、第16周,每组每次随机选取6只大鼠收集24 h尿液,测定24 h尿蛋白定量;腹主动脉采血,测定血肌酐、血尿素氮。取约1 mm×1 mm×1 mm大鼠肾皮质组织进行冰冻切片,2%牛血清白蛋白封闭,稀释(1∶75)荧光标记IgA抗体滴于组织表面,孵育,冲洗,荧光显微镜下观察大鼠肾小球系膜区IgA抗体荧光显色情况,采用国际通用5级半定量法评价IgA沉积强度:低倍镜下不能显示、高倍镜下似乎可见为(-);低倍镜下似乎可见、高倍镜下可见为(+);低倍镜下可见,高倍镜下清晰可见为(++);高倍镜下耀眼为(+++);高倍镜下刺眼为(++++)。取3 mm×3 mm×2 mm肾皮质置于10%福尔马林固定液中固定;依次脱水、浸蜡、冷却、切片、烘片、脱蜡、苏木素染色、1%盐酸酒精、1%碳酸锂、1%伊红液染色、脱水、烘干、中性树胶封片,光镜下观察肾脏HE染色病理变化。取约1 mm×1 mm×1 mm的肾皮质组织,经2.5%戊二醛固定、1%锇酸后固定、脱水、环氧树脂618包埋,超薄切片后醋酸铀-柠檬酸铅染色,透射电镜下观察肾组织微观结构改变。
1.5 大鼠系膜细胞培养及给药
大鼠GMCs用含10%胎牛血清及1%青链霉素的MEM/EBSS培养液培养,在37℃、5% CO2及饱和湿度的条件下生长传代。将IgA1解冻并稀释浓度为100 μL/mL最佳。采用高效液相进行昆仙胶囊中雷公藤甲素及淫羊藿苷含量测定,制成浓度为(10 μg雷公藤甲素+4.6 mg淫羊藿苷)/mL的昆仙胶囊含药培养液,以雷公藤甲素浓度为标准,稀释不同浓度的昆仙胶囊含药培养液。配制缬沙坦浓度为1 mg/mL的液体,稀释相应浓度用于细胞给药。取对数生长期的大鼠GMCs,接种到96孔培养板上(共4个,作3 h、6 h、12 h和24 h检测)培养。后换无血清培养液培养24 h使细胞同步生长,弃上清,分为五组(正常组为完全培养液,余4组分别为IgA浓度25、50、75、100 μL/mL的培养液)。每组设8个复孔,各组分别给药处理3 h、6 h、12 h和24 h后,弃上清,加入培养液和CCK-8试剂(1:10稀释),37℃避光孵育1.5 h,450 nm检测吸光度OD值,计算细胞增殖率,得出最佳增殖时间点为24 h。
1.6 大鼠系膜细胞增殖的测定
取对数生长期的大鼠GMCs,接种到96孔培养板上培养24 h,换无血清培养液培养24 h使细胞同步生长。实验分组:①正常组:完全培养液;②模型组:正常组+mIgA1(浓度100 μL/mL);③缬沙坦低剂量组:模型组+10-7 mg/mL的缬沙坦培养液;④缬沙坦高剂量组:模型组+10-5 mg/mL的缬沙坦培養液;⑤昆仙胶囊低剂量组:模型组+雷公藤甲素浓度为0.04 μg/mL的昆仙胶囊培养液;⑥昆仙胶囊中剂量组:模型组+雷公藤甲素浓度为0.06 μg/mL的昆仙胶囊培养液;⑦昆仙胶囊高剂量组:模型组+雷公藤甲素浓度为0.08 μg/mL的昆仙胶囊培养液。按不同分组加入受试品进行药物干预,每组设7个复孔,各组分别药物干预12 h、24 h、36 h后,根据CCK-8测定细胞增殖率。
1.7 统计学方法
采用SPSS20.0统计软件进行分析,各组计量资料以(x±s)表示,同组检验采用t检验,多组组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠第10周、第16周24 h尿蛋白定量水平比较
第10周,模型组24 h尿蛋白定量高于其余三组(P<0.05);缬沙坦组和昆仙胶囊组无明显差异(P>0.05),但均高于正常组(P<0.05)。第16周,模型组高于其余三组(P<0.05);缬沙坦组与昆仙胶囊组无明显统计学差异(P>0.05)。缬沙坦组和昆仙胶囊组第16周尿蛋白定量均较第10周降低(P<0.05)。见表1。
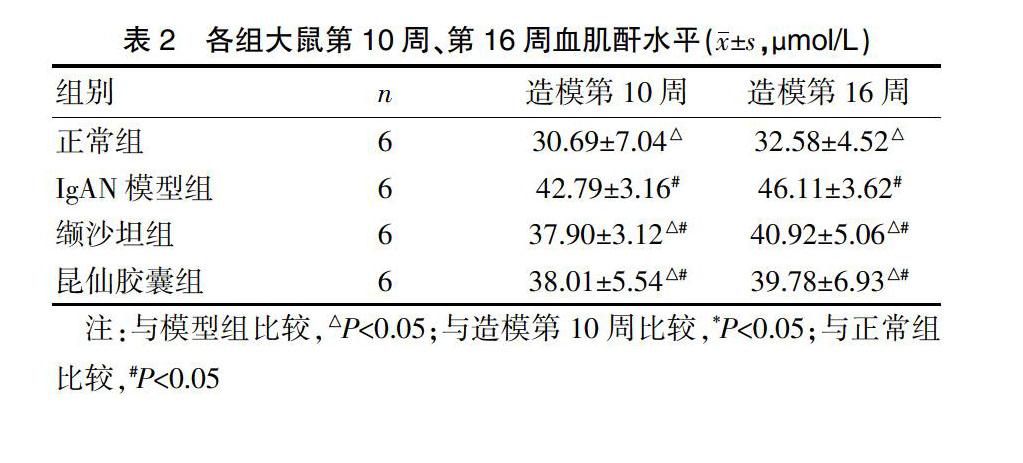
2.2 各组大鼠第10周、第16周血肌酐水平比较
第10周和16周,模型组血肌酐高于其余三组(P<0.05);缬沙坦组和昆仙胶囊组无明显差异(P>0.05),但均高于正常组(P<0.05)。模型组第16周与第10周血肌酐比较有所上升(P<0.05),缬沙坦组和昆仙胶囊组第16周与第10周血肌酐比较,差异无统计学意义(P>0.05)。见表2。
2.3 各组大鼠第10周、第16周血尿素氮水平比较
第10周和16周,模型组血尿素氮高于其余三组(P<0.05);缬沙坦组和昆仙胶囊组血尿素氮第16周与第10周比较虽无明显统计学差异(P>0.05),但有略微下降趋势,两组间血尿素氮水平无统计学差异(P>0.05)。见表3。
2.4 大鼠肾脏病理改变
2.4.1 免疫荧光IgA沉积情况 第10周正常组大鼠肾小球系膜区无明显IgA免疫复合物沉积;其余各组大鼠均可见到绿色IgA荧光免疫复合物在肾小球系膜区呈团块状或颗粒状沉积,模型组荧光强度为++~++++,药物干预组荧光强度为++~+++。见封三图1。
2.4.2 HE染色病理形态学改变 观察第16周各组大鼠肾皮质组织标本,可见正常组大鼠肾小球结构清晰,系膜细胞及基质未见明显增生,未见肾小球细胞性或纤维性新月体形成,未见硬化肾小球;模型组均可见肾小球系膜细胞和基质轻重不等的弥漫性增生,局灶性系膜细胞增生、硬化,伴肾小管灶状萎缩,肾间质灶状淋巴细胞和单核细胞浸润,伴或不伴有纤维化。缬沙坦组和昆仙胶囊组肾小球系膜细胞和基质弥漫性增生情况较模型组轻,缬沙坦组与昆仙胶囊组之间病变情况未见明显差异。见封三图2。
2.4.3 电镜下病理形态学改变 观察第16周电镜下各组大鼠肾脏病变情况,正常组无肾小球系膜细胞、基质增生及电子致密物沉积,足突细胞形态正常,排列整齐有序。模型组可见肾小球系膜细胞增生,基质明显增多,伴有大量电子致密物沉积及部分足突融合。缬沙坦组和昆仙胶囊组系膜细胞增生、基质增多及电子致密物沉积较模型组相对较少,缬沙坦组与昆仙胶囊组之间未见明显差异。见封三图3。
2.5 大鼠肾小球系膜细胞增殖抑制情况
经IgA1诱导增生后大鼠GMCs增殖明显,24 h时模型组增殖水平与其他各组存在显著性差异(P<0.05)。昆仙胶囊及缬沙坦对IgA1诱导的GMCs增殖具有明显的抑制作用,且呈剂量依赖关系,其中昆仙胶囊中高剂量组优于缬沙坦高、低剂量组(P<0.05)。36 h时昆仙胶囊各浓度组及缬沙坦高剂量组细胞增殖水平明显低于模型组(P<0.05),昆仙各剂量组细胞增殖水平均明显低于正常组(P<0.01),说明给药36 h时间过长,对系膜细胞增殖的抑制作用太過。见表4、5。
3 讨论
IgA肾病是我国最常见的原发性肾小球疾病,约占原发性肾小球肾炎的43.5%~54.3%,是导致终末期肾脏病的主要原因之一。目前认为[10-12],遗传、环境和免疫因素共同决定了IgA肾病的发病,发病的始动因素可能是IgA1分子糖基化异常,造成IgA1易自身聚集或被IgG或IgA识别形成免疫复合物,与系膜细胞结合沉积,进而触发炎症反应,使肾小球细胞增生,肾小球硬化、小管萎缩和间质纤维化。目前,IgA肾病常见治疗方案有激素、免疫抑制剂、血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)等[13]。本实验采用临床运用广泛的ARB类药物缬沙坦胶囊作为药物阳性对照用药。中成药昆仙胶囊由昆明山海棠、淫羊藿、枸杞子和菟丝子四药配伍制成,祛风除湿、补肾通络。其中君药昆明山海棠是卫矛科雷公藤属,具有祛风除湿、舒筋活络、清热解毒功效,主要成分雷公藤甲素具有免疫抑制与抗炎作用;臣药淫羊藿祛风湿、补肾强精,所含的淫羊藿苷具保护生殖和骨骼系统及类激素样作用;菟丝子、枸杞子为佐使,菟丝子的主要成分黄酮具调节免疫、保肝及类激素样作用,枸杞子所含的甜菜碱能调节免疫、保肝、提高生殖能力,二者与淫羊藿共同发挥补肾养血,强精健骨功效,并能减少昆明山海棠的对肝肾及性腺的毒副作用,达到增效减毒的效果[14]。临床上昆仙胶囊主要用于治疗类风湿性关节炎、强直性脊柱炎等免疫相关性疾病[15-16]。亦有研究表明[17-19],昆仙胶囊能降低狼疮性肾炎、肾病综合征、慢性肾脏病患者的24 h尿蛋白定量,且无明显肝肾功能损害。动物实验显示[20],昆仙胶囊可降低阳离子化牛血清白蛋白诱导的大鼠原位免疫复合物模型的24 h尿蛋白定量,改善肾小球病理损害,其机制可能与昆仙胶囊降低免疫复合物在基底膜沉积有关。
本实验IgA肾病大鼠造模模型采用免疫诱导联合继发病变型,应用大分子物质BSA作为免疫原,激发机体免疫反应,CCL4皮下注射减低肝脏清除能力,使血液中的IgA聚集形成免疫复合物,在肾小球系膜区沉积,并注射免疫佐剂LPS增强免疫原性[5-6]。此造模方法安全性高,实验过程中无实验大鼠死亡,免疫荧光可见肾小球系膜区较强的IgA免疫复合物沉积,实验第10周检测24 h尿蛋白定量、血肌酐、血尿素氮方面,模型组均较正常组有显著性差异,提示IgA肾病大鼠造模成功。第16周病理HE染色和电镜均提示昆仙胶囊组肾小球系膜细胞和基质弥漫性增生及免疫复合物沉积情况较模型组轻。同时,细胞实验提示大鼠GMCs经血清IgA1刺激24 h后出现了明显的细胞增殖,而昆仙胶囊组及缬沙坦组对IgA1诱导的大鼠GMCs增殖具有明显的抑制作用,与模型组比较有明显的统计学意义,且呈一定的剂量依赖关系,其中昆仙中高剂量组抑制作用优于缬沙坦组。
综上所述,本实验结果提示昆仙胶囊在保护IgA肾病模型大鼠肾功能、减少24 h蛋白尿、减缓肾脏病理病变速度方面具有一定作用,其作用机制可能是通过抑制肾小球系膜细胞增殖而达到的。
[参考文献]
[1] Lai KN.Pathogenesis of IgA nephropathy[J].Nat Rev Ne-phrol,2012,8(5):275-283.
[2] Moura IC,Benhamou M,Launay P,et al.The glomerular response to IgA deposition in IgA nephropathy[J]. Semin Nephrol,2008,28(1):88-95.
[3] Suzuki H,Kiryluk K,Novak J,et al. The pathophysiology of IgA nephropathy[J].J Am Soc Nephrol,2011,22(10):1795-1803.
[4] Scindia YM,Deshmukh US,Bagavant H. Mesangial pathology in glomerular disease:Targets for therapeutic intervention[J].Adv Drug Deliv Rev,2010,62(14):337-343.
[5] 陸慧瑜,张巧玲,蒋小云,等.IgA肾病大鼠模型的建立[J].中国误诊学杂志,2011,11(6):1264-1267.
[6] 张静,李静,桑晓红,等.运用两种BSA剂量建立IgA肾病大鼠模型观察[J].中国中西医结合肾病杂志,2013, 14(1):13-16.
[7] Yu XQ,Wei JL.Kidney disease in China:Recent progress and prospects[J].Chin Med J (Engl),2009,122(17):2048-2053.
[8] Strippoli GF,Maione A,Schena FP,et al.IgA nephropathy:A disease in search of a large-scale clinical trial to reliably inform practice[J]. Am J Kidney Dis,2009,53(1):5-8.
[9] Zhou FD,Zhao MH,Zou WZ,et al.The changing spectrum of primary glomerular diseases within 15 years:A survey of 3331 patients in a single Chinese centre[J]. Nephrol Dial Transplant,2009,24(3):870-876.
[10] Floege J.The pathogenesis of IgA nephropathy:What is new and how does it change therapeutic approaches?[J].Am J Kidney Dis,2011,58(6):992-1004.
[11] Coppo R,Amore A,Peruzzi L,et al.Innate immunity and IgA nephropathy[J].J Nephrol,2010,23(6):626-632.
[12] Kiryluk K,Novak J.The genetics and immunobiology of IgA nephropathy[J].J Clin Invest,2014,124(6):2325-2332.
[13] Boyd J K,Cheung C K,Molyneux K,et al.An update on the pathogenesis and treatment of IgA nephropathy[J].Kidney Int,2012,81(9):833-843.
[14] 刘小燕,祁爱蓉,罗登贵,等.雷公藤制剂生殖毒性及联用减毒研究进展[J].中国中医药信息杂志,2018,25(4):133-135.
[15] 林昌松,杨岫岩,戴冽,等.昆仙胶囊治疗类风湿关节炎多中心临床研究[J].中国中西医结合杂志,2011,31(6):769-774.
[16] 林昌松,刘明岭,徐强,等.昆仙胶囊治疗强直性脊柱炎疗效观察[J].新医学,2011,42(3):175-178.
[17] 曾又佳,孔慧霞,李顺民.昆仙胶囊治疗慢性肾脏病蛋白尿的临床疗效及其安全性观察[J].新中医,2014,46(7):74-76.
[18] 陈婷,李海坚,麦伟民.昆仙胶囊联合强的松治疗难治性肾病综合征的临床观察[J].中药药理与临床,2011, 27(6):97-99.
[19] 高明利,李晓晨,齐庆.昆仙胶囊降低狼疮性肾炎尿蛋白的临床观察[J].中药材,2010,33(4):651-652.
[20] 杨丽平,赵世萍,李克明.昆仙胶囊对阳离子化牛血清白蛋白所致大鼠肾病模型的保护作用[J].中国中西医结合肾病杂志,2009,10(12):1046-1049.
(收稿日期:2019-06-05)

