实验动物常见支原体荧光定量PCR检测方法建立
辛闻婷 杨媛媛 王馨宇 吴 东 李灵恩
(江苏集萃药康生物科技有限公司,南京 210061)
支原体(Mycoplasma)属于柔膜体纲(Mollicutes),支原体目(Mycoplasmatales),支原体科(Mycoplasmataceae),是能够在无生命培养基上生长的最小微生物[1]。迄今为止,很多研究表明支原体对实验动物和细胞有不同程度的污染[2-6],给科研、教学、生产领域相关的实验结果造成了很大的影响。
目前针对支原体的检测方法有多种[7-8],主要有病原分离鉴定法、血清学检测方法(间接免疫荧光法、酶联免疫吸附试验、免疫组化方法、间接血凝试验等)和分子生物学检测方法(PCR、荧光定量PCR、环介导等温扩增技术等)。其中,病原分离鉴定方法所需周期较长(2~3周)、技术要求高;而免疫学方法容易和其它病原发生交叉反应,特异性和敏感性较差;因此分子生物学方法是实验室检测支原体的首选方法。
本研究建立了支原体荧光定量PCR检测方法,具有快速、特异、灵敏、可大批量检测的特点,并可根据测序结果判断支原体类型,为实验室多种常见支原体的快速诊断提供了依据。
1 材料与方法
1.1 菌株和样品
肺支原体(Mycoplasmapulmonis)与猪鼻支原体(Mycoplasmahyorhinis)为实验室分离保存。小肠结肠炎耶尔森菌(Yersiniaenterocolitica)CMCC(B)52204、假结核耶尔森菌(Yersiniapseudotuberculosis)CMCC 53504、沙门氏菌(Salmonella)ATCC 14028、肺炎克雷伯杆菌(Klebsiellapneumoniae)CMCC (B)46117、绿脓杆菌(Pseudomonasaeruginosa)ATCC 27853、金黄色葡萄球菌(Staphylococcusaureus)ATCC 6538购自环凯微生物科技有限公司,嗜肺巴斯德杆菌(Pasteurellapneumotropica)ATCC 35149、鼠棒状杆菌(Corynebacteriumkutscheri)ATCC 15677购买自美国菌种保藏中心(ATCC)。
不同来源的60份小鼠肺脏、60份细胞培养物经冷链运输至本单位后冻存于-20 ℃冰箱中。
1.2 主要试剂与仪器
AceQ U+Probe Master Mix购自南京诺唯赞生物科技有限公司;蛋白酶K购自上海鼓臣生物技术有限公司;EDTA与Tris-HCl购自BIOSHARP公司。
Roche LightCycler 96购自罗氏诊断产品(上海)有限公司;柏恒GE9612T智能梯度PCR仪器购自杭州柏恒科技有限公司;天能EPS300电泳仪及电泳槽购自上海天能科技有限公司;Quawell Q5000 超微量紫外分光光度计购自美国QUAWELL科技公司。
1.3 引物设计与合成
通过比对Genbank上多种大、小鼠易感支原体的16 s rRNA基因中较保守的区域,用Primer Express 3.0设计引物和探针序列,再使用Primer 5与Oligo 7软件排除引物二聚体及错配后,最终确定引物(Myco FP、Myco RP)与探针(Myco P)的序列,预计扩增目的片段大小为168 bp。引物和探针的序列见表1,由北京擎科新业生物科技有限公司合成。
1.4 质粒标准品的构建
将目的片段的序列交由北京擎科新业生物科技有限公司合成含目的片段的质粒标准品pUC57-myco。使用载体pUC57的通用测序引物M13 F、M13 R对得到的质粒标准品进行PCR扩增,送北京擎科新业生物科技有限公司测序。
1.5 荧光定量PCR反应体系及条件的优化
以质粒标准品为模板,根据荧光定量PCR试剂盒说明书配置10 μL反应体系:2× AceQ U+mix 5 μL,Myco FP 1 μL,Myco RP 1 μL,Myco P 1 μL,模板 1 μL,超纯水补至10 μL。采用上述的反应体系,将引物和探针的浓度分别配制成250、350、450、550 nmol/L,每个引物和探针浓度的组合做两个重复,利用矩阵法对引物浓度和探针浓度进行优化。
用确定的引物、探针浓度及反应体系,将退火温度设置为58~65 ℃之间的8个随机温度梯度,每个温度梯度做两个重复,以优化退火温度。

表1 引物和探针序列Table 1 The sequence of primers and probe
1.6 标准曲线的绘制
用超微量紫外分光光度计测量质粒标准品的浓度,根据公式:待测质粒拷贝数(copies/μL)=(6.02×1023×样品浓度(ng/μL)×10-9)/(模板长度×660),计算质粒标准品的拷贝浓度。以10倍倍比稀释至5×106、5×105、5×104、5×103、5×102、5×101、5×100copies/μL的质粒标准品为阳性模板,超纯水为阴性对照,用已优化好的程序进行荧光定量PCR扩增,绘制标准曲线。
1.7 荧光定量PCR敏感性检测
以5×105、5×104、5×103、5×102、5×101、5×100copies/μL 6个浓度梯度的质粒标准品为阳性模板,超纯水为阴性对照,分别进行荧光定量PCR和普通PCR检测,比较两种检测方法的灵敏性。
1.8 荧光定量PCR特异性检测
用支原体荧光定量PCR方法对肺支原体、猪鼻支原体、小肠结肠炎耶尔森菌、假结核耶尔森菌、沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德杆菌、金黄色葡萄球、绿脓杆菌、鼠棒状杆菌进行检测。若产生扩增曲线,对其进行测序。
1.9 荧光定量PCR重复性检测
以5×105、5×104、5×103、5×102copies/μL 4个浓度梯度的质粒标准品为模板进行组内和组间重复性实验。组内重复性实验为每个浓度梯度的模板设置4个重复;组间重复性实验为每个浓度梯度的模板独立进行4次。将检测结果进行统计学分析,以评价本支原体荧光定量PCR的重复性。
1.10 临床样品检测
1.10.1样品处理
肺脏样品处理:剪取针尖大小的小鼠肺脏组织,放入灭菌后的1.5 mL Eppendorf管,加入500 μL含有蛋白酶K的消化液,在56 ℃培养箱中消化过夜。次日早晨将消化液12 000 r/min离心10 min后,取300 μL上清加入300 μL异丙醇,上下颠倒几次后12 000 r/min离心10 min,弃去管内液体充分晾干后,加100 μL超纯水后即得样品DNA。
细胞样品处理:吸取细胞及培养液1 mL至Eppendorf管内,12 000 r/min 5 min离心以收集底部细胞。弃上清后加入200 μL超纯水吹打细胞,用恒温混匀仪37 ℃孵育1 h后95 ℃ 300 r/min振摇使细胞裂解,即得基因组DNA。
1.10.2临床样品检测:使用本研究建立的支原体荧光定量PCR方法和普通PCR方法对120个临床样品DNA进行检测,并比较两种方法的检出率。若产生扩增曲线,对其进行测序。
2 结果
2.1 质粒标准品的鉴定
对质粒标准品进行PCR扩增后,将扩增产物送测序,NCBI上进行序列比对。结果显示,目的片段与支原体属中多种支原体的基因同源性达98%,表明标准品质粒构建成功。
2.2 荧光定量PCR反应条件的优化
通过矩阵法优化引物与探针的最佳浓度组合发现,当上、下游引物均为450 nmol/L,探针为250 nmol/L时,扩增效率最佳。同时优化退火温度,确定荧光定量PCR反应程序如下(其中包含降落PCR程序以增强特异性):95 ℃ 2 min;前10个循环降落PCR:95 ℃ 10 s,65~60 ℃ 30 s(每循环下降0.5度),72 ℃ 30 s;后30个循环普通PCR:95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s;最后37 ℃孵育30 s。
2.3 荧光定量PCR的标准曲线
使用超微量紫外分光光度计测得质粒标准品浓度为158.97 ng/μL,根据1.6中公式计算可得质粒标准品的拷贝浓度为5×1010copies/μL。将质粒标准品10倍倍比稀释至5×106、5×105、5×104、5×103、5×102、5×101、5×100copies/μL。用已优化好的体系及程序进行荧光定量PCR,绘制的标准曲线如图1所示。标准曲线公式为y=-3.3679x+38.24,扩增效率E=98.11%,相关系数R2=0.9972,表明该荧光定量PCR方法在5×100~5×106copies/μL之间能进行高效扩增且有很好的线性关系。
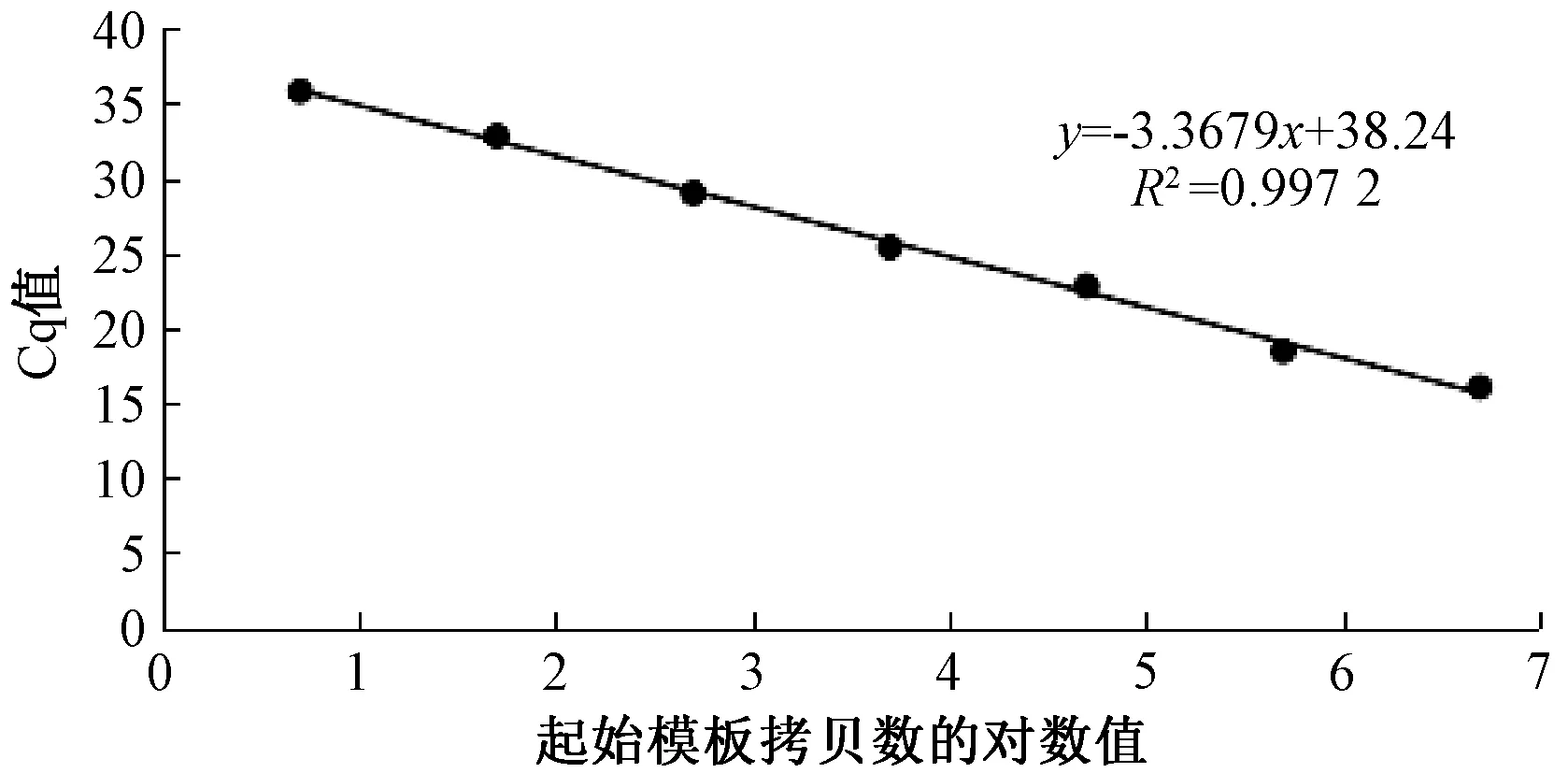
图1 荧光定量PCR标准曲线Fig.1 The standard curve of the real-time PCR
2.4 荧光定量PCR的灵敏性
用荧光定量PCR方法和普通PCR方法对不同浓度的质粒标准品进行检测。结果显示,荧光定量PCR方法能够检出质粒标准品的最低浓度为5 copies/μL(图2),PCR方法能够检出质粒标准品的最低浓度为5×102copies/μL(图3),表明本研究建立的支原体荧光定量PCR的检测灵敏性是常规PCR方法的100倍。

图2 荧光定量PCR灵敏性检测注:6~1:质粒标准品的浓度分别为5×105、5×104、5×103、5×102、5×101、5×100 copies/μL;0:阴性对照Fig.2 Sensitivity test of the real-time PCRNote:6~1:The concentration of standard plasmid was 5×105、5×104、5×103、5×102、5×101、5×100 copies/μL,respectively;0:negative
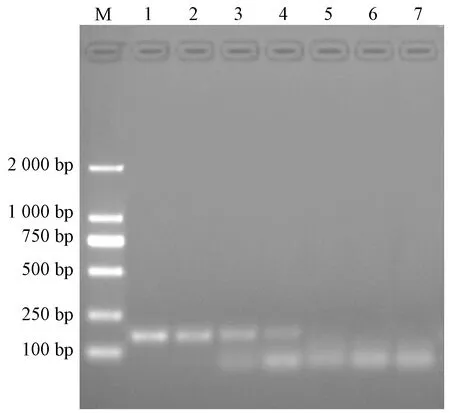
图3 普通PCR灵敏性检测注:M:DL 2000 DNA Marker;1~6:质粒标准品的浓度分别为5×105、5×104、5×103、5×102、5×101、5×100 copies/μL;7:阴性对照Fig.3 Sensitivity test of the conventional PCRNote:M:DL 2000 DNA Marker;1~6:The concentration of standard plasmid was 5×105、5×104、5×103、5×102、5×101、5×100 copies/μL,respectively;7:negative control
2.5 荧光定量PCR的特异性
用该荧光定量PCR方法对多种常见病原进行检测。结果如图4所示,肺支原体与猪鼻支原体有扩增曲线,且测序结果均为支原体。而其他病原菌:小肠结肠炎耶尔森菌、假结核耶尔森菌、沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德杆菌、金黄色葡萄球、绿脓杆菌、鼠棒状杆菌均无明显扩增曲线。
2.6 荧光定量PCR的重复性
选择4个浓度的质粒标准品检测本研究所建立的荧光定量PCR方法的重复性。结果如表2所示,组内重复试验的变异系数低于1%,组间重复试验的变异系数低于2%,表明该荧光定量PCR方法的重复性好,稳定性高。
2.7 临床样品的检测
用两种方法分别对60份小鼠肺脏和60份细胞样品进行检测,检测结果表明,支原体荧光定量PCR方法检测小鼠支原体阳性率为3.33%(2/60),普通PCR方法检测阳性率为1.67%(1/60),测序均为肺支原体;支原体荧光定量PCR方法检测细胞样品支原体阳性率为5%(3/60),与普通PCR方法检测结果一致,测序结果分别为猪鼻支原体(M.hyorhinis)、发酵支原体(M.fermentans)、精氨酸支原体(M.arginina)。本次临床样品检测结果也证明该荧光定量PCR方法的检测灵敏性高于普通PCR方法。

图4 荧光定量PCR特异性检测注:1:肺支原体与猪鼻支原体;2:其他参与检测的病原菌与阴性对照Fig.4 Specific test of the real-time PCRNote:1:Mycoplasma pulmonis and Mycoplasma hyorhinis;2:the other pathogenic strains participated in this test and negative control

表2 荧光定量PCR重复性试验结果Table 2 Reproducibility test results of the real-time PCR
3 讨论
大、小鼠是常用的实验动物之一,有资料表明实验用大、小鼠广泛存在支原体感染[2-3],常见的有肺支原体(M.pulmonis)、关节炎支原体(M.arhrititis)、溶神经支原体(M.neurolyticum)等。其中,肺支原体是对实验动物危害最大的一种支原体。肺支原体在大、小鼠中多呈隐性感染,导致动物的繁殖能力降低;在受到应激或免疫系统受到抑制时发病,并表现为咳嗽、肺炎等症状[9]。尽管支原体感染后多无明显的临床症状,但是病原的存在会对免疫学、老年病学、营养学、行为学等实验造成一定干扰[10]。
目前国内外常用的支原体检测方法为病原培养法、免疫学方法和分子生物学方法,每种方法各有利弊[7-8,11-12]。其中,分子生物学方法以其快速、灵敏、特异性强等优点吸引了越来越多的关注。常用的分子生物学检测方法主要是常规PCR和荧光定量PCR,但荧光定量PCR的灵敏性远高于常规PCR,且具有快速和高通量的优势,适合对大批量样品进行快速定量检测。武昱孜等[13]用常规PCR、套式PCR以及荧光定量PCR方法检测同一批样品,结果显示检出率分别为18.0 %、53.9 %和55.1 %。何曼莉等[14]研究显示,实时荧光定量PCR具有快速、准确和易标准化等优点,能够代替颜色变化单位(color change unit,CCU)法和浊度法对绵羊支原体进行定量。
本研究针对多种大、小鼠易感支原体的16 s rRNA基因中较保守的区域设计引物和探针,建立了支原体荧光定量PCR检测方法。该荧光定量PCR方法的标准曲线相关系数R2=0.9972,扩增效率E=98.11%,具有良好的线性关系,且当模板浓度在5×100~ 5×106copies/μL之间时能进行高效扩增。该方法特异性强,与小肠结肠炎耶尔森菌、假结核耶尔森菌、沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德杆菌、金黄色葡萄球、绿脓杆菌、鼠棒状杆菌无交叉反应;灵敏性高,最低检测限为5copies/μL,灵敏性较常规PCR方法高100倍,同时还能通过测序鉴定支原体亚型;稳定性好,组内和组间重复性试验的变异系数均低于2%。用该方法进行小鼠和细胞两种样品的临床检测,结果证实了该方法可用于小鼠的临床样品检测,同时检测结果与已报道的支原体流行率相符[2]。
另外,值得关注的是,该方法也可用于细胞易感支原体的检测。细胞对于各种生物制品、科研实验来说是必不可少的实验材料之一。自从Robinson等在1956年从一株Hela细胞培养液中分离出支原体以来,国内外有关支原体污染细胞的报道屡见不鲜。目前已报道的能够污染细胞的支原体有二十多种,常见的有发酵支原体(M.fermentans)、猪鼻支原体(M.hyorhinis)、精氨酸支原体(M.arginina)、人型支原体(M.hominis)等[15-17]。支原体感染后的细胞往往生长状态不佳[18],且细胞的DNA、RNA和蛋白的表达可能发生变化[19],降低实验结果的准确性。本研究建立的支原体荧光定量PCR检测方法能够同时检测实验动物及细胞易感支原体,提升了其应用价值。
综上所述,本研究成功建立了实验室多种常见支原体的荧光定量PCR检测方法,具有高特异性、高灵敏性、高稳定性、高通量及快速准确等优势,为实动物常见支原体的快速检测提供了方法。

