静动脉二氧化碳分压差对脓毒性休克患者容量反应性的预测价值*
曹 平,刘济铭,潘 桃
(重庆市璧山区人民医院重症医学科 402760)
脓毒症病情重且病死率高,病死率可达30%~70%,其发生率仍以每年1.5%~8.0%的速度增加,对患者生命构成严重的威胁[1- 2]。液体复苏已经成为治疗脓毒性休克患者的常用方法之一[3- 4]。静动脉二氧化碳分压差(Pcv- aCO2)作为脓毒性休克液体复苏治疗的参数之一[5],能动态地评估液体复苏治疗过程中患者的微循环情况。既往的研究对体液容量反应性静态检测主要从压力指标如中心静脉压(CVP)、肺动脉楔度(PAWP)等,逐步发展到心脏容积指标,如左心室舒张末容积(LVEDV)或其指数(LVEDVI)、右心室舒张末期容积(RVEDV)或其指数(RVEDVI)、胸腔内血容积(ITBV)或其指数(ITBVI)等,但研究证实这些指标均不能准确判定危重患者输液反应性[6- 7]。越来越多的研究发现,动态指标如复苏前后心输出量(cardiac output,CO)、心指数(cardiac index,CI)、血乳酸等变化过程,预测输液反应性的灵敏度和特异度均优于静态指标[8]。本研究基于此分析Pcv- aCO2对脓毒性休克患者容量反应性的预测价值,现将研究结果报道如下。
1 资料与方法
1.1一般资料 回顾性分析2014年1月至2017年12月本院重症医学科(ICU)脓毒性休克患者的临床资料。纳入的所有患者均参照2016国际脓毒症和脓毒性休克管理指南[9]诊断为脓毒症,并符合以下条件:经充分的液体复苏1 h后血压仍不能恢复平时水平,需用血管活性药物才能维持,同时伴有四肢冰凉、乳酸升高、意识变化、少尿等改变。排除标准:(1)入住ICU时间小于或等于6 h者;(2)入住后未留取中心静脉血及股动脉血行血气分析者;(3)妊娠、疾病终末期且合并多器官衰竭、严重肝肾疾病患者。本研究符合医学伦理学标准,并经本院医学伦理委员会审核批准。最终纳入89例脓毒性休克患者,男45例,女44例;年龄25~79岁,平均(55.32±16.98)岁;肺部感染38例,腹腔感染30例,泌尿道感染12例,其他感染9例。
1.2方法 患者入住ICU后即行右锁骨下深静脉穿刺(双腔中心静脉导管),使其头端位于右心房附近。同时,抽取中心静脉血标本及股动脉血标本,应用雅培i- STAT床边血气分析仪行血气分析并测定乳酸水平,Pcv- aCO2=PcvCO2-PaCO2。将中心静脉血氧饱和度(ScvO2)>70%者纳人研究,按BAKKER等[10]推荐的参考值将患者分为两组:Pcv- aCO2≥6.0 mm Hg组(A组,48例)和Pcv- aCO2<6.0 mm Hg组(B组,41例),在复苏前及复苏后6 h观察所有患者的心率(HR)、CO、CI、乳酸、Pcv- aCO2。A组男28例、女20例,平均年龄(39.3±5.3)岁,平均体质量(55.3±2.3)kg;B组男23例、女19例,平均年龄(35.3±5.8)岁,平均体质量(59.1±1.3)kg;两组患者性别、年龄、体质量等一般资料比较,差异无统计学意义(P>0.05),具有可比性。治疗28 d后观察患者存活情况,并将所有患者分为生存组和病死组,比较两组复苏6 h的急性生理功能和慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、Pcv- aCO2、血乳酸清除率,血乳酸清除率=(入科时动脉血乳酸水平-复苏时动脉血乳酸水平)/入科时动脉血乳酸水平×100%。

2 结 果
2.1液体复苏前后检测指标比较 复苏后6 h,所有患者CO、CI升高,乳酸水平、Pcv- aCO2降低,差异均有统计学意义(P<0.05);复苏前后HR比较,差异无统计学意义(P>0.05),见表1。
2.2不同Pcv- aCO2水平患者各检测指标比较 复苏后6 h时A组病死率高于B组(P< 0.05),A组CO、CI及乳酸清除率均低于B组(P<0.05),见表2。
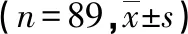
表1 复苏前后各相关指标比较
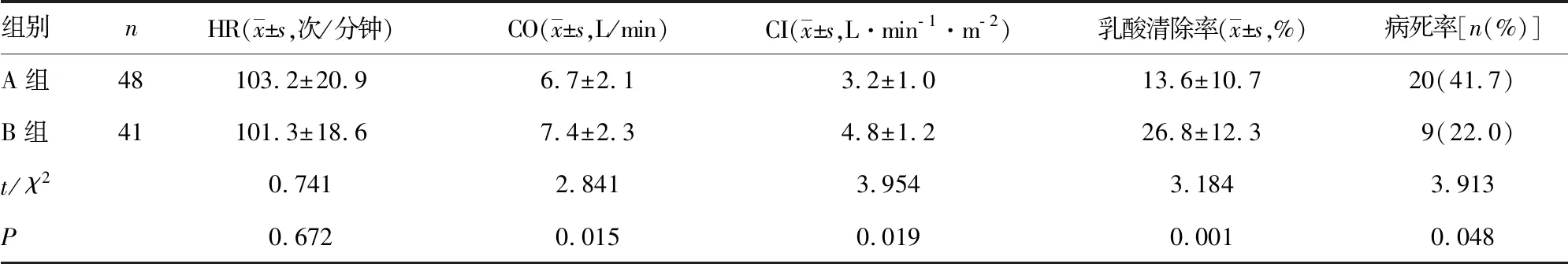
表2 不同Pcv- aCO2水平患者各检测指标比较
2.3生存组与病死组各相关指标比较 经治疗28 d后,生存患者62例,病死患者27例,生存组APACHEⅡ评分、Pcv- aCO2值均低于病死组,乳酸清除率高于病死组(P<0.05),见表3。
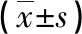
表3 生存组与病死组各相关指标比较
2.4各检查指标间的相关性分析 复苏前,Pcv- aCO2与血乳酸清除率、CO、CI无明显相关性(P>0.05);复苏6 h时,Pcv- aCO2与CO、CI及血乳酸清除率呈正相关(r=0.714、0.625、0.683,均P=0.001)。
3 讨 论
本研究结果显示,较高水平的Pcv- aCO2可能预示着较差的临床预后。休克是由于灌注不足导致的组织细胞缺氧缺血及无氧代谢,早期的容量复苏是治疗脓毒性休克的重要手段之一[11]。通过早期容量复苏能改善组织细胞的灌注情况,改善组织缺血、缺氧,挽救组织细胞功能[12- 13]。但近期有研究发现,一些脓毒性休克患者往往存在供氧不足且ScvO2升高的情况,因此ScvO2用于指导液体复苏的临床意义遭到质疑[14]。有学者纳入ICU中83例患者,分析Pcv- aCO2与CI及Pcv- aCO2与CI的关系[15]。入选的患者同时监测中心静脉血及混合静脉血二氧化碳分压,经研究证实,Pcv- aCO2与CI呈线性相关,Pcv- aCO2与CO亦呈线性相关。另有学者随机抽取入住ICU的冠状动脉手术患者40例,术后均置入肺动脉漂浮导管,并进行液体复苏,分析Pcv- aCO2与CI的相关性;该40例患者入住ICU时(T0)的CI≤2.5 L·min-1·m-2,经过容量复苏后,以PAWP≥18 mm Hg 为液体复苏终点(T1),患者的CI明显升高,Pcv- aCO2明显降低[16]。以上研究均证实,Pcv- aCO2与CI呈负相关关系,故Pcv- aCO2是反映流量的指标,可反映脓毒性休克患者复苏时的微循环状况,也可通过CO、CI等指标间接反映复苏的效果。本研究发现,复苏后6 h与复苏前比较,患者CO、CI升高,乳酸水平、Pcv- aCO2降低,且在不同Pcv- aCO2水平患者比较中,复苏后6 h时A组CO、CI及乳酸清除率均低于B组(P<0.05)。
此外,本研究还发现,复苏6 h时Pcv- aCO2与乳酸清除率呈正相关(r=0.683,P=0.001)。且A组病死率高于B组,即Pcv- aCO2水平越高其病死率越高。乳酸清除率与脓毒性休克患者的病死率具有相关性[17],动态监测乳酸清除率较单一监测乳酸水平的临床意义更大。该研究结果与张丽娜等[18]的研究结果一致。
虽然目前关于Pcv- aCO2的临床意义还存在争议。但有学者认为,脓毒性休克患者的血流动力学多呈现高血流动力学状态,因此Pcv- aCO2可以在正常范围波动,且影响Pcv- aCO2测定的因素较多,对Pcv- aCO2变化(或无变化)的理解需慎重[19]。HEINZ等[20]研究表明,将中心静脉导管置于右心房入口处,其Pcv- aCO2主要反映上半身的血流情况,并不是全身的血流情况,也不能反映脏器的血流情况。因此,目前对Pcv- aCO2的理解还需结合其他指标共同分析。
综上所述,较高水平的Pcv- aCO2可能预示着治疗复苏后CI、心搏出量及乳酸清除率改善不佳,病情重,死亡风险大。Pcv- aCO2可作为脓毒性休克患者疗效评价的有效指标之一。但本研究为单中心回顾性研究,样本量较小,观察的预后指标较少,且未能对两组患者的预后做出综合评价,有待进一步研究。

