猪蓝耳病抗体高敏荧光免疫层析快检试剂盒的研制
王泽洲,张毅,吴俊清,章健,陈弟诗,贺冬梅
(1.四川省动物疫病预防控制中心,四川 成都 610041;2.成都微瑞生物科技有限公司,四川 成都 611731)
猪繁殖与呼吸综合征(PRRS)简称猪蓝耳病,是我国养猪业的重要疫病之一[1]。PCR、酶联免疫吸附试验(ELISA)、胶体金技术等在PRRS的诊断、流行病学调查和监测等方面发挥了重要作用[2-5],但在即时现场快速检测方面存在不足。本研究应用镧系元素铕(Eu)作荧光标记物研制了一种既简单、快捷,又准确、特异、敏感的猪蓝耳病抗体高敏荧光免疫层析快速检测试剂盒(PRRS-LFICA)。现将研究结果报告如下:
1 材料与方法
1.1 材料 PRRS表达蛋白抗原、兔抗鸡IgY抗体、鸡IgY抗体,镧系荧光纳米微球和Wellray®WR-1608荧光仪;吸水纸、样品垫、硝酸纤维素膜,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺,切条机、点膜与喷金膜机,其他试剂均为国产分析纯。还需准备猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)等7种病毒的阳性血清IDEXX试剂盒。
此外,制备包被膜、抗原标记微球、夹心法建立等,均参照说明书或按相关要求操作。
1.2 荧光免疫层析试纸条的组装 在湿度小于30%,温度20~25 ℃的环境下,把吸水纸、标记物垫和样品垫按顺序粘贴在聚氯乙烯底板上形成微反应体系,然后将其切割成0.5 cm宽,即成试纸条,将试纸条装入卡壳中制成检测卡,装入铝箔袋封存备用。
1.3 特异性试验 以建立的判断标准(标准曲线)与CSFV、PCV-2、PRV、PPV、JEV、PEDV、TGEV阳性血清进行猪蓝耳病抗体镧系荧光免疫层析检测,同时设阳性、阴性对照,旨在确定该检测方法是否发生交叉反应。
1.4 敏感性试验 将PRRSV标准阳性血清进行1∶4、1∶16、1∶64、1∶256、1∶1 024、1∶4 096、1∶16 384倍比稀释,每个稀释度平行做4个重复,用组装的PRRS-LFICA试剂盒检测,将结果换算成S∕P值,判断抗体检出效价。
1.5 重复性试验
1.5.1 批内重复性试验 在相同条件下,选取12份PRRSV抗体水平不同的血清样本,每份样本平行做8个重复,用组装的PRRS-LFICA试剂盒(批号:20170831)检测,对检测结果进行统计学分析。
1.5.2 批间重复性试验 在相同条件下,选取12份PRRSV抗体水平不同的血清样本,分别用4批PRRS-LFICA试剂盒检测(批号分别为20170831、20171107、20171221、20180117),然后对检测结果进行统计学分析。
1.6 比较试验 分别用组装的PRRS-LFICA试剂盒和ELISA试剂盒(IDEXX)检测临床样品200份,比较两种方法的符合率。
1.7 试剂盒的组装及保存期试验 PRRS-LFICA试剂盒由荧光检测仪、检测卡、连接线组成。试剂盒置4 ℃保存,于保存后60、120、180、240、300、360、420、480 d按照PRRS-LFICA各个优化条件,对PRRSV阳性和阴性参考血清进行检测,然后对结果进行统计学分析。
1.8 现场应用试验 用研制的PRRS-LFICA试剂盒对来自四川省内的2 336份送检样本进行检测,了解PRRSV血清抗体阳性率。
2 结果
2.1 测定条件的选择
2.1.1 标记量的选择 把标记好的质量比(抗体∕微球)不同的荧光微球稀释相同倍数,组装成检测卡,在检测卡加样孔分别加入80 μL参考样本,室温下层析15 min,检测,考察并验证不同标记量对标记结果的影响。结果表明,随标记抗原浓度的增加,各浓度点的结合率呈现先增后降的趋势,在抗原∕微球的质量比为1∶25时有最大值。因此,选择标记比例为1∶25的免疫微球进行后续实验。
2.1.2 加样量的选择 在其他条件一致的情况下,考察并验证样本不同稀释倍数对检测结果的影响。在检测卡加样孔里分别加入稀释10、20、30、40、50、60、70倍的参考样本,室温下反应15 min后检测。结果表明,随稀释倍数的增加,各浓度点的结合率均减小。当样本稀释倍数为40倍时,继续降低稀释倍数,结合率增加不明显,免疫反应基本饱和。因此,后续实验选择样本稀释倍数40倍为加样量。
2.1.3 检测时间的选择 在检测卡加样孔中加入80 μL参考样本,室温下免疫反应,分别在5、10、15、20、25、30 min时检测,考察不同检测时间对结果的影响。结果表明,随着检测时间的延长,各浓度点的结合率基本呈现增加的趋势,试纸静置15 min检测即能达到较高的结合率,而随着检测时间的增加,各浓度点的结合率不再发生较大的变化,趋于平稳,说明在15 min时试纸条上的双抗原夹心吸附基本达到饱和。因此,本着快速简便的原则,选择检测时间为加样后15 min。
2.2 检测结果的判读 加样后,由于液体向前移动,先后与包被在T线和C线上的抗原形成复合物,这时试纸条经荧光检测设备扫描显示出2条荧光带。C线荧光扫描值基本一致,T线值随加样中抗体浓度的增加而升高。相应的检测结果以浓度为横坐标,荧光值信号为纵坐标,经对数函数数据处理程序拟合得到标准曲线。当样本为阴性时,PRRSV抗体浓度很低,T线荧光值很低或完全检测不到;当样本为阳性时,PRRSV抗体浓度越高,T线荧光值也越高。无论是阳性还是阴性结果,C线总能显示荧光,如果C线没有荧光显现,无论T线有无,这时的结果均判为无效。
2.3 特异性试验 本次用PRRSV蛋白和全病毒建立的PRRS-LFICA试剂盒检测7种常见猪病的阳性血清,荧光比值均低于0.40(表1),呈阴性反应。表明该方法与7种常见猪病阳性血清不发生交叉反应,显示出很好的特异性。
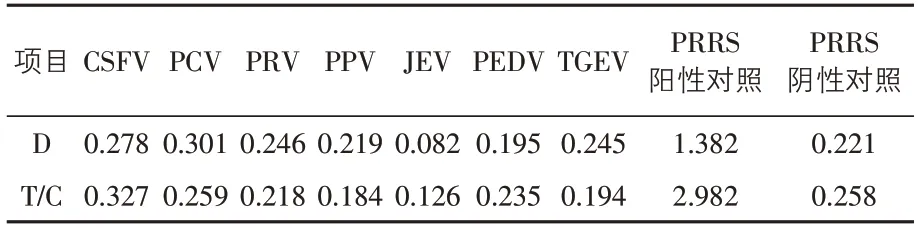
表1 特异性试验结果
2.4 敏感性试验 检测PRRSV标准阳性血清,当血清稀释至1∶1 024时,荧光检测仍为阳性,用同一份阳性血清同时进行ELISA检测,其效价为1∶64,可见用PRRS-LFICA试剂盒检测比用ELISA检测高1~2个滴度,表明该试剂盒的敏感性较好。
2.5 重复性试验 批内重复性试验的变异系数小于10%(表2),批间重复性试验的变异系数也小于10%(表3)。表明PRRS-LFICA试剂盒具有良好的重复性。

表2 批内重复性试验结果
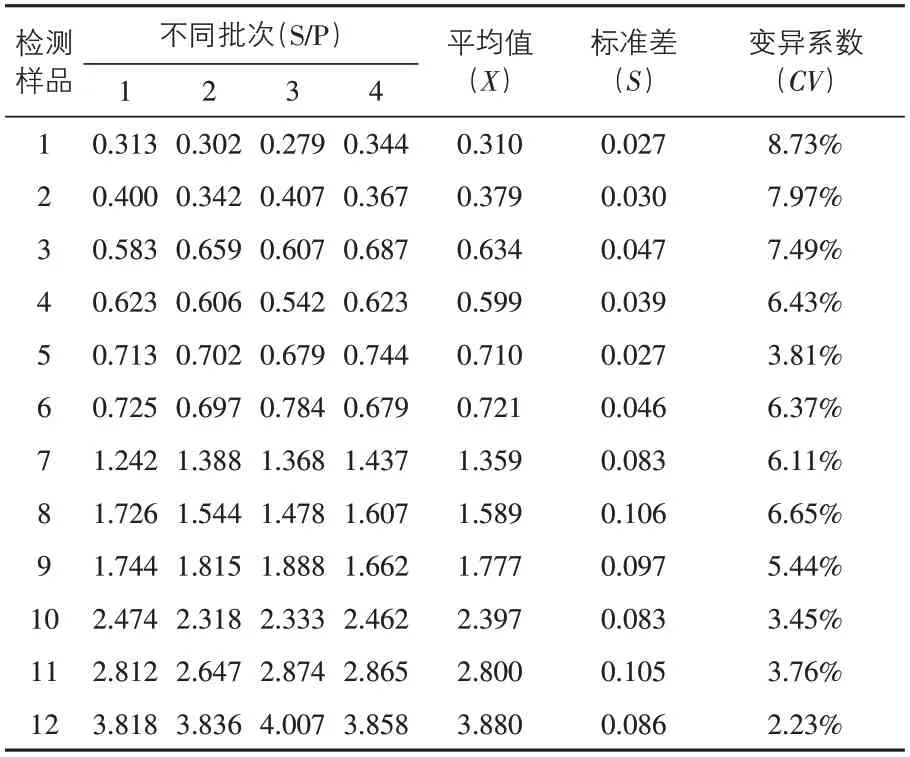
表3 批间重复性试验
2.6 比较试验 分别用PRRS-LFICA试剂盒和ELISA试剂盒检测临床样品200份,比较两种方法的符合率。结果得出:PRRS-LFICA试剂盒检出阳性180份,阴性20份,ELISA检出阳性183份,阴性17份,两种检测方法的总符合率为91.5%(表4)。

表4 比较试验结果
2.7 试剂盒保存期试验 如表5所示,PRRS-LFICA试剂盒在保存480 d后检测阳性血清、阴性血清,其变异系数均小于10%,说明该诊断试剂盒在保存12个月后仍然稳定有效,进一步的稳定性试验还在进行中。
2.8 现场应用试验 使用本次研制的PRRSLFICA试剂盒检测四川省内各地市送检的样本2 336份,检出血清抗体阳性2 087份,阳性率为89.34%。
3 结论与分析
3.1 镧系荧光免疫层析方法(LFICA)是在时间分辨荧光免疫分析(TRFIA)基础上建立起来的一种超微量快速免疫检测技术,它集合了酶标记技术、放射标记技术和同位素标记技术的优点,具有灵敏度高、特异性强、稳定性好、无污染,且测定范围宽,试剂盒寿命长,操作简单和无放射性等优点。在人医学界已有文献报道,在兽医学领域才起步,需要研究的内容和范围还很多[6-7]。
3.2 本研究采用镧系元素铕(Eu)作为荧光物质,与传统荧光物质相比,铕具有独特的荧光光谱特性:Stokes位移大、激发光谱宽、发射光谱窄、荧光寿命很长[8],由此建立的荧光方法特异性更强,敏感性更高,检测结果更加准确可靠。荧光纳米微球的大小和均匀度也是重要的影响因素,本试验用的微球粒径为70~200 nm。微球表面经过羧基(或氨基)活化处理,易与蛋白或抗体牢固地结合,提高标记物的稳定性。微球表面积比大,可以提高蛋白质的包被量,提升标记效率,从而大大提高试纸条的灵敏度。
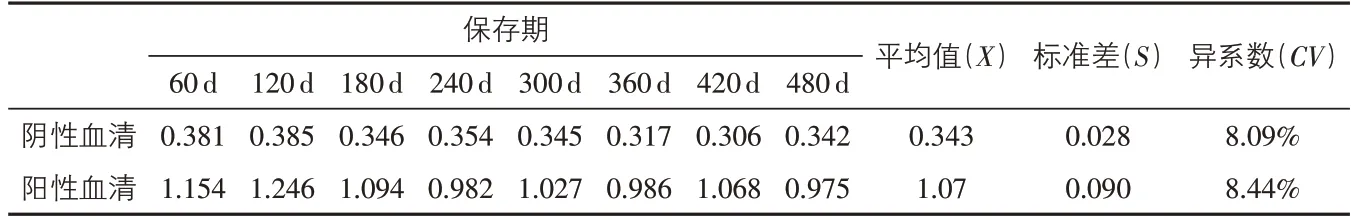
表5 保存期试验结果
3.3 在猪蓝耳病抗体的常用检测方法中,ELISA是目前应用最广、发展最快的免疫检测技术,具有敏感性和特异性强、操作简单、检测相对快速、检查微量、无辐射、高通量等优点,但需要比较完备的实验设备,操作人员需要有一定的专业技术水平和经验,检测一批样品的整个流程至少需要2~4 h,对于基层兽医站和一般的养殖场不适用。胶体金免疫层析法(GICA)是近几年来发展起来的一种快速检测方法,操作简单方便,不需要特殊仪器设备,但敏感性、重复性不高,产品质量参差不齐,漏检率和误诊率较高。本研究建立的PRRS-LFICA方法,既具有胶体金免疫层析法简单方便、适于基层等优点,又具有ELISA敏感、特异、微量等优点,克服了各自的缺点,与ELISA试剂盒检测结果的符合率和敏感性都在90%以上。综合分析表明,PRRS-LFICA试剂盒完全可以用于PRRS免疫抗体的快速检测。

