Smad3促进肾小管上皮细胞转分化在高糖诱导肾脏纤维化中的作用*
毛彦稳,张小欢,刘玲伶,刘慧铭,梁露群,张会芳,向珈谊,王圆圆
(贵州医科大学 基础医学院 病理生理教研室,贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳 550025)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus, DM)最常见的严重微血管并发症之一[1]。在DN过程中,上皮细胞表型标志物(例如E-cadherin、N-cadherin等)表达减少,并逐渐表达间质细胞表面标志物(Desmin、α-Smooth muscle actin等),发生向成纤维细胞转分化(epithelial-mesenchymal transition, EMT),从而加重加快DN肾脏纤维化的进程[2-4]。课题组前期研究发现,肾小管上皮细胞EMT在肾纤维化中发挥重要作用,抑制上皮细胞转分化将抑制或延缓DM肾脏纤维化以及高糖诱导的肾小管上皮细胞纤维化进程[5-8]。转化生长因子-β1(Transforming growth factor-β1, TGF-β1)可以诱导EMT的发生,是公认的致纤维化因子[9-11]。Smad3 作为TGF-β1 受体激酶底物之一,被认为是介导 TGF-β1 诱导纤维化的关键分子[12-13],而Smad3在高糖诱导肾小管上皮细胞纤维化过程中的作用尚不明确,因此本研究通过观察Smad3对高糖条件下肾小管上皮细胞转分化的影响,探讨Smad3在高糖诱导肾脏纤维化中的作用。
1 材料与方法
1.1 主要材料与仪器
1.1.1主要试剂 肾小管上皮细胞株(吉妮欧,中国),DMEM细胞培养基(Hyclone,美国),Smad3抗体、P-Smad3(Ser423/425)抗体(CST,美国),E-cadherin抗体、Desmin抗体(Santa Cruz公司,美国),β-actin单克隆抗体 (普美,中国),胎牛血清、胰酶(Gibco,美国),一抗稀释液、ECL 显色剂、质粒提取试剂盒(碧云天,中国),real-time PCR试剂(天根,中国),Lipofectamine 3000(赛默飞,美国)。
1.1.2主要仪器 电泳系统及电转移装置(北京六一,中国),凝胶成像系统、荧光定量 PCR 仪(Bio-Rad,美国),DP72显微镜(OLYPUMS,日本)。
1.2 方法
1.2.1质粒构建 敲低Smad3质粒(Smad3-sh)和过表达Smad3质粒(OE-Smad3)均由上海毅乐公司设计合成,序列见表1。

表1 敲低Smad3质粒、空载质粒及过表达Smad3质粒序列Tab.1 Sequence of Smad3 knock down plasmid, vector of the plasmid and Smad3 overexpression plasmid
1.2.2细胞培养与分组 细胞生长融合度达 80%时,弃去培养瓶中的培养液,用无菌 PBS 洗涤 3 次,弃上清液、吸干,加入胰蛋白酶(浓度为 0.25%,37 ℃预热) 1 mL进行消化,细胞悬液均匀组铺于6 孔板或相应培养皿中。随机将细胞分为正常对照组(NC组)、正常糖组(NG组)、高糖组(HG组、空载组(vector组)、敲低Smad3质粒干预组(Smad3-sh组)及过表达Smad3质粒干预组(OE-Smad3组),正常糖为5.5 mmol/L葡萄糖,高糖为30 mmol/L葡萄糖;各组于培养箱(37 ℃,5% CO2)中孵育过夜。
1.2.3细胞转染 待细胞融合至50%~60%时,进行转染。配制转染液:DMEM 培养液(不含血清及双抗)、Lipofectamine 3000、质粒,瞬离、混匀,于无菌环境静置 30 min;弃去培养皿中的培养液,并且加入已经混匀好的转染液,轻晃混匀,于培养箱(37 ℃,5% CO2)中孵育48 h。
1.2.4质粒效应检测 (1)Real-time PCR实验检测Smad3 mRNA表达水平,按天根公司试剂盒说明书,用Trizol法提取各组大鼠肾组织的总 RNA;以20 μL反应体系反转录-聚合酶链反应合成cDNA,内参照β-actin及Smad3的引物由生物工程有限公司合成,内参照β-actin上游引物序列5′-ACCACCATGTACCCAGGCAT-3′,下游引物序列5′-CCGGACTCATCGTACTCCTG-3′);Smad3上游引物序列5′-GCCGAGGGAACATCCTGTCT-3′,下游引物序列5′-CCACGTCACTGCGGAGACA-3′;采用Bio-Rad CFX 96TM 荧光定量 PCR分析系统进行RT-qPCR。(2)采用Western blot Smad3 蛋白表达水平,提取各组细胞蛋白,用BCA试剂盒(碧云天)测定各组蛋白质浓度,按所测得浓度计算每泳道所需体积,加入加样缓冲液煮沸10 min,经8%的SDS-PAGE凝胶电泳分离,再转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入抗β-actin、Smad3及抗体,4 ℃孵育过夜;次日,TBST洗膜后,加入相应二抗(浓度均为1 ∶7 000)室温孵育1 h,加ECL荧光显色液,凝胶成像仪曝光,Image Lab软件分析各条带调整体积值,结果用目标蛋白/β-actin值表示。
1.2.5敲低和过表达Smad3对EMT的影响 选取正常对照组(NC)、空载组(vector)、敲低Smad3质粒干预组(Smad3-sh)及过表达Smad3质粒干预组(OE-Smad3)细胞,分别给予正常糖浓度及高糖浓度处理,于培养箱(37 ℃,5% CO2)中孵育过夜。提取各组细胞蛋白,采用Western blot 法检测Smad3、p-Smad3(Ser423/425)、E-cadherin及Desmin蛋白表达水平;提取各组细胞蛋白,用BCA试剂盒(碧云天)测定各组蛋白质浓度,按所测得浓度计算每泳道所需体积,加入加样缓冲液煮沸10 min,经8%的SDS-PAGE凝胶电泳分离,再转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入抗β-actin、Smad3、p-Smad3(Ser423/425)、E-cadherin及Desmin抗体,4 ℃孵育过夜;次日,TBST洗膜后,加入相应二抗(浓度均为1 ∶7 000)室温孵育1 h,加ECL荧光显色液,凝胶成像仪曝光,Image Lab软件分析各条带调整体积值,结果用目标蛋白/β-actin值表示。
1.3 统计学处理

2 结果
2.1 E-cadherin及Desmin蛋白表达
结果显示,NG组E-cadherin蛋白高表达,而Desmin表达较少;与NG组相比,HG组细胞E-cadherin蛋白表达减少,而Desmin蛋白表达增高,差异具有统计学意义,P<0.05。见如图1。

注:A为Western blot条带,B为灰度值定量条图;(1)与NG组比较,P<0.05。图1 肾小管上皮细胞中E-cadherin和Desmin蛋白表达(Western blot)Fig.1 The effect of HG on the protein expression levels of E-cadherin, Desmin in NRK-52E cellsNG:normal glucose group;HG:high glucose group
2.2 质粒效应检测
结果显示,与NC组相比,vector组Smad3蛋白及mRNA水平表达均无显著变化,而Smad3-sh组Smad3蛋白及mRNA表达均显著减少(P<0.05),蛋白敲低效率约为60%;OE-Smad3组Smad3蛋白及mRNA表达均显著增加(P<0.05),蛋白过表达约为3.5倍。见图2。
2.3 敲低和过表达Smad3对EMT的影响
结果显示,与NG组比较,HG刺激肾小管上皮细胞细胞后,p-Smad3/Smad3蛋白比值、Desmin蛋白表达水平均显著增加,E-cadherin蛋白表达水平显著减少,差异具有统计学意义(P<0.05);在NG情况下敲低Smad3后,p-Smad3/Smad3蛋白比值减少,Desmin蛋白表达水平略有减少,E-cadherin蛋白表达水平略有增加,差异无统计学意义(P>0.05);而在HG情况下敲低Smad3,Desmin蛋白表达水平显著减少,E-cadherin蛋白表达水平显著增加,差异有统计学意义(P<0.05);在NG情况下过表达Smad3,p-Smad3/Smad3蛋白比值增加,Desmin蛋白蛋白表达水平略有增加,E-cadherin蛋白蛋白表达水平略有减少,但差异无统计学意义(P>0.05);而在HG情况下过表达Smad3,Desmin蛋白表达水平显著增加,E-cadherin蛋白表达水平显著减少,差异有统计学意义(P<0.05)。见图3。
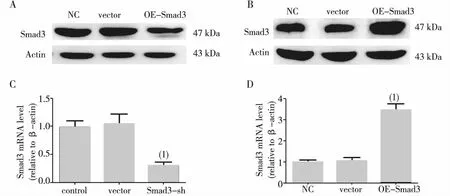
敲低Smad3 过表达Smad3注:A、B为Western blot条带,C、D为灰度值定量条图;(1)与NC组比较,P<0.05。图2 各组肾小管上皮细胞细胞中Smad3蛋白及mRNA表达Fig.2 The protein expression levels and mRNA expression levels of Smad3 in Smad3-sh and OE-Smad3 NRK-52E cells

敲低Smad3 过表达Smad3注:A、B为Western blot条带,C、D为灰度值定量条图;(1)与NG+control组比较,P<0.05; (2)与HG+control组比较,P<0.05。图3 敲低和过表达Smad3对EMT的影响(Western blot)Fig.3 The effect of Smad3 expression on HG-mediated E-cadherin and Desmin expression levels
3 讨论
肾脏纤维化是慢性肾脏疾病 (chronic kidney disease,CKD) 的共有特征之一,以大量肌纤维母细胞的活化和细胞外基质 (extracellular matrix,ECM) 的过度沉积为主要特征,常导致肾功能的持续恶化,最终可能进展为终末期肾脏疾病 (end-stage renal disease,ESRD)[14]。目前,对于肾脏纤维化的发病机制还不明确,且临床上缺乏有效治疗措施[15]。肌成纤维细胞是分泌肾间质细胞外基质的主要细胞,在疾病状态下,上皮细胞表达成纤维细胞表面标志物并发生向DM,从而分泌大量细胞外基质,最终将加重加快DN肾脏纤维化的进程[2-4]。本研究发现,正常糖培养的肾小管上皮细胞成纤维细胞标志物表达较少,向间充质细胞转分化较少,而在高糖刺激之后,上皮细胞发生大量转分化,成纤维细胞标志物表达显著增加。课题组前期发现,肾小管上皮细胞EMT在肾纤维化中发挥重要作用,抑制上皮细胞转分化将抑制或延缓DM肾脏纤维化以及HG诱导的肾小管上皮细胞纤维化进程[5-8],提示寻找抑制EMT过程的有效靶点将为临床上治疗肾脏纤维化提供理论依据。
TGF-β1是公认的致纤维化因子,肾脏肾脏纤维化过程中发挥至关重要作用[14-15]。Smads作为主要的TGF-β1受体激酶底物,承担着转导通路中介分子的作用,将TGF-β1信号从细胞外传递到细胞核。根据结构和功能,Smad蛋白可分为3种亚型:(1)受体调控型Smad(R-Smad),包括 Smad1、2、3、5、8;(2)共用型Smad(co-Smad)只有 Smad4;(3)拮抗型Smad (I-Smad)有Smad 6,7[12-15]。激活的TGF-β1通过跨膜的Ⅱ型(TβRⅡ)和Ⅰ型(TβRⅠ)丝氨酸/苏氨酸激酶受体激活其下游的Smad2/3,Smad2/3随后与Smad4形成复合物转移入细胞核中,在核中Smad2/3/Smad4复合物可与转录辅激活剂p300/CBP相互作用,参与TGF-β1目的基因的转录活化,发挥其致纤维化效应诱导肾小管上皮细胞向间充质细胞转分化(epithelial-mesenchymal transition,EMT),促使细胞外基质(extracellular matrix,ECM)合成增加并抑制其降解而过度沉积,从而造成广泛的肾组织纤维化[14-15]。Smad3 被认为是介导 TGF-β1 诱导纤维化的关键分子,敲除Smad3能抑制ECM沉积和EMT的发生,从而改善单侧输尿管梗阻所致的肾脏纤维化以及TGF-β1所诱导的体外肾小管上皮细胞纤维化[14,16];并且TGF-β1激活Smad3可上调多种促纤维化的微小RNA(micoRNA)表达,包括miR-21、miR-129及miR-145[17-18]。本研究中,在高糖条件下培养的肾小管上皮细胞中,敲低Smad3抑制高糖诱导的肾小管上皮细胞转分化过程,并且过表达Smad3之后可以促进高糖诱导的肾小管上皮细胞转分化,表明Smad3在高糖诱导的肾小管纤维化模型的作用与其他学者在其他肾脏纤维化模型中的作用一致[14,16]。肿瘤方面的研究发现,Smad3可以单独与Smad4结合成Smad3/4复合物,并且结合在核转录共抑制因子(Ski-related novel protein N,SnoN)基因的SIE (Smad-inhibitory element)从而抑制SnoN基因转录,从而减少SnoN蛋白表达[19]。而SnoN蛋白是TGF-β1的负调控因子,它可以分别在细胞质和在细胞核中抑制TGF-β1信号通路的活化[20-21]。提示Smad3可能通过削弱SnoN对TGF-β1信号通路的负调控作用,从而促进HG诱导肾小管上皮细胞纤维化的发生,但具体机制还有待进一步研究。
综上所述,Smad3 促进HG诱导肾小管上皮细胞转分化过程,从而促进高糖介导的肾小管上皮细胞纤维化的发生。

