一种金黄色葡萄球菌核酸检测方法的建立
万宇平 吴小胜 张瑜 杜美红 王兆芹 冯才伟 赵正苗 何方洋*
一种金黄色葡萄球菌核酸检测方法的建立
万宇平①③吴小胜①③张瑜①③杜美红②王兆芹①③冯才伟①③赵正苗①③何方洋①③*
(①北京勤邦生物技术有限公司 北京 102206 ②北京市理化分析测试中心 ③北京市食品安全免疫快速检测工程技术研究中心)
通过对金黄色葡萄球菌的femA基因设计两对特异性引物,运用环介导等温扩增技术(LAMP)扩增基因的特定区域,探索出一种金黄色葡萄球菌的快速检测方法。结果表明,该方法对金黄色葡萄球菌菌液检测的最低检出浓度为102~103CFU/Ml;使用不同浓度的金黄色葡萄球菌处理样品,不同样品LAMP方法检测结果与国标方法一致,两者符合率为100%。该方法中金黄色葡萄球菌的femA基因特异性引物及建立的LAMP方法能有效检测食品中的金黄色葡萄球菌,操作简单、检测速度快、灵敏度高、特异性强,适用于不同层级的实验室及基层单位使用。
金黄色葡萄球菌 环介导等温扩增技术 快速检测
金黄色葡萄球菌(Staphylococcus aureus)属革兰氏阳性菌,是人类化脓感染中最常见的食源性病原菌[1],耐高低温、耐高渗透,生存能力强,普遍存在于环境中,消毒等常规处理方法无法完全破坏其分泌的毒素[2]。误食金黄色葡萄球菌污染的食品可引起腹泻、呕吐等食物中毒反应,严重时可引起局部化脓感染,亦可引起肺炎、伪膜性肠炎、心包炎等,甚至引发败血症、脓毒症等全身感染,危及生命[3-5]。据统计,每年我国细菌性食物中毒占食物中毒事件总数的30%~90%,中毒人数占食物中毒总人数的60%~90%,严重影响了人民群众的生命健康[6]。食品中致病菌的超标也是影响我国食品出口的主要因素,每年都给我国造成了巨大的经济损失,同时也使我国食品在国际市场上的声誉受损,制约了我国农业和食品制造业的发展[7]。由于其危害性,全球各国都重视对金黄色葡萄球菌的预防监控及检测技术,我国农业部发布的《GB 29921-2013食品安全国家标准食品中致病菌限量》中规定金黄色葡萄球菌的限量为100CFU/g[8]。
目前检测金黄色葡萄球菌的主要方法有传统的国标法[9]、免疫学检测方法、分子生物学检测等技术,这些方法灵敏性和特异性比较高,但步骤较为繁琐,耗时长,操作复杂,大多需要昂贵的仪器设备,且受人为操作的影响较大,不能适用于现场的快速检测,难以在基层单位实现大面积的普及和推广应用。环介导等温扩增技术(LAMP),是日本科学家 Notomi等[10]创建的一种新型核酸扩增技术,可针对靶基因设计能识别相应互补位点的4条特异性内、外引物,利用Bst DNA聚合酶在60~65℃等温条件下对其进行延伸,形成哑铃状DNA结构,随后,在此基础扩增,最终生成DNA片段混合物[10]。结果主要是通过凝胶电泳法、沉淀法、显色法等方法进行检测[11]。SYBR Green I作为一种高灵敏度的DNA荧光染料,安全无毒,结合于所有dsDNA双螺旋小沟区域[12],可检出20pb的DNA,灵敏度高。运用LAMP方法可简单、快速检测金黄色葡萄球菌,且灵敏度高,特异型强。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株 金黄色葡萄球菌CICC10477、金黄色葡萄球菌ATCC6538、表皮葡萄球菌CMCC(B)26069、鼠伤寒沙门氏菌ATCC14028、鸭沙门氏菌CICC21498、沙门氏菌50001、肠炎沙门氏菌50041、肠炎沙门氏菌CICC21490、大肠埃希氏菌ATCC25922、副溶血性弧菌ATCC17802、福氏志贺ATCC2457T、单增李斯特菌CMCC(B) 54002、小肠结肠炎耶尔森菌CMCC(B)52225、阪崎肠杆菌来自军科院、金黄色葡萄球菌野生菌分离自饺子,粘氏沙雷氏菌、潘氏变形杆菌、奇异变形杆菌、溶血性葡萄球菌、微球菌、屎肠球菌均为野生菌。
1.1.2 仪器与设备 恒温水浴锅(美国WEALTEC CORR公司)、荧光定量PCR仪(美国Thermo Fisher 公司)、生化培养箱、高压灭菌锅、4℃离心机、Mini离心机、金属浴、超净工作台等。
1.1.3 试验试剂 生理盐水、致病菌相应的二次增菌液、脑浸液、无菌拭子、7.5%氯化钠、肉汤培养基、缓冲蛋白胨水培养基、金黄色葡萄球菌显色培养基、血平板、Bst DNA聚合酶、营养琼脂、胰酪胨大豆酵母浸膏琼脂培养基、联合增菌液(北京良润生物科技有限公司);DNA提取液:含0.5mol/L Tris-HCl、0.05mol/L 乙二胺四乙酸二钠、0.5%TritonX-100;10×Buffer反应缓冲液:含200mmol/L Tris-HCl(pH8.8,25℃),100mmol/LKCl,100mmol/L(NH4)2SO4,20mmol/L MgSO4,1% Triton X-100。
1.2 方法
1.2.1 引物设计 根据金黄色葡萄球菌的femA基因的保守区域,利用生物学在线软件分析该基因的核苷酸序列,结合环介导等温扩增方法的引物设计原则,用Primer Explorer V4.0在线引物设计软件筛选并合成LAMP引物:内引物1、外引物1、内引物2、外引物2,见表1。

表1 金黄色葡萄球菌LAMP引物序列
1.2.2 待检样品的处理、增菌 按照中华人民共和国国家标准GB 4789.10-2016《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》中指定的方法对待检样品进行处理及增菌培养。
1.2.3 模板DNA的制备 (1)增菌液模板DNA的制备:取制备的待检样品增菌培养液1ml于1.5ml离心管中,10000r/min离心2min,弃上清;滴加100μl DNA提取液,入沸水浴10min;10000r/ min离心2min,上清即为模板DNA。(2)可疑菌落模板DNA的制备:分离挑取单菌落,加入到100μl DNA提取液中,振荡混匀,沸水浴10min;10000r/min离心2min,上清即为模板DNA。
1.2.4 LAMP检测方法的建立 金黄色葡萄球菌LAMP反应体系见表2。
将配制好的反应液上方覆盖适量灭菌液体石蜡隔绝污染,并做阴性、阳性对照,其中阴性对照为DNA提取液,阳性对照为金黄色葡萄球菌标准菌株DNA提取物。将25μl LAMP反应体系配制成反应液后,65℃扩增60min。扩增完成后加入1~2µl 1000×SYBR Green I,混匀,肉眼观察颜色反应。在自然光下肉眼观察显色情况,在阴性对照呈橙色、阳性对照呈绿色的前提下,待检样品呈绿色判为阳性,即检测样品中含有金黄色葡萄球菌;待检样品呈橙色判为阴性,即检测样品中不含有金黄色葡萄球菌。若阴阳性对照与前述情况不符,则检测结果无效,应重新检测。
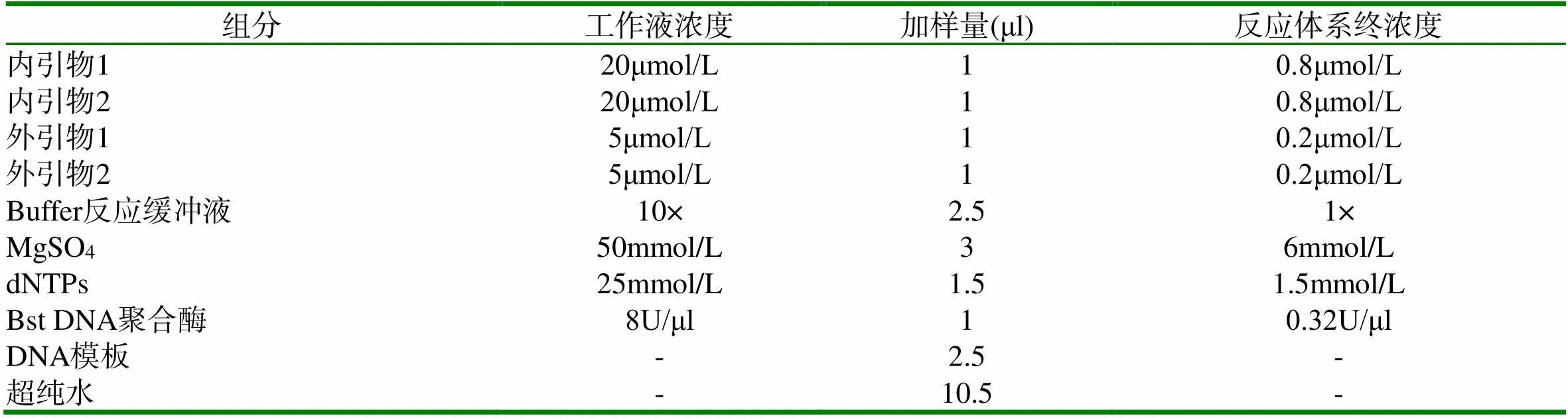
表2 金黄色葡萄球菌LAMP反应体系
1.2.5 特异性试验 分别对常见的21种食源性致病菌菌株及同源性高的菌株进行检测,同时设置金黄色葡萄球菌DNA为阳性对照,DNA提取液为阴性对照,每个样品重复2次。
1.2.6 敏感性试验 取计数后菌液进行10倍倍比稀释后,用建立的LAMP检测方法分别对其进行检测。
1.2.7 LAMP检测方法与国标检测方法的符合性试验 使用不同浓度的金黄色葡萄球菌处理猪肉、水饺、肉松、巴氏消毒奶、奶粉为样品,采用所建立的LAMP检测方法与中华人民共和国国家标准GB 4789.10-2016《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》中指定的方法同时进行检测,比较两种方法的检测结果,每个样品3次重复,并设立阴、阳性对照。
2 结果与分析
2.1 LAMP检测方法特异性试验结果
对21种常见致病菌的检测结果中金黄色葡萄球菌显示阳性结果,其余均为阴性,表明本研究建立的金黄色葡萄球菌LAMP检测方法具有良好的特异性。
2.2 LAMP检测方法敏感性试验结果
对102~105CFU/ml菌落数的金黄色葡萄球菌LAMP检测方法敏感性试验结果如下表4所示,当金黄色葡萄球菌浓度为102CFU/ml时即可呈现阳性反应。但由于模板提取、稀释误差等原因,灵敏度数量级可能为103CFU/mL,因此,认定该方法对金黄色葡萄球菌菌液检测的最低检出浓度为102~103CFU/ml。
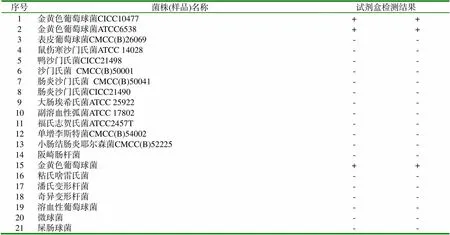
表3 特异性试验结果
注:“+”代表阳性,“-”代表阴性。

表4 敏感性试验结果
注:“+”代表阳性;“-”代表阴性;“-(+/-)”代表阴阳性结果均会出现,判定阴性。
2.3 与国标检测方法的符合性试验结果
选择猪肉、水饺、肉松、巴士消毒奶、奶粉为样品,使用不同浓度的金黄色葡萄球菌对其进行添加,三组重复试验结果如下表5。不同样品的LAMP方法检测结果与国标方法一致,两者符合率为100%。

表5 金黄色葡萄球菌核酸检测方法与国标方法检测结果
注:“+”代表阳性;“-”代表阴性。
3 讨论
(1)LAMP技术在60~65℃的恒温条件下反应30~60min即可完成基因的扩增,生成由一系列反向重复的目的基因构成的DNA片段环状混合物[13],可有效减少繁琐的人员操作且无需昂贵的试验仪器。而选用无毒的SYBR greenI染色代替电泳,避免对操作人员的伤害和对环境的污染,且实现了样本DNA产物的可视化检测;无须DNA模板的热变性过程,使原本至少90min才能完成的扩增反应,缩减到30min,有效节约检测时间[14]。(2)本研究将LAMP方法应用于食品安全检测方面,可对食品中金黄色葡萄球菌进行定性定量检测,最低检出浓度为102~103CFU/ml,灵敏度和特异性较好。但LAMP方法在应用的同时也出现了一些值得注意的方面:一是在引物设计方面,由于是在线软件进行设计,且针对较短靶序列中的6~8个区域设计4~6条引物,导致了一些扩增效率较高的其他靶位点容易被忽略[15],如本研究中选用的是金黄色葡萄菌的femA基因,是在对金黄色葡萄菌nuc基因的前期研究基础上改良的结果;二是由于LAMP体系扩增效率极高,且产物稳定,不易降解,易发生携带污染,致使假阳性结果的出现[16];三是LAMP体系极易被污染,开管操作应在单独操作室内进行,避免被微量污染物污染。当仅用比浊和比色法确定LAMP反应结果时,由于个体对颜色的主观感知不同,结果可能会出现偏差[17]。因此,在实际应用中,应结合配套读数仪器进行定性定量分析。
本研究根据金黄色葡萄球菌的femA基因设计的特异性引物能准确结合目的基因,建立的金黄色葡萄球菌核酸检测方法,通过添加SYBR Green I染色实现结果可视化、快速高效、高灵敏度和高特异性检测,适用于各层级实验室和基层单位的普及和推广。
[1] FETSCH A, JOHLER S. Staphylococcus aureus as a food bornepathogen[J]. Current Clinical Microbiology Reports, 2018, 5(2): 88-96.
[2] 郭建平, 万佳佳, 陆兆新等. 基于可视化环介导等温扩增技术快速检测金黄色葡萄球菌[J]. 食品科学, 2019, 6(4): 1-10.
[3] 刘晓慧, 郭凤柳, 贾月梅等. 金黄色葡萄球菌在蔬菜中生长状况分析[J]. 江苏农业科学, 2015, 43(8): 304-307.
[4] Kumar S, Mittal G S. Rapid Detection of Microorganisms Using Image Processing Parameters and Neural Network[J]. Food and Bioprocess Technology, 2010, 3(5): 741-751.
[5] 于颖. 实时荧光LAMP技术检测牛乳中金黄色葡萄球菌的研究[D]. 河北农业大学: 保定, 2015: 1-2.
[6] 陈建琳, 刘明辉. 细菌性食物中毒流行趋势及预防对策[J]. 中国卫生检验杂志, 2002, 12(4): 481.
[7] 杨平. 食品中4种致病微生物的多联PCR快速检测技术研究[D]. 重庆大学: 重庆, 2007.
[8] GB 29921-201 食品安全国家标准, 食品中致病菌限量[S].
[9] GB 4789.10-2010食品微生物学检验, 金黄色葡萄球菌检验[S]. 2010.
[10] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63.
[11] 戴婷婷, 陆辰晨, 郑小波. 环介导等温扩增技术在病原物检测上的应用研究进展[J]. 南京农业大学学报, 2015, 38(5): 695-703.
[12] Zipper H, Brunner H, emhagen J, et al. Investigations on DNA interclation and thesurface binding by SYBR Green I its structure determination and methodological implications[J]. Nucleic Acids Research, 2004, 32(12): e103.
[13] Notomi T, Mori Y, Tomita N, et al. Loop- mediated isothermal amplification(LAMP): principle, features,and future prospects[J]. J Microbiol, 2015, 53(1): 1-5.
[14]徐美迪, 木兰, 牛超. 环介导等温扩增技术在致病微生物检测中的应用[J]. 生物技术通讯, 2019, 30(01): 140-146.
[15] Dhama K, Karthik K, Chakraborty S, et al. Loop-medi ated isothermal amplification of DNA(LAMP): a new diagnostic tool lights the world of diagnosis of animal and human pathogens: a review[J]. Pak J Biol Sci, 2014, 17(2): 151-166.
[16] Fischbach J, Xander N C, Frohme M, et al. Shining a light on LAMP assays-a comparison of LAMP visu alization methods including the novel use of berberine[J]. Biotechniques, 2015, 58(4): 189-194.
[17] Bista B R, Ishwad C, Wadowsky R M, et al. Develop ment of a loop-mediated isothermal amplification assay for rapid detection of BK virus[J]. J Clin Microbiol, 2007, 45(5): 1581-1587.
(2019–10–15)
S852.61+1
A
1007-1733(2019)12-0007-04

