白术多糖对肺癌模型大鼠免疫功能的调节作用及机制研究
银瑞,王俊钢
论著
白术多糖对肺癌模型大鼠免疫功能的调节作用及机制研究
银瑞,王俊钢
研究白术多糖对肺癌模型大鼠免疫相关因子及癌细胞增殖凋亡的影响,探讨其肿瘤抑制机制。
观察记录不同给药剂量20、50、80 mg/(kg·d)白术多糖对肺癌模型大鼠肺指数、脾脏指数、胸腺指数的影响。全自动血细胞分析仪检测大鼠外周血中白细胞和溶菌酶含量。ELISA 法检测大鼠血清中 IgG、IgA、IgM 水平。流式细胞仪分析 T 淋巴细胞亚群 CD3+、CD4+、CD8+比例。MTT 法和 Annexin V-FITC/PI 双染法分别检测癌细胞增殖和凋亡。
与模型组相比,白术多糖各剂量组大鼠肺指数均下降(< 0.01),脾脏和胸腺指数上升(< 0.01),大鼠外周血中白细胞和溶菌酶含量升高(< 0.01),且均呈剂量依赖性。ELISA 法和流式细胞仪分析结果显示,白术多糖给药组大鼠血清免疫球蛋白 IgG、IgA、IgM 水平和 T 淋巴细胞亚群 CD3+、CD4+、CD4+/CD8+水平呈剂量依赖性升高(< 0.01)。MTT 法和 Annexin V-FITC/PI 双染法检测结果表明,对比模型组,白术多糖各剂量组肺癌模型大鼠癌细胞增殖率降低(< 0.01),细胞凋亡率增大(< 0.01)。
白术多糖能够增强肺癌模型大鼠机体免疫功能,抑制癌细胞增殖并诱导凋亡。
肺肿瘤; 免疫球蛋白类; T 淋巴细胞; 白术多糖
2018 年,肺癌新发病例数约为 209 万,死亡病例数约为176 万,是全球第一大恶性肿瘤[1],其恶性程度较高,易浸润转移,多数患者就诊时被确诊为晚期,预后效果差,发病率和死亡率呈上升趋势[2-3]。手术治疗、放疗、化疗、靶向治疗、姑息治疗等多种现代医学治疗手段在肺癌的临床治疗中发挥作用,但器官功能受损、耐药、肿瘤转移等不良反应导致死亡率仍居高不下[4-5]。提高患者免疫力对改善生活质量、延长患者生存期、抑制肿瘤生长具有积极意义[6]。白术()是一种天然中草药,在我国江苏、福建、四川、安徽等地均有分布,可用于治疗水肿、脾虚、腹泻等症,其水溶性多糖是白术的重要组成成分,能够提高机体免疫力,抑制肿瘤生长[7-8]。已有研究表明,白术多糖能够抑制神经胶质瘤细胞增殖,减缓癌症发展[9],但其在肺癌中的作用尚未报道。本文将建立大鼠肺癌模型,观察白术多糖给药后免疫球蛋白、T 淋巴细胞亚群、白细胞水平及癌细胞增殖、凋亡情况,探讨白术多糖对肺癌模型大鼠免疫力及肿瘤生长的影响。
1 材料与方法
1.1 材料
Wistar 大鼠共 60 只,体质量(150 ± 30)g,雌雄各半,购自南京君科生物工程有限公司;白术多糖购自陕西慈缘生物技术有限公司;微球菌购自ELISA 试剂盒购自美国 BioLegend 公司;MTT 细胞增殖检测试剂盒购自美国 Abcam 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自江苏凯基生物技术有限公司;水合氯醛购自青岛宇龙海藻有限公司;胰蛋白酶、PBS 购自美国 Sigma 公司;迈瑞BC-5180 全自动血细胞分析仪购自武汉盛世达医疗设备有限公司;流式细胞仪购自美国 BD 公司。
1.2 方法
1.2.1 造模与分组 60 只 Wistar 大鼠常规饲养 1 周后,随机选取 12 只作为对照组,其余48只参考文献[10]肺癌模型建立方法造模,每只实验大鼠肌肉注射青霉素钠 5 万单位和链霉素 50 mg,预防肺部感染。水合氯醛麻醉后,将大鼠置于活动操作台上,调整合适的角度,使大鼠自然仰卧并用台面上方的固定线挂住大鼠上颌门齿。鸭咀镊将舌轻轻拉出,弹性金属弯形压舌板轻轻压舌根,暴露喉头。趁大鼠吸气时在额镜直视下将吸有药物的钝头注射针通过声门轻轻插至气管分叉处,然后轻轻向右下方斜插入心后叶的肺支气管内,缓缓注入致癌碘油,肺内可见碘油为灌注成功。建模成功后,将实验大鼠随机分为模型(NS)组、白术多糖低、中、高剂量组,每组 12 只。白术多糖低、中、高剂量组大鼠分别按 20、50、80 mg/(kg·d) 给药并标记为 BZ1 组、BZ2 组、BZ3 组,NS 组给予等体积生理盐水,每周给药 5 d,连续 16 周,给药结束后以麻醉法处死大鼠。
1.2.2 各组大鼠肺、脾脏、胸腺指数变化 给药结束处死大鼠后,称取各组大鼠体重及其肺、脾脏、胸腺重量并记录,于–80 ℃保存,计算肺、脾脏、胸腺指数。肺、脾脏、胸腺指数 = 肺、脾脏、胸腺重量(mg)÷ 大鼠体重(g)。
1.2.3 大鼠外周血中白细胞和溶菌酶含量测定 采集各组大鼠外周血,全自动血细胞分析仪进行白细胞计数。大鼠外周血以 3000 r/min 离心 10 min,取上清。适量微球菌悬液与 LB 培养基混匀后倒平板,平板凝固后以无菌打孔器打孔,孔内加入上清液稀释液,每个样品重复 3 次,置于37 ℃恒温保湿箱 24 h。测量溶菌环直径,计算溶菌酶含量。
1.2.4 大鼠血清 IgG、IgA、IgM 水平检测 将麻醉后的大鼠腹部向上固定在操作台上,剪开皮肤,暴露腹腔。手持穿刺针 30° 斜向下刺入主动脉,抽取血液,2000 r/min 离心 15 min,收集血清,–20 ℃保存。ELISA 法检测大鼠血清中 IgG、IgA、IgM水平。
1.2.5 大鼠外周血 CD3+、CD4+、CD8+水平检测 取 100 μl 大鼠全血,加入含相应抗体的 EP 管中,4 ℃暗室孵育 30 min,加入红细胞裂解液,混匀后避光静置 10 min,加入 500 μl PBS 洗涤两次,离心弃上清。2% 多聚甲醛固定,流式细胞仪分析 T 淋巴细胞亚群 CD3+、CD4+、CD8+比例。
1.2.6 MTT 法检测肺癌模型大鼠癌细胞增殖 取适量肺癌组织,剪碎,1% 胰酶消化30 min,反复吹打,流式细胞仪分选纯化细胞系,制成细胞悬液。取适量细胞悬液接种于 96 孔板,于 37 ℃、5% CO2条件下培养 48 h,加入 20 μl MTT(5 mg/ml),继续培养 4 h,吸除培养液后加入 150 μl DMSO,振荡反应 10 min,酶标仪检测 490 nm 处吸光度()值。
1.2.7 肺癌模型大鼠癌细胞凋亡检测 细胞悬液离心后收集细胞,加入 100 μl 1 × binding buffer 重悬细胞,按照 Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书依次加入 5 μl Annexin V-FITC 和 10 μl PI,轻轻混匀,避光反应 15 min,流式细胞仪检测细胞凋亡。
1.3 统计学处理

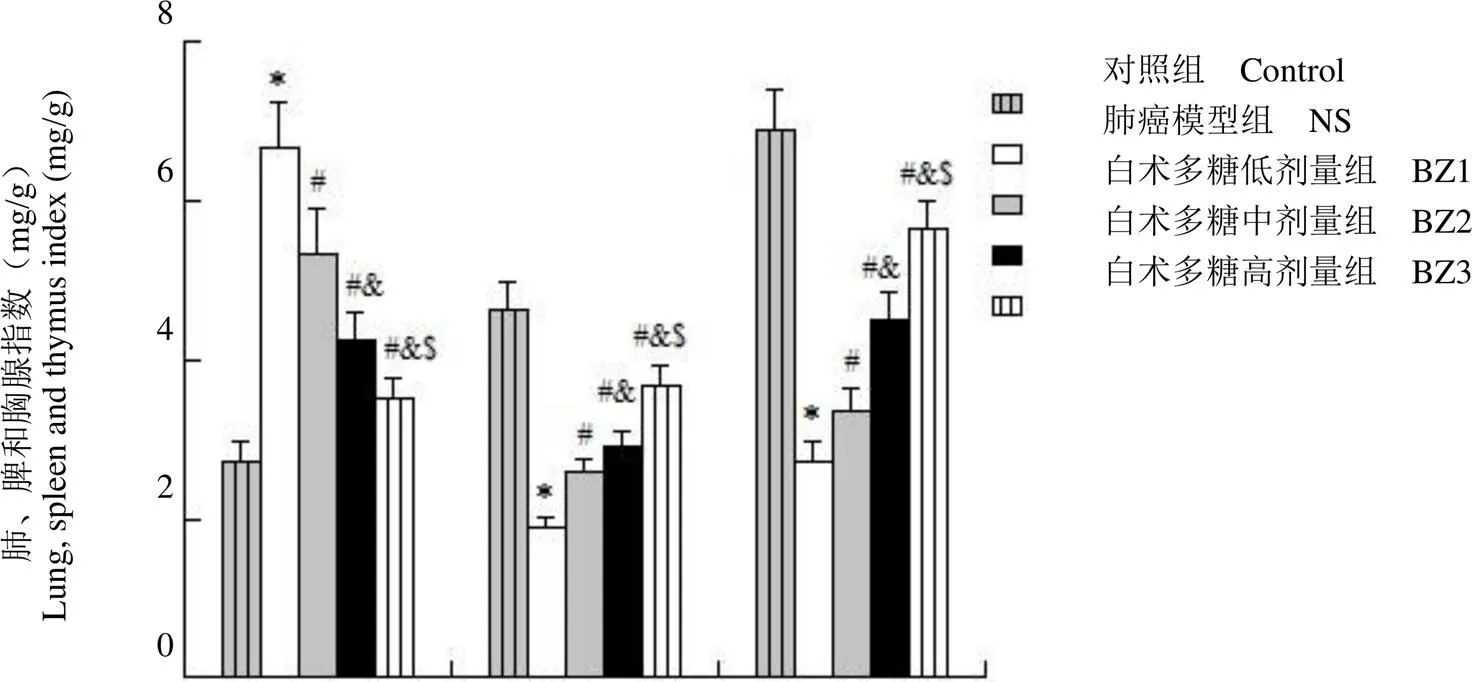
图1 白术多糖对肺癌模型大鼠肺、脾和胸腺指数的影响(与对照组相比,*P < 0.01;与NS 组相比,#P < 0.01;与 BZ1组相比,&P < 0.01;与 BZ2 组相比,$P < 0.01)
Figure 1 Effect of Atractylodes macrocephala L. polysaccharide on lung index, spleen and thymus index in lung cancer model rats (*< 0.01 compared with control group;#< 0.01 compared with NS group;&< 0.01 compared with BZ1 group;$< 0.01 compared with the BZ2 group)
2 结果
2.1 白术多糖对肺癌模型大鼠肺、脾和胸腺指数的影响
称量大鼠肺叶重量并计算肺指数,结果如图 1 显示,与对照组相比,NS 组、白术多糖给药各组大鼠肺指数上升,脾和胸腺指数下降;与 NS 组相比,白术多糖给药各组大鼠肺指数下降,脾和胸腺指数上升;与 BZ1 组相比,BZ2、BZ3 大鼠肺指数下降,脾和胸腺指数上升;与 BZ2 组相比,BZ3 大鼠肺指数下降,脾和胸腺指数上升(< 0.01)。
2.2 白术多糖对肺癌模型大鼠外周血中白细胞和溶菌酶含量的影响
白术多糖给药后,各组大鼠外周血中白细胞和溶菌酶含量低于对照组;与 NS 组相比,白术多糖给药各组大鼠外周血中白细胞和溶菌酶含量升高;与BZ1 组相比,BZ2、BZ3 大鼠外周血中白细胞和溶菌酶含量升高;与 BZ2 组相比,BZ3 大鼠外周血中白细胞和溶菌酶含量升高(< 0.01)(图2)。
2.3 白术多糖对肺癌模型大鼠血清 IgG、IgA、IgM 水平的影响
采用 ELISA 法检测大鼠血清 IgG、IgA、IgM 水平,结果如图 3 所示,与 NS 组相比,不同剂量白术多糖给药后,大鼠血清 IgG、IgA、IgM 水平上升(< 0.01),呈剂量依赖性。
2.4 白术多糖对肺癌模型大鼠外周血 CD3+、CD4+、CD8+水平的影响
流式细胞仪分析显示,白术多糖给药(BZ1、BZ2、BZ3)的肺癌模型大鼠外周血 CD3+、CD4+细胞和CD4+/CD8+比值明显高于NS 组(< 0.01)而 CD8+细胞低于NS 组(< 0.01),均呈剂量依赖性(图4)。
2.5 白术多糖对肺癌模型大鼠癌细胞增殖和凋亡的影响
分别采用 MTT 和 Annexin V-FITC/PI 双染法检测细胞增殖和凋亡检测,结果如图5 所示,与 NS 组相比,白术多糖各组(BZ1、BZ2、BZ3)肺癌模型大鼠癌细胞培养 48 和 72 h 后,其增殖率明显降低(< 0.01),细胞凋亡率增大(< 0.01)。
3 讨论
肺癌的发生与吸烟、室内环境污染、呼吸系统疾病等因素有关,据我国癌症登记数据显示,肺癌的发病率和死亡率均逐年上升,严重危害人体健康及生命安全,已被列为重点防治癌症之一[11]。中药治疗是中国传统治疗方式,能够减轻患者病痛、延长患者生存期、改善生活质量,提高免疫系统功能,已成为目前研究的热点[12]。姜黄素可通过调节 Wnt 信号通路、NF-κB/AKT 通路等多种途径,影响肺癌细胞增殖、凋亡及耐药性[13-14];紫杉醇、喜树碱可调节癌细胞周期,破坏微管功能,从而抑制细胞增殖和血管生成,诱导细胞凋亡[15-16]。

图 2 白术多糖对肺癌模型大鼠外周血中白细胞(A)和溶菌酶(B)含量的影响(与对照组相比,*P < 0.01;与NS 组相比,#P < 0.01;与 BZ1组相比,&P < 0.01;与 BZ2 组相比,$P < 0.01)
Figure 2 Effect of Atractylodes macrocephala L. polysaccharide on WBC (A) and lysozyme (B) content in peripheral blood of lung cancer model rats (*< 0.01 compared with control group;#< 0.01 compared with NS group;&< 0.01 compared with the BZ1 group;$< 0.01compared with the BZ2 group)
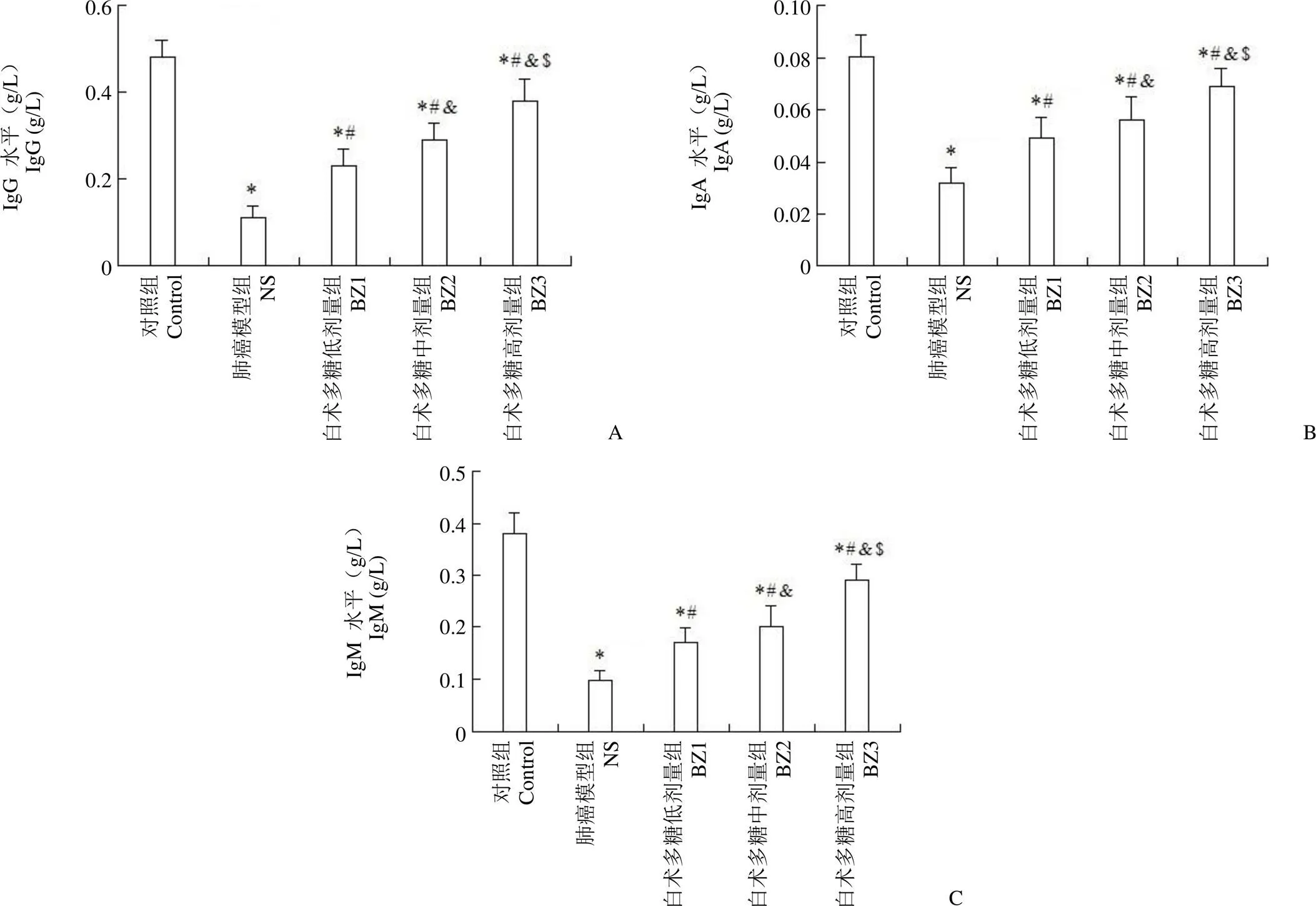
图 3 白术多糖对肺癌模型大鼠血清IgG(A)、IgA(B)、IgM(C)水平的影响(与对照组相比,*P < 0.01;与NS 组相比,#P < 0.01;与 BZ1组相比,&P < 0.01;与 BZ2 组相比,$P < 0.01)
Figure 3 Effect of Atractylodes macrocephala L. polysaccharide on serum IgG (A), IgA (B) and IgM (C) levels in lung cancer model rats (*< 0.01 compared with control group;#< 0.01 compared with NS group;&< 0.01 compared with BZ1 group;$< 0.01 compared with the BZ2 group)
白术多糖在临床应用中对患者毒副作用小,无残留;可增加脾脏和胸腺重量,促进淋巴细胞增殖,提高单核吞噬细胞吞噬率,诱导 IL-1、IL-2、IL-6 等免疫分子分泌,同时对树突状细胞表面分子表达及吞噬能力具有促进作用,提高抗体分子 IgG 和 IgM 抗体水平,发挥免疫调节作用,改善机体免疫功能,抑制肿瘤细胞增殖并诱导凋亡[17-19]。李鹏等[20]以白术多糖对小鼠灌胃,小鼠淋巴细胞转化能力及巨噬细胞吞噬活性增强,提高机体免疫能力。此外,白术多糖能够调节血清中 VEGF 水平,增强机体免疫力,调节凋亡相关蛋白表达,诱导胃癌细胞凋亡,发挥抑癌作用[21-22]。本研究以不同剂量白术多糖给药肺癌模型大鼠,发现对比 NS 组,给药各组大鼠肺指数下降,主要免疫器官脾脏和胸腺指数增大,白细胞和溶菌酶含量升高,且均呈剂量依赖性。
免疫球蛋白普遍存在于外分泌液、组织液和血液中,是一种具有抗体活性的糖蛋白分子,其中 IgG、IgA、IgM 是主要测量指标。IgG 是血清免疫球蛋白的主要抗体成分,多种抗病原菌、病毒抗体属于 IgG[23]。IgA 主要通过黏膜输出,可与周围淋巴细胞、浆细胞组成局部免疫系统,抵御病原微生物[24]。IgM 分子量较大,不能通过血管壁,可用于机体感染早期诊断。T 细胞亚群是主要的细胞免疫应答形式,其免疫调节作用主要通过 CD4+和 CD8+完成,CD4+可分化产生抗体,诱导有效免疫反应的作用;CD8+则抑制 T 细胞增殖、抗体合成和分泌,CD4+/CD8+比值的稳定能维持机体的有效免疫应答[25-26]。有研究发现,在恶性肿瘤患者外周血中,CD3+、CD4+、CD8+和 CD4+/CD8+水平下降,机体免疫功能普遍下降,表明肿瘤的发生发展可能与免疫应答有关[27-28]。本文在不同剂量组白术多糖给药的肺癌模型大鼠血中,免疫球蛋白IgG、IgA、IgM 和 T 细胞亚群 CD3+、CD4+和 CD4+/CD8+水平上升(< 0.01),表明白术多糖能够提高肺癌模型大鼠免疫功能。进一步检测癌细胞增殖和凋亡情况,发现白术多糖能剂量依赖性抑制癌细胞增殖并诱导凋亡。这一试验结果有望为改善肺癌的临床治疗提供新靶点。

图 4 白术多糖对肺癌模型大鼠外周血CD3+(A)、CD4+(B)、CD8+(C)和CD4+/CD8+(D)水平的影响(与对照组相比,*P < 0.01;与NS 组相比,#P < 0.01;与 BZ1组相比,&P < 0.01;与 BZ2 组相比,$P < 0.01)
Figure 4 Effect of Atractylodes macrocephala L. polysaccharide on CD3+(A), CD4+(B), CD8+(C) and CD4+/CD8+(D) levels in peripheral blood of lung cancer model rats (*< 0.01 compared with control group;#< 0.01 compared with NS group;&< 0.01 compared with BZ1 group;$< 0.01 compared with the BZ2 group)

图 5 白术多糖对肺癌模型大鼠癌细胞增殖(A)和凋亡(B)的影响(与NS 组相比,*P < 0.01;与 BZ1组相比,#P < 0.01;与 BZ2 组相比,&P < 0.01)
Figure 5 Effect of Atractylodes macrocephala L. polysaccharide on proliferation (A) and apoptosis (B) of cancer cells in lung cancer model rats (*< 0.01 compared with NS group;#< 0.01 compared with BZ1 group;&< 0.01 compared with BZ2 group)
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018, 68(6):394-424.
[2] Harpole DH Jr, Herndon JE 2nd, Young WG Jr, et al. Stage I nonsmall cell lung cancer. A multivariate analysis of treatment methods and patterns of recurrence. Cancer, 2015, 76(5):787-796.
[3] Travis WD, Travis LB, Devesa SS. Lung cancer. Cancer, 2015,75(1 Suppl):191-202.
[4] Anandappa G, Popat S. Management of lung cancer. Medicine, 2016, 44(4):244-248.
[5] Wang BQ, Wang XH, Li ZG. Research progress in traditional Chinese medicine treatment of lung cancer. China J Chin Med, 2018, 33(3): 371-374. (in Chinese)
王保芹, 王心恒, 李泽庚. 中医药治疗肺癌研究进展. 中医学报, 2018, 33(3):371-374.
[6] Wei D, Yu F, Chen J. Clinical effect of ribonucleic acid on improving immunity and quality of life in patients with advanced lung cancer. Clin Res Pract, 2018, 3(20):22-23. (in Chinese)
魏丹, 于菲, 陈娟. 核糖核酸在提高晚期肺癌患者免疫力、改善生存质量中的临床效果. 临床医学研究与实践, 2018, 3(20):22-23.
[7] Huang HL, Lin TW, Huang YL, et al. Induction of apoptosis and differentiation by atractylenolide-1 isolated from Atractylodes macrocephala in human leukemia cells. Bioorg Med Chem Lett, 2016, 26(8):1905-1909.
[8] Yue MY, Pan Y, Ao H. Advance on the chemical, pharmacological and clinical of atractylodes macrocephala koidz. Asia Pac Traditional Med, 2016, 12(5):66-68. (in Chinese)
岳美颖, 潘媛, 敖慧. 白术化学、药理与临床研究进展. 亚太传统医药, 2016, 12(5):66-68.
[9] Li X, Liu F, Li Z, et al. Atractylodes macrocephala polysaccharides induces mitochondrial mediated apoptosis in glioma C6 cells. Int
J Biol Macromol, 2014, 66(5):108-112.
[10] Tian HS, Liu MQ, Gao WQ, et al. A methodological study on the establishment of an animal lung cancer model -- II. A new method of lung cancer induced by intrabronchial infusion of carcinogenic iodine oil solution in rats. Cancer Res Prev Treat, 1982, 9(1):2-4, 61-62. (in Chinese)
田鸿生, 刘铭球, 高文琴, 等. 建立动物肺癌模型的方法学研究——II.肺叶支气管内灌注致癌质碘油溶液诱发大白鼠肺癌的新方法. 肿瘤防治研究, 1982, 9(1):2-4, 61-62.
[11] Chen WQ, Zuo TT, Zheng RS, et al. Lung cancer incidence and mortality in China in 2013. Chin J Oncol, 2017, 39(10):795-800. (in Chinese)
陈万青, 左婷婷, 郑荣寿, 等. 2013年中国肺癌发病与死亡分析. 中华肿瘤杂志, 2017, 39(10):795-800.
[12] Tseng CY, Lin CH, Wu LY, et al. Potential combinational anti-cancer therapy in non- small cell lung cancer with traditional Chinese medicine sun-bai-pi extract and cisplatin. PLoS One, 2016, 11(5):e0155469.
[13] Zhu JY, Yang X, Chen Y, et al. Curcumin suppresses lung cancer stem cells via inhibiting Wnt/β-catenin and Sonic Hedgehog pathways. Phytother Res, 2017, 31(4):680-688.
[14] Ai Y, Zhu B, Ren C, et al. Discovery of new monocarbonyl ligustrazine-curcumin hybrids for intervention of drug-sensitive and drug-resistant lung cancer. J Med Chem, 2016, 59(5):1747-1760.
[15] Chen K, Shi W. Autophagy regulates resistance of non-small cell lung cancer cells to paclitaxel. Tumor Biology, 2016, 37(8):10539-10544.
[16] Hariri G, Edwards AD, Merrill TB, et al. Sequential targeted delivery of paclitaxel and camptothecin using a cross-linked "nanosponge" network for lung cancer chemotherapy. Mol Pharm, 2014, 11(1):265- 275.
[17] Fan W, Zhang S, Pan H, et al. Structure characterization of three polysaccharides and a comparative study of their immunomodulatory activities on chicken macrophage. Carbohydr Polym, 2016, 153:631- 640.
[18] Xu D, Tian Y. Selenium and polysaccharides of atractylodes macrocephala koidz play different roles in improving the immune response induced by heat stress in chickens. Biol Trace Elem Res, 2015, 168(1):235-241.
[19] Yang JT, Cheng X, Chen HW, et al. Advances in the mechanism of polysaccharide immunization in atractylodes macrocephala koidz. Chin J Vet Drug, 2018, 52(6):80-85. (in Chinese)
杨锦涛, 程希, 陈红伟, 等. 白术多糖免疫调节作用机制的研究进展. 中国兽药杂志, 2018, 52(6):80-85.
[20] Li P, He S, Zhu HX, et al. Effect of Atractylodes macrocephala L. on immunomodulation in mice. Cardiovasc Dis J Integr Traditional Chin West Med (Electron), 2016, 4(32):95. (in Chinese)
李鹏, 贺颂, 朱鸿翔, 等. 白术多糖对小鼠免疫调节作用的影响. 中西医结合心血管病电子杂志, 2016, 4(32):95.
[21] Zhou J, Su DC, Song GQ. Experimental study on anti-tumor effect of Atractylodes macrocephala L. on H22 liver cancer mice. Asia Pac Traditional Med, 2015, 11(17):9-10. (in Chinese)
周剑, 苏德春, 宋国权. 白术多糖对H22肝癌小鼠抗肿瘤作用实验研究. 亚太传统医药, 2015, 11(17):9-10.
[22] Wang H, Chen YJ, Zhang ZH. Effect of Atractylodes polysaccharides on apoptosis of gastric cancer cell line SGC-7901. Chin J Ethnomed Ethnopharm, 2015, 24(24):10-11. (in Chinese)
王鹤, 陈拥军, 张中华. 白术多糖对胃癌细胞SGC-7901凋亡的影响. 中国民族民间医药, 2015, 24(24):10-11.
[23] Liu H, May K. Disulfide bond structures of IgG molecules: structural variations, chemical modifications and possible impacts to stability and biological function. MAbs, 2016, 4(1):17-23.
[24] Macpherson AJ, Mccoy KD, Johansen FE, et al. The immune geography of IgA induction and function. Mucosal Immunol, 2008, 1(1):11-22.
[25] Kara EE, Comerford I, Fenix KA, et al. Tailored immune responses: novel effector helper t cell subsets in protective immunity. PLoS Pathog, 2014, 10(2):e1003905.
[26] Kawamoto K, Nakamura S, Iwashita A, et al. Clinicopathological characteristics of primary gastric T-cell lymphoma. Histopathology, 2009, 55(6):641-653.
[27] Yu DP, Han Y, Zhao QY, et al. CD3+ CD4+ and CD3+ CD8+ lymphocyte subgroups and their surface receptors NKG2D and NKG2A in patients with non-small cell lung cancer. Asian PacJ Cancer Prev, 2013, 15(6):2685-2688.
[28] Ye W, Liu SF, Nie AL. Comparative analysis of expression levels in patiens with gastric cancer cells perioperative peripheral blood T cell subsets (CD3+, CD4+, CD8+) and NK (CD16+ CD56+). Chin Community Dr, 2014, 30(36):167-169. (in Chinese)
叶文, 刘诗富, 聂爱俐. 胃癌患者围手术期外周血T细胞亚群(CD3+、CD4+、CD8+)及NK(CD16+ CD56+)细胞表达水平的比较分析. 中国社区医师, 2014, 30(36):167-169.
Regulation and mechanism of Atractylodes macrocephala L. polysaccharide on immune function in lung cancer model rats
YIN Rui, WANG Jun-gang
000
To explore the effect and mechanism of Atractylodes macrocephala L. polysaccharide on immune factors, cell proliferation and apoptosis in lung cancer model rats.
The effect of different doses of Atractylodes macrocephala L. polysaccharide 20, 50, 80 mg/(kg·d) on lung index, spleen index and thymus index in lung cancer model rats were recorded. White blood cells and lysozyme in peripheral blood of rats were detected by automatic blood cell analyzer. IgG, IgA and IgM in rat serum were detected by ELISA. The ratio of CD3+, CD4+and CD8+was analyzed by flow cytometry. Cell proliferation and apoptosis were detected by MTT and Annexin V-FITC/PI double staining assay, respectively.
As compared with NS (model group) group, the lung index was decreased (< 0.01) while the spleen, thymus index, leukocytes and lysozyme in rats were increased (< 0.01) of Atractylodes macrocephala L. polysaccharide in each dose group. The result of ELISA and flow cytometry showed that serum immune globulin IgG, IgA, IgM and T lymphocyte subsets CD3+, CD4+, CD4+/CD8+were increased in a dose-dependent manner (< 0.01) in rats treated with Atractylodes macrocephala L. polysaccharide. The results of MTT assay and Annexin V-FITC/PI double staining showed that cell proliferation rate was decreased (< 0.01) and apoptosis rate was increased (< 0.01) of BZ1 group, BZ2 group and BZ3 group.
Atractylodes macrocephala L. polysaccharide enhances the immunologic function of lung cancer model rats, inhibits cell proliferation and induces apoptosis.
Lung neoplasms; Immunoglobulins; T-lymphocytes; Atractylodes macrocephala L. polysaccharide
YIN Rui, Email: 155203699@qq.com
Author Affiliation: Department of Thoracic Surgery, NanYang Central Hospital, Henan 473000, China
10.3969/j.issn.1673-713X.2019.06.009
473000 河南,南阳市中心医院胸外科
银瑞,Email:155203699@qq.com
2019-07-29

