谷子抗锈病反应相关MYB转录因子的鉴定与表达
白辉,宋振君,王永芳,全建章,马继芳,刘磊,李志勇,董志平
谷子抗锈病反应相关MYB转录因子的鉴定与表达
白辉1,宋振君2,王永芳1,全建章1,马继芳1,刘磊1,李志勇1,董志平1
(1河北省农林科学院谷子研究所/国家谷子改良中心/河北省杂粮重点实验室,石家庄 050035;2上海电子信息职业技术学院通信与信息工程学院,上海 201411)
【】谷子锈病是影响其产量和品质的重要因素之一。鉴定谷子抗锈病相关的MYB转录因子,为谷子抗锈病机理研究奠定基础。利用real-time PCR技术,检测9个SiMYBs转录因子基因在(1)谷子孕穗期根、茎、叶和穗4个部位的表达情况,(2)在谷子抗(resistance,R)、感(susceptibility,S)锈病反应120 h内的表达丰度差异,(3)在植株外接水杨酸(salicylic acid,SA)和茉莉酸甲酯(methyl jasmonate,MeJA)后24 h内的表达变化;比较SiMYBs基因在谷子R、S、SA与MeJA 4种反应中的表达模式;选择抗病相关SiMYBs基因进行转录激活活性检测和亚细胞定位。在叶部表达量最高,其余8个基因均在根部表达量最高,最显著。5个基因的表达与抗病相关:和受锈菌侵染诱导表达,抗病反应早期的表达量明显高于感病反应;和在抗病反应早期下调表达,后期上升至接种前,而感病反应中保持低水平表达;在接种后的48 h内,抗病、感病反应表达模式相反。在响应外源激素SA和MeJA反应中,SiMYBs基因的表达量均发生不同程度的变化。4个基因(、、和)在R、SA与MeJA反应中的表达模式一致,不同于S反应。5个抗病相关SiMYBs基因具有转录激活活性,其编码蛋白质定位于细胞核中。鉴定到、、、和5个基因的表达与谷子抗锈病相关;与在谷子生长发育和抗病过程中都发挥一定的功能;、、和4个基因可能通过SA和JA信号途径参与谷子的早期抗病反应。
谷子;MYB转录因子;锈病;real-time PCR;抗病反应
0 引言
【研究意义】谷子()抗旱耐瘠且营养丰富,是北方旱区重要的农作物之一。由粟单孢锈菌(Yoshino)侵染引起的谷子锈病属于爆发流行性病害,一旦发生会给谷子生产带来巨大的经济损失[1]。明确SiMYBs基因在谷子的不同发育阶段、谷锈菌生物胁迫、激素处理条件下的表达水平,了解它们的转录激活活性与亚细胞定位等转录因子特征,为谷子抗锈病机理研究和抗病分子育种提供优异基因资源。【前人研究进展】MYB是植物最大的转录因子家族之一,参与植物的次生代谢、细胞形态建成、生长发育和逆境胁迫应答反应等多种生命活动[2-3]。在拟南芥()[4]、水稻()[2]、葡萄()[5]、棉花(spp.)[6]和谷子[7]中已经鉴定到大量MYB转录因子,如拟南芥和棉花中分别鉴定到超过198个和200个MYB基因[8]。WER(R2R3-MYB)和CPC(R3-MYB)共同参与根毛生长发育的遗传调控[9-12];拟南芥中参与茎的发育与叶片形状的形态建成[13];、、、、和等基因调控拟南芥花药的发育[14]。拟南芥中在抗病反应中被特异、快速诱导表达,过表达加快和强化超敏反应的出现以提升抗性[15];小麦中调控寄主对小麦条锈病的抗性[16];过表达增加烟草对青枯病的抗性[17];过表达可显著增强转基因小麦的根腐病抗性;在小麦防御根腐病过程中起正调控作用[18];过表达的转基因水稻幼苗较未转基因对照相比,增强了对稻瘟病菌侵染的抗性,减少了病斑数量[19];番茄在烟草中过表达,增加了植株抵抗镰刀菌()和灰葡萄球菌()侵染的能力,对番茄灰霉病产生抗性[20]。水杨酸(salicylic acid,SA)和茉莉酸(jasmonic acid,JA)作为信号分子,在植物调控抗病和防卫信号传导网络中扮演了重要角色。外源SA能够引起拟南芥中PR基因的转录,从而提高其抗病性[21]。甜瓜幼苗期外接SA,可降低其白粉病病情的指数,提升植株对白粉病的抗性[22];SA处理的油菜提高了对核盘菌的抗性[23];SA处理的小麦植株显著激活和增强病程相关蛋白(PR-1和PR-5)的表达,提高了对白粉病的抗性[24]。小麦外接茉莉酸甲酯(methyl jasmona,MeJA)可以显著激活、、和等抗病相关基因的转录,提高小麦对白粉病的抗病水平,且抗病性的提高与抗病标志基因表达增强呈正相关[25-26]。因此,植物体受到外界胁迫时,体内转录因子(WRKY、NPR1、TGA、EIN)会参与SA和JA下游的信号转导途径,通过调控PR等防御相关基因的表达来调控过敏性反应,从而调控植物对病原菌的抗性[15,27-29]。【本研究切入点】印度学者曾对谷子中代表9条染色体和10个MYB基因家族系统进化树分支的11个MYB基因进行了非生物胁迫(盐胁迫、脱水胁迫与激素处理)下的实时荧光定量PCR(real-time PCR)表达分析,而这些基因是否参与了生物胁迫反应?是否在生物胁迫反应中的表达与SA、JA激素信号通路中的表达具有相关性?这些问题目前尚不清楚,有待回答。【拟解决的关键问题】本研究为探索MYB转录因子调控谷子抗锈病反应的防御机制,选择响应非生物胁迫反应的9个SiMYBs基因[7],通过real-time PCR技术检测其在谷子发育不同组织部位、抗病与感病材料接种谷锈菌以及外接SA和MeJA后的表达水平,并进行比较,分析SiMYBs基因表达与植物生长发育、病原菌侵染应答反应和激素调节的相关性,筛选抗病相关基因,明确转录激活活性与表达部位,为深入研究谷子中MYB转录因子在谷子抗锈病反应的作用机制提供参考。
1 材料与方法
试验于2018年4月至2019年1月在河北省农林科学院谷子研究所河北省杂粮重点实验室完成。
1.1 试验材料
供试谷子材料为十里香和豫谷1号,谷锈菌为强毒性小种A57的单孢菌系93-5,该菌株为河北省农林科学院谷子研究所植物保护实验室分离保存,菌种的扩繁与保存参照梁克恭等[30]方法。十里香对谷锈菌单孢菌系93-5表现抗病反应,豫谷1号对93-5表现感病反应。
1.2 SiMYBs基因的选择
根据已报道的谷子SiMYBs基因家族信息,选择其中9个SiMYBs基因(、、、、、、、和),它们分别来自该基因家族的9个进化树分支,且在非生物胁迫反应中具有响应[7],用于检测它们在谷子生长发育的不同组织部位与胁迫反应中的表达。
1.3 不同条件下的取材
(1)谷子发育过程中的不同组织部位取材:材料取自谷子品种豫谷1号孕穗期的根、茎、叶、穗四部位。(2)谷锈菌接种处理与取材:选取培养21 d(4—5叶期)生长健康且大小一致的幼苗,收集新鲜的谷锈菌单孢菌系93-5,制备孢子悬浮液(浓度为1.0×105个/mL)喷雾接种幼苗并保湿,于接种后0、12、24、36、48、72、96和120 h采集接种叶片,液氮速冻后于-80℃保存。(3)激素处理与取材:选取培养21 d(4—5叶期)生长健康且大小一致的幼苗分别用0.1 mmol·L-1SA溶液、0.1 mmol·L-1MeJA溶液进行胁迫处理,并于处理后0、12和24 h分别取样,液氮冷冻,-80℃保存备用。
1.4 谷子总RNA提取、实时荧光定量PCR检测与分析
采用Trizol试剂(Thermo Fisher Scientific,15596-026),提取不同处理条件下取材的谷子样品的总RNA,第一链cDNA的合成按照RevertAidTMFirst Strand cDNA Synthesis Kit(Thermo Fisher Scientific,K1622)操作说明进行,反转录获得cDNA作为real-time PCR的模板。real-time PCR使用TB GreenTM™ Ⅱ试剂盒(TaKaRa,RR820A)完成,选用谷子肌动蛋白基因()作为内参。反应体系20 μL,包括10 μL 2×SYBR Premix Ex Taq Ⅱ、正反向引物各0.8 μL、2 μL cDNA和6.4 μL ddH2O。采用三步法反应程序为95℃ 30s;95℃ 15 s,60℃ 30 s,72℃32 s,40个循环后收集荧光信号。每个反应3次重复,Ct取平均值,采用2-△△Ct法根据各样品在特定荧光阈值下的Ct值计算基因在不同样品中的相对表达量,与对照相比,将差异倍数≥2作为显著性差异表达的筛选标准。real-time PCR中所用引物信息见电子附表1。
1.5 SiMYBs基因转录激活活性检测
根据SiMYBs基因在谷子参考基因组中的序列设计特异性引物(电子附表1),扩增5个抗病反应特异的SiMYBs基因(、、、和)的全长CDS序列,利用双酶切体系(RⅠ-HF和HⅠ-HF)与同源重组的方法与pGBKT7载体连接,构建与BD(binding domain)融合的重组质粒pBD-SiMYBs,筛选阳性克隆,测序验证后用化学法转入酵母菌株Y2H Gold,以转入空载体为对照。均匀涂布于SD/-Trp单缺陷平板上,30℃培养2—3 d。待酵母长出菌落后,稀释酵母菌落后均匀点在SD/-Trp单缺陷平板和SD/-Trp/ X-α-gal/Aba显色平板上,30℃培养2—3 d,观察酵母菌落生长状况与进行β-半乳糖苷酶活性检测,并拍照记录。
1.6 SiMYBs蛋白质亚细胞定位
设计、、、和的特异性引物(电子附表1),分别扩增5个基因的5’端339、360、330、351和360 bp ORF序列,之后构建pSiMYB041-YFP、pSiMYB074-YFP、pSiMYB100-YFP、pSiMYB177-YFP和pSiMYB202- YFP融合表达载体,参考YOO等[31]方法,以生长2周龄的水稻叶片为材料进行原生质体制备,将对照YFP空载体和重组质粒通过化学转化法导入水稻原生质体中,28℃培养12 h后,使用激光扫描共聚焦显微镜(Zeiss,LSM 710)观察水稻原生质体内的SiMYBs蛋白亚细胞定位情况。
2 结果
2.1 SiMYBs基因在谷子不同组织器官中的表达
如图1所示,9个SiMYBs基因在谷子孕穗期的根、茎、叶和穗中均有表达。在叶中表达量最高,其他部位表达量相似。、、和表达模式相似,在根中的表达量最高,叶和穗次之,而茎中的表达量最低。、和在根、叶中表达量最高,茎中次之,穗中的表达量最低。在根中的表达量最高,其余4个部位的表达量极低或检测不到,推测在根部特异性表达。
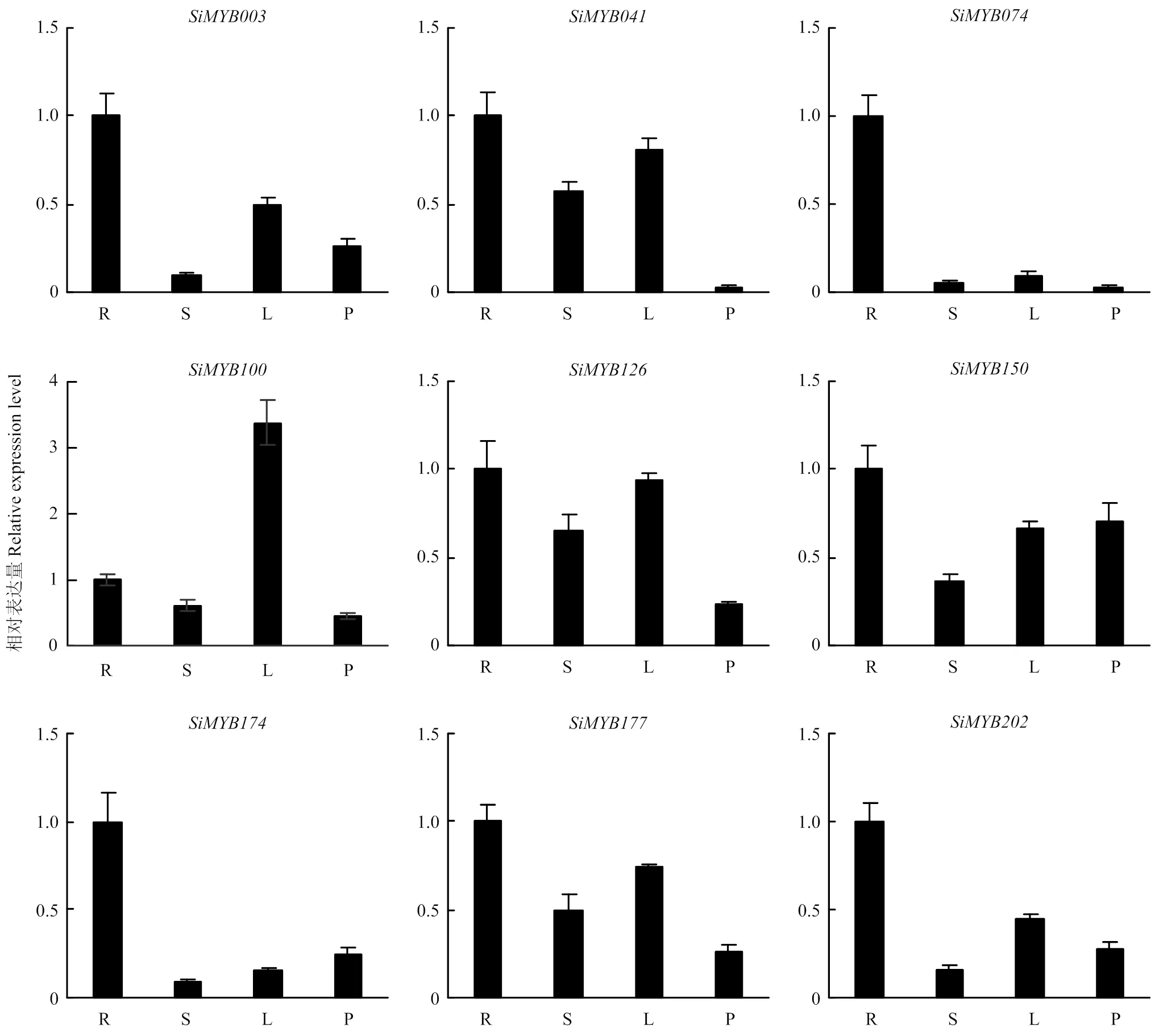
R:根;S:茎;L:叶;P:穗 R: root; S: stem; L: leaf; P: Panicle
2.2 谷子与谷锈菌的互作
在谷子生长的5叶期接种谷锈菌,接种后第14天观察叶片病斑表型(图2),十里香在接种93-5单孢菌系后叶片表面无症状,呈典型的抗病反应。豫谷1号接种93-5单孢菌系后叶片表面布满较大的锈孢子堆,呈典型的感病反应。

图2 接种谷锈菌后第14天的谷子叶片照片
2.3 SiMYBs基因在谷子抗病、感病反应中的表达比较
为检测9个SiMYBs基因在谷子响应锈菌胁迫反应中的表达情况,选取谷子十里香和豫谷1号接种谷锈菌后0、12、24、36、48、72、96和120 h的叶片材料,用real-time PCR技术检测基因的表达变化并进行对比分析(图3),在抗病(R:十里香-93-5)、感病(S:豫谷1号-93-5)反应中没有发生明显的表达变化。和在R、S反应中均下调表达,并且24 h时下调幅度最显著,可能参与了植物基础免疫反应的负调控。在2种反应中均表达上调,且在S反应中明显高于R反应,认为在基础免疫中起作用,且在感病过程中反应更剧烈。在R反应早期上调表达,在S反应早期下调表达,以12 h变化最为显著;在R反应的12和36 h显著上调表达,而S反应过程中没有发生明显可见的表达变化,推测和的表达具有抗病特异性,在抗病反应早期起作用。和在R反应的48 h内下调表达,之后恢复到正常表达水平,而S反应中持续下调表达,且维持低水平的表达,推测这两个基因在抗病反应的中后期起作用。在R、S反应的48 h内表达模式相反,R反应显著下调表达,S反应显著上调表达,以12和36 h差异最显著,说明该基因与抗病相关。

图3 SiMYBs基因在谷子抗病、感病反应中的表达模式比较分析
2.4 SiMYBs基因在十里香外接SA和MeJA后的表达变化
为了检测谷子抗病品种十里香中9个SiMYBs基因对于激素SA和MeJA处理的响应,选取处理后0、12和24 h的叶片材料,用real-time PCR技术检测SiMYBs基因的表达情况(图4)。SA处理后的24 h内,、、和在12 h均表现上调表达,24 h出现不同程度的下调。、、、和下调表达,其中基因和的表达量在处理后12 h下调至最低,24h恢复到0 h表达量。
MeJA处理后的24 h内,、、、、和上调表达。除表达持续上调外,其余5个基因表达模式一致,均在12 h表达量最大,24 h下降至初始值或以下。、和在检测的24 h内均表现下调表达,其中在12 h显著下调表达,24 h上调表达至0 h的2倍。

图4 SiMYBs基因在激素SA和MeJA处理的十里香叶片中的表达
9个SiMYBs基因中,、、、、、和在SA、MeJA处理的不同时间点的叶片中表达模式相似,和表达模式相反。
2.5 SiMYBs基因在谷子抗病、感病反应与外接SA和MeJA反应中表达模式的对比分析
对SiMYBs基因在谷子抗病(R)、感病(S)反应与SA和MeJA处理早期时间点(12和24 h)表达模式进行对比分析(图5)。在R、S、SA和JA反应中,4个SiMYBs基因(、、和)在R、SA与MeJA反应中的表达模式基本一致,不同于S反应,其中,仅在R、SA和MeJA反应12 h上调表达,而S反应中持续高水平上调表达;和在R、SA和MeJA反应中上调表达,S反应中下调表达或表达无明显变化;在R、SA和MeJA反应中下调表达,在S反应中上调表达,推测这四个基因通过SA和JA信号途径参与谷子的早期抗病反应。2个基因(与)在R、S、SA和MeJA反应中的表达模式一致,均表现下调表达,推测它们通过SA、JA途径参与了植物早期基础免疫反应。3个SiMYBs基因(、和)在R、S、SA和MeJA反应中的变化趋势不同。在SA和MeJA反应中表现上调表达,在R和S反应中表达无明显变化;和在R、S和SA反应中均表现下调表达,而MeJA反应中上调表达,说明这两个基因通过SA途径参与谷子早期基础免疫反应。
2.6 SiMYBs基因转录激活活性检测
转录因子具有转录激活活性是其正常发挥生物学功能的重要前提条件,因此,对筛选到的5个抗病相关的SiMYBs基因(、、、和)进行转录激活活性的检测(图6-A),在SD/-Trp平板上,5个pBD-SiMYBs载体和pBD空载体转化的酵母均可以正常生长;在SD/-Trp/X-α-gal/Aba平板上,pBD-SiMYBs载体转化的酵母均可以正常生长且变蓝,pBD空载体转化的酵母不能生长。上述结果表明,5个SiMYBs转录因子均具有转录激活活性,通过激活酵母中报告基因,分解底物X-α-gal发生显色反应。

图5 SiMYBs基因在抗病、感病反应和外源SA、MeJA处理早期(12和24 h)表达模式比较
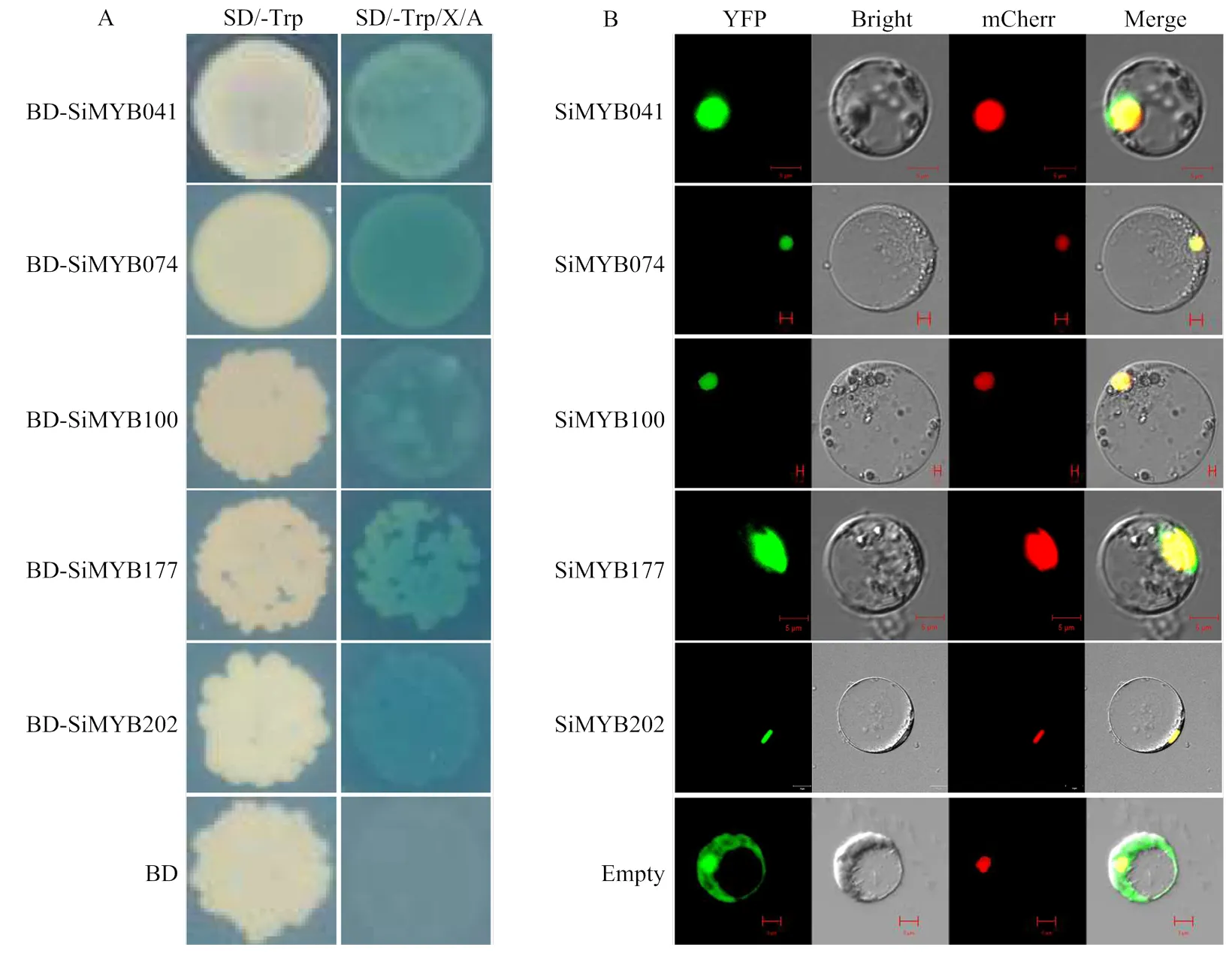
A:SiMYBs在酵母中的转录激活活性检测;B:SiMYBs在水稻原生质体细胞中的亚细胞定位
2.7 SiMYBs蛋白质亚细胞定位
将构建的5个抗病相关SiMYBs基因与YFP的融合表达载体(pSiMYB041-YFP、pSiMYB074-YFP、pSiMYB100-YFP、pSiMYB177-YFP和pSiMYB202- YFP)和pYFP空载体,分别转入水稻原生质体细胞。通过共聚焦显微镜观察(图6-B),5个基因均启动了YFP的表达形成绿色荧光蛋白,主要在水稻原生质体的细胞核区域表达,绿色荧光蛋白信号与核定位信号重合,而空载体的绿色荧光信号遍布整个细胞内。
3 讨论
谷子基因组中已鉴定到209个SiMYBs基因[7],是植物最大的转录因子家族之一。MYB转录因子因包含不同数目的R结构域而具有不同的功能:(1)1R-MYB只含有一个R结构域,主要功能是维持染色体结构的完整性和调节基因转录[32]。本研究中属于此亚组,在叶片中相对表达量最高,R、SA和MeJA反应中表达模式一致,具有抗病特异性;经过转录激活检测,SIMYB100具有激活活性且定位到细胞核中,推测是通过调控下游基因的转录参与谷子的抗病反应,但这一结论需要进一步的验证。(2)R2R3-MYB转录因子的N端含有2个R结构域,广泛参与细胞分化、激素应答、次生代谢、环境胁迫以及抵抗病原菌的侵害[33]。本研究中、、和在抗病反应不同阶段的表达量明显高于感病反应,表现出对锈菌侵染的特异性表达,印证了这一亚组的功能。
在植物发育过程中MYB基因主要参与了根部器官的形态建成和根毛的发育过程。本研究中除外,其余8个基因均在根部表达最多。表达模式最典型,除了根部高表达外,其余部位的表达极低,推测可能特异的参与根部的生长发育或根毛发育。目前有关MYB调控根部生长发育的网络越来越清晰:WER(R2R3 MYB)和CPC(R3 MYB)能竞争结合GL3/EGL3-TTG形成复合物,再作用于以促进根毛凸起[34]。但本研究中的是否与此调控机制一致,有待进一步的验证。
SiMYB基因响应生物胁迫(锈菌)和非生物胁迫(高盐、干旱等)的表达模式不同。如与在抗病早期12和36 h均被诱导表达,是0 h表达量的2倍以上;而谷子品种Prasad[7]中和的表达量在处理早期(1 h)和后期(24 h)的高盐胁迫下表现下调而干旱胁迫下表现上调,说明2个基因以不同的表达方式参与了谷子的生物与非生物胁迫反应。此外,与在谷子Prasad中均不响应高盐与干旱胁迫反应[7],而本研究中这两个基因在抗病、感病反应后期不同的表达模式表明它们与抗病相关。杨树中的同源基因[35]的过表达转基因植株能够激活原花青素合成基因的表达,增强了杨树对溃疡病菌的抗性,与本研究中的表达可能正调控抗病反应的结果一致。
激素SA和JA作为重要的信号分子激活并介导植物的免疫反应。在激素调控的过程中,SA和JA信号之间既有相互拮抗,也存在相互协作[36-37]。通常认为,SA信号通路主要参与对活体营养型病原物的抗性反应,JA主要参与对死体营养型病原物的抗性反应[38-40]。本研究中,谷锈菌属于活体营养型病原物,和在R、S和SA反应早期(12和24 h)均表现下调表达,而JA反应中上调表达,推测它们通过SA信号途径参与谷子早期的基础免疫反应。而4个SiMYBs基因(、、和)在R、SA和JA反应中表达变化趋势一致,和在R、S、SA和JA反应中表达模式一致,提示6个基因可能通过SA和JA信号途径协同参与谷子的抗病反应或基础免疫反应。SA和JA信号分子在谷子抗锈病过程中的协同或拮抗关系有待进一步深入研究。
4 结论
鉴定到、、、和的表达与谷子抗锈病相关,并且具有转录激活活性。在根部特异性表达,在叶片中高水平表达,且在谷子生长发育和抗病过程中都发挥一定的功能。、、和在R、SA与MeJA反应中的表达模式基本一致,它们可能通过SA和JA信号途径协同参与谷子的早期抗病反应。
[1] 赵立强, 潘文嘉, 马继芳, 瓮巧云, 董立, 全建章, 邢继红, 董志平, 董金皋. 一个谷子新抗锈基因的AFLP标记. 中国农业科学, 2010, 43(21): 4349-4355.
ZHAO L Q, PAN W J, MA J F, WENG Q Y, DONG L, QUAN J Z, XING J H, DONG Z P, DONG J G. Identification of AFLP markers linked to a novel rust resistance gene in foxtail millet., 2010, 43(21): 4349-4355. (in Chinese)
[2] DUBOS C, STRACKE R, GROTEWOLD E, WEISSHAAR B, MARTIN C, LEPINIEC L. MYB transcription factors in., 2010, 15(10): 573-581.
[3] 左然, 徐美玲, 柴国华, 周功克. 植物MYB转录因子功能及调控机制研究进展. 生命科学, 2012, 24(10): 1133-1140.
ZUO R, XU M L, CHAI G H, ZHOU G K. Function and regulation mechanism of plant MYB transcription factors., 2012, 24(10): 1133-1140. (in Chinese)
[4] CHEN Y H, YANG X Y, HE K, LIU M H, LI J G, GAO Z F, LIN Z Q, ZHANG Y F, WANG X X, QIU X M, SHEN Y P, ZHANG L, DENG X H, LUO J C, DENG X W, CHEN Z L, GU H Y, QU L J. The MYB transcription factor superfamily of arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family., 2006, 60(1): 107-124.
[5] MATUS J T, AQUEA F, ARCE-JOHNSON P. Analysis of the grape MYB R2R3 subfamily reveals expanded wine quality-related clades and conserved gene structure organization acrossandgenomes., 2008. 8: 83.
[6] SUO J F, LIANG X E, PU L, ZHANG Y S, XUE Y B. Identification ofencoding a R2R3 MYB transcription factor that expressed specifically in fiber initials and elongating fibers of cotton (L.)., 2003, 1630(1): 25-34.
[7] MUTHAMILARASAN M, KHANDELWAL R, YADAV C B, BONTHALA V S, KHAN Y, PRASAD M. Identification and molecular characterization of MYB transcription factor superfamily in C4 model plant foxtail millet (L.)., 2014, 9(10): e109920.
[8] 牛义岭, 姜秀明, 许向阳. 植物转录因子MYB基因家族的研究进展. 分子植物育种, 2016, 14(8): 2050-2059.
NIU Y L, JIANG X M, XU X Y. Research advances on transcription factor MYB gene family in plant., 2016, 14(8): 2050-2059. (in Chinese)
[9] LEE M M, SCHIEFELBEIN J. Cell pattern in theroot epidermis determined by lateral inhibition with feedback., 2002, 14(3): 611-618.
[10] RYU K H, KANG Y H, PARK Y H, HWANG I, SCHIEFELBEIN J, LEE M M. The WEREWOLF MYB protein directly regulates CAPRICE transcription during cell fate specification in theroot epidermis., 2005. 132(21): 4765-4775.
[11] 牛耀芳. 大气CO2浓度升高对拟南芥根毛发育与养分吸收的影响及根系对养分的响应机理[D]. 杭州: 浙江大学, 2013.
NIU Y F. Effect of elevated carbon dioxide on root hair development and nutrient uptake and the response mechanisms of root growth to nutrient supply in[D]. Hangzhou: Zhejiang University, 2013. (in Chinese)
[12] 张德健, 夏仁学, 曹秀. 根毛的生长发育及其遗传基础. 植物生理学报, 2015, 51(1): 9-20.
ZHANG D J, XIA R X, CAO X. Root hair development and its genetic basis., 2015, 51(1): 9-20. (in Chinese)
[13] BYRNE M E, BARLEY R, CURTIS M, ARROYO J M, DUNHAM M, HUDSON A, MARTIENSSEN R A.mediates leaf patterning and stem cell function in., 2000, 408(6815): 967-971.
[14] CHENG H, SONG S, XIAO L, SOO H M, CHENG Z, XIE D, PENG J. Gibberellin acts through jasmonate to control the expression of,, andto promote stamen filament growth in., 2009, 5(3): e1000440.
[15] VAILLEAU F, DANIEL X, TRONCHET M, MONTILLET J L, TRIANTAPHYLIDÈS C, ROBY D. A R2R3-MYB gene,, acts as a positive regulator of the hypersensitive cell death program in plants in response to pathogen attack., 2002, 99(15): 10179-10184.
[16] AL-ATTALA M N, WANG X, ABOU-ATTIA M A, DUAN X, KANG Z. A noveltranscription factor involved in the defence response againstf. sp.and abiotic stresses., 2014, 84(4/5): 589-603.
[17] LIU H, ZHOU X, DONG N, LIU X, ZHANG H, ZHANG Z. Expression of a wheat MYB gene in transgenic tobacco enhances resistance to, and to drought and salt stresses., 2011, 11(3): 431-443.
[18] 单天雷, 洪彦涛, 杜丽璞, 徐惠君, 魏学宁, 张增艳. 抗根腐病的过表达转基因小麦的创制与分子功能鉴定. 作物学报, 2016, 42(10): 1429-1436.
SHAN T L, HONG Y T, DU L P, XU H J, WEI X N, ZHANG Z Y. Development and characterization of-overexpressing transgenic wheat lines with resistance to common root rot., 2016, 42(10): 1429-1436. (in Chinese)
[19] CAO W L, CHU R Z, ZHANG Y, LUO J, SU Y Y, XIE L J, ZHANG H S, WANG J F, BAO Y M., a R2R3-type MYB transcription factor, enhanced blast resistance in transgenic rice., 2015, 92: 154-160.
[20] LIU Z, LUAN Y S, LI J B, YIN Y L. Expression of a tomato MYB gene in transgenic tobacco increases resistance toand., 2016, 144(3): 607-617.
[21] DONG J, CHEN C, CHEN Z. Expression profiles of theWRKY gene superfamily during plant defense response., 2003, 51(1): 21-37.
[22] 陈年来, 胡敏, 乔昌萍, 乃小英, 王锐. BTH、SA和SiO2处理对甜瓜幼苗白粉病抗性及叶片HRGP和木质素含量的影响. 中国农业科学, 2010, 43(3): 535-541.
CHEN N L, HU M, QIAO C P, NAI X Y, WANG R. Effects of BTH, SA, and SiO2treatment on disease resistance and leaf HRGP and lignin contents of melon seedlings., 2010, 43(3): 535-541. (in Chinese)
[23] 倪郁, 王婧, 宋超, 夏瑞娥, 孙正圆, 郭彦军, 李加纳. 外源SA影响油菜叶表皮蜡质及菌核病抗性的机制. 作物学报, 2013, 39(01): 110-117.
NI Y, WANG J, SONG C, XIA R E, SUN Z Y, GUO Y J, LI J N. Effect of SA induction on leaf cuticular wax and resistance toin., 2013, 39(01): 110-117. (in Chinese)
[24] 牛吉山, 刘瑞, 郑磊. 小麦、、基因的白粉菌和水杨酸诱导表达分析及白粉病抗性研究. 麦类作物学报, 2007, 27(6): 1132-1137.
NIU J S, LIU R, ZHENG L. Expression analysis of wheatactivated byand SA, and powdery mildew resistance., 2007, 27(6): 1132-1137. (in Chinese)
[25] 牛吉山, 刘靖, 倪永静, 尹钧. 茉莉酸对、、和基因表达以及小麦白粉病抗性的诱导. 植物病理学报, 2011, 41(3): 270-277.
NIU J S, LIU J, NI Y J, YIN J. Induction of,,,and wheat powdery mildew resistance in response to MeJA treatment., 2011, 41(3): 270-277. (in Chinese)
[26] 牛吉山, 倪永静, 刘靖, 王正阳, 尹钧. 茉莉酸甲酯对小麦白粉病抗性的诱导作用. 中国农学通报, 2010, 26(4): 254-257.
NIU J S, NI Y J, LIU J, WANG Z Y, YIN J. Inducing effect of ja on wheat powdery mildew resistance., 2010, 26(4): 254-257. (in Chinese)
[27] 彭喜旭, 胡耀军, 唐新科, 周平兰, 邓小波, 王海华. 茉莉酸和真菌病原诱导的水稻转录因子基因的分离及表达特征. 中国农业科学, 2011, 44(12): 2454-2461.
PENG X X, HU Y J, TANG X K, ZHOU P L, DENG X B, WANG H H. Isolation and expression profiles of riceinduced by jasmonic acid application and fungal pathogen infection., 2011, 44(12): 2454-2461. (in Chinese)
[28] ZHANG Y, XU S, DING P, WANG D, CHENG YT, HE J, GAO M, XU F, LI Y, ZHU Z, LI X, ZHANG Y. Control of salicylic acid synthesis and systemic acquired resistance by two members of a plant-specific family of transcription factors., 2010, 107(42): 18220-18225.
[29] 王美芳. 转录因子WRKY1和WRKY2在激发子诱导的过敏反应和气孔关闭中的功能研究[D]. 南京: 南京农业大学, 2011.
Wang M F. The role of WRKY transcription factors in the elicitor-triggered hypersensitive response and stomatal closure in[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
[30] 梁克恭, 刘维, 王雅儒, 冯凌云, 崔光先, 宋燕春, 武小菲, 郑桂春, 董志平. 粟品种资源抗粟锈病鉴定研究. 沈阳农业大学学报, 1992, 23(1): 13-18.
LIANG K G, LIU W, WANG Y R, FENG L Y, CUI G X, SONG Y C, WU X F, ZHENG G C, DONG Z P. Rust resistance evaluation for millet varieties., 1992, 23(1): 13-18. (in Chinese)
[31] YOO S D, CHO Y H, SHEEN J.mesophyll protoplasts: a versatile cell system for transient gene expression analysis., 2007, 2(7): 1565-1572.
[32] BILAUD T, KOERING C E, BINET-BRASSELET E, ANCELIN K, POLLICE A, GASSER S M, GILSON E. The telobox, a Myb-related telomeric DNA binding motif found in proteins from yeast, plants and human., 1996, 24(7): 1294-1303.
[33] 陈俊, 王宗阳. 植物MYB类转录因子研究进展. 植物生理与分子生物学学报, 2002, 28(2): 81-88.
CHEN J, WANG Z Y. Progress in the study of plant MYB transcription factors., 2002, 28(2): 81-88. (in Chinese)
[34] LIBAULT M, BRECHENMACHER L, CHENG L, XU J L, XU D, STACEY G. Root hair systems biology., 2010, 15(11): 641-650.
[35] WANG L J, RAN L Y, HOU Y S TIAN Q Y, LI C F, LIU R, FAN D, LUO K M. The transcription factor MYB115 contributes to the regulation of proanthocyanidin biosynthesis and enhances fungal resistance in poplar., 2017, 215(1): 351-367.
[36] VLEESSCHAUWER D D, GHEYSEN GODELIEVE, HÖFTE MONICA. Hormone defense networking in rice: tales from a different world., 2013, 18(10): 555-565.
[37] YANG Y N, QI M, MEIC S. Endogenous salicylic acid protects rice plants from oxidative damage caused by aging as well as biotic and abiotic stress., 2004, 40(6): 909-919.
[38] HAMMOND-KOSACK K E, PARKER J E. Deciphering plant– pathogen communication: fresh perspectives for molecular resistance breeding., 2003, 14(2): 177-193.
[39] LIU X Q, LI F, TANG J Y, WANG W H, ZHANG F X, WANG G D, CHU J F, YAN C Y, WANG T Q, CHU C C, LI C Y. Activation of the jasmonic acid pathway by depletion of the hydroperoxide lyase OsHPL3 reveals crosstalk between the HPL and AOS branches of the oxylipin pathway in rice., 2012, 7(11): e50089.
[40] TONG X H, QI J F, ZHU X D, MAO B Z, ZENG L J, WANG B H, LI Q, ZHOU G X, XU X J, LOU Y G, HE Z H. The rice hydroperoxide lyase OsHPL3 functions in defense responses by modulating the oxylipin pathway., 2012, 71(5): 763-775.
Identification and Expression Analysis of Myb Transcription Factors Related to Rust Resistance in Foxtail Millet
BAI Hui1, SONG ZhenJun2, WANG YongFang1, QUAN JianZhang1, MA JiFang1, LIU Lei1, LI ZhiYong1, DONG ZhiPing1
(1Institute of Millet Crops, Hebei Academy of Agriculture and Forestry Sciences/National Foxtail Millet Improvement Center/Minor Cereal Crops Laboratory of Hebei Province, Shijiazhuang 050035;2College of Communication and Information Engineering, Shanghai Technical Institute of Electronic & Information, Shanghai 201411)
Millet rust is one of the important factors affecting the yield and quality of foxtail millet. Identification of MYB transcription factors related to rust resistance in foxtail millet lays a foundation for the study of the mechanism of rust resistance in foxtail millet.In this study, we used real-time PCR to detect the expression patterns of 9transcription factors (1) in roots, stems, leaves and panicles at booting stage; (2) during 120 hours post-inoculated withurediniospores in resistance (R) and susceptible (S) reactions; (3) during 24 hours after treatment with salicylic acid (SA) and methyl jasmonate (MeJA) in foxtail millet. Then their expression patterns in four reactions of R, S, SA and MeJA were compared, and the resistance-related MYB transcription factors were selected for detection of transactivation activity and subcellular localization.The highest expression ofwas in leaves, and the highest expression of the other eight genes, especially, was in roots. The expression of five genes was correlated with disease resistance.andwere induced by rust fungus infection and their expression levels at early stage of disease resistance were significantly higher than that in the susceptible reaction. The expression ofandwas down-regulated in the early stage of resistance reaction and increased to pre-inoculation level in the later stage, while their expression remained low in susceptible reaction.showed opposite expression pattern in resistance and susceptible responses. In response to exogenous SA and MeJA, the expression ofgene changed in varying degrees. The expression patterns of four genes (,,and) in the R, SA and MeJA reactions were identical, but different from the S reaction. Five resistance-relatedgenes have the transactivation activity and their encoding proteins are located in the nucleus.The expression of five genes,,,,and, was identified to be associated with resistance to rust disease in foxtail millet.andplay certain roles in the growth and disease resistance of foxtail millet. Four genes,,,and, may participate in early disease resistance of foxtail millet through SA and JA signaling pathways.
; MYB transcription factors; rust disease; real-time PCR; disease resistance
10.3864/j.issn.0578-1752.2019.22.007

2019-08-01;
2019-09-30
国家重点研发计划(2018YFD1000703,2018YFD1000700)、国家自然科学基金(31872880)、河北省农林科学院创新工程(2019-4-2-3)、国家现代农业产业技术体系(CARS-07-13.5-A8)
白辉,E-mail:baihui_mbb@126.com。通信作者李志勇,E-mail:lizhiyongds@126.com。通信作者董志平,E-mail:dzping001@163.com
(责任编辑 李莉)

