胡萝卜WRKY69基因(DcWRKY69)的克隆及其对不同植物生长调节剂的响应
张榕蓉, 王雅慧, 李 彤, 丁 旭, 徐志胜, 熊爱生
(南京农业大学园艺学院 作物遗传与种质创新国家重点实验室农业农村部华东地区园艺作物生物学与种质创新重点实验室, 江苏 南京 210095)
胡萝卜(Daucuscarotavar.sativaHoffm.)为二年生草本植物,是全球十大蔬菜作物之一,栽培面积广阔[1]。胡萝卜的肉质根为其主要食用部位,含有丰富的蛋白质、维生素和类胡萝卜素等营养成分[2]。植物激素可直接或间接调控胡萝卜的生长发育过程,如物质积累、结构变化和基因调控等[3]。植物生长调节剂是一类人工合成的化合物,具有与天然植物激素相同的功能[4],可通过调节植物的新陈代谢调控其生殖和生长[5]。已有研究结果表明:植物生长调节剂在胡萝卜生长发育过程中具有重要的调控作用[6-7],因此,研究不同植物生长调节剂对胡萝卜生长发育的影响及探明胡萝卜对植物生长调节剂的分子响应机制具有重要的科学意义。
WRKY转录因子是一类主要存在于植物体内的锌指型转录调控因子,除具有高度保守的WRKYGQK基序,通常还具有C2H2(Cx4-5Cx22-23HxH)型或C2HC(Cx7Cx23HxC)型锌指结构[8]。WRKY转录因子可与启动子中的W-box〔(T)TGACC(A/T)〕特异性结合,从而调控靶基因的表达,参与各种信号转导途径[9]。Eulgem等[10]根据WRKY结构域数量和锌指结构类型将WRKY转录因子分成Ⅰ、Ⅱ和Ⅲ类,其中,Ⅰ类WRKY转录因子含有2个WRKY结构域,锌指结构类型为C2H2型;Ⅱ类WRKY转录因子含有1个WRKY结构域,锌指结构类型为C2H2型;Ⅲ类WRKY转录因子含有1个WRKY结构域,锌指结构类型为C2HC型。迄今为止,研究者已在拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕[8]、红薯〔Ipomoeabatatas(Linn.) Lam.〕[11]、水稻(OryzasativaLinn.)[12]、玉米(ZeamaysLinn.)[13]、大豆〔Glycinemax(Linn.) Merr.〕[14]和胡萝卜[15]等植物中发现WRKY转录因子,该转录因子参与调控植物对多种生物和非生物胁迫的响应[16-17],主要参与调控脱落酸(ABA)、水杨酸(SA)和茉莉酸甲酯(MeJA)信号转导途径[18],进而调控植物的生长发育、物质代谢及抗病和抗逆过程,并通过参与赤霉素(GA)信号转导途径调控植物的衰老进程[19]。研究胡萝卜WRKY转录因子有助于深入了解胡萝卜对不同植物生长调节剂的分子响应机制。
为了深入开展胡萝卜WRKY转录因子相关研究,作者以胡萝卜品种‘黑田五寸’(‘Heitian Wucun’)为研究对象,根据GenBank中的DcWRKY69基因序列设计引物,采用RT-PCR技术从其叶片cDNA中克隆获得DcWRKY69基因片段,对该基因及其编码的氨基酸序列进行生物信息学分析;同时,采用RT-qPCR技术对不同植物生长调节剂处理下叶中DcWRKY69基因表达水平的差异进行了比较,为进一步开展胡萝卜WRKY转录因子对植物生长调节剂的分子响应机制研究提供基础资料。
1 材料和方法
1.1 材料
实验使用的胡萝卜品种‘黑田五寸’种子由南京农业大学作物遗传与种质创新国家重点实验室伞形科蔬菜课题组提供。于2018年9月在人工气候室内进行播种,并在昼温25 ℃、夜温18 ℃、光照时间16 h·d-1及光照强度300 μmol·m-2·s-1的条件下进行培养。
1.2 方法
1.2.1 总RNA提取及cDNA第1链合成 待幼苗萌出60 d后,选取长势良好且无病虫害的完整叶片,将采集的叶片混匀后置于-80 ℃冰箱中保存、备用,采集叶片的总质量约10 g。采用植物总RNA提取试剂盒〔天根生化科技(北京)有限公司〕提取叶片的总RNA,使用One-Drop OD-1000+超微量核酸分析仪(南京五义科技有限公司)检测提取的总RNA样品溶液的浓度,并采用HiScript Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司)对提取的总RNA样品进行反转录,合成cDNA第1链。
1.2.2 基因克隆 基于Xu等[20]获得的胡萝卜转录组和基因组数据库检索获得DcWRKY69基因序列(GenBank登录号为XM_017382173.1),根据检索到的DcWRKY69基因序列设计1对特异的克隆引物,正向引物DcWRKY69-F1的序列为5′-T-C-T-C-T-C-T-A-G-CC-A-G-C-C-A-A-T-A-G-C-3′,反向引物DcWRKY69-R1的序列为5′-C-A-A-C-A-A-A-A-A-G-C-A-G-T-T-T-T-A-T-T-T-3′。以cDNA第1链为模板进行PCR扩增反应,扩增体系总体积30.0 μL,包括PrimerStar Max Premix (2×)高保真酶(含Mg2+和dNTPs)〔宝生物工程(大连)有限公司〕15.0 μL、100 ng·μL-1cDNA第1链2.0 μL、10 nmol·mL-1正向引物和反向引物各1.5 μL、ddH2O 10.0 μL。扩增程序为:98 ℃预变性10 s;98 ℃变性10 s、60 ℃退火10 s、72 ℃延伸30 s,共35个循环;72 ℃延伸10 s。取5 μL扩增产物,用质量体积分数1.2%的琼脂糖凝胶进行电泳检测,确定得到目标基因片段后,将剩余的25 μL扩增产物交由滁州通用生物系统有限公司进行测序。
1.2.3 序列分析 在NCBI网站(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)上对获得的目的基因片段的核苷酸和氨基酸序列进行BLAST比较和保守域预测;采用DNAMAN 6.0软件进行不同植物WRKY转录因子氨基酸序列同源性比对和亲水性/疏水性分析;使用MEGA 7.0软件构建系统进化树并生成图形报告;运用BioXM 2.6软件及SMS序列处理在线工具包(http:∥www.bio-soft.net/sms/)分析不同植物WRKY转录因子的氨基酸组成及理化性质;使用TMHMM Server v. 2.0软件(http:∥www.cbs.dtu.dk/services/TMHMM/)预测分析DcWRKY69转录因子的跨膜结构;使用SignalP 4.1 Server软件(http:∥www.cbs.dtu.dk/services/SignalP-4.1/)预测分析DcWRKY69转录因子的信号肽区域;使用NetPhos 3.1 Server软件(http:∥www.cbs.dtu.dk/services/ NetPhos/)预测分析DcWRKY69转录因子的磷酸化位点;在SOPMA网站(https:∥npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=/NPSA/npsa_sopma.html)上预测分析DcWRKY69转录因子的二级结构。
1.2.4 植物生长调节剂处理方法及基因表达分析
分别配制0.1 mmol·L-1茉莉酸甲脂(MeJA)[21]、1.0 mmol·L-1水杨酸(SA)[22]、0.1 mmol·L-1赤霉素(GA3)[23]和0.1 mmol·L-1脱落酸(ABA)[24],并向上述溶液中添加表面活性剂(体积分数0.1% Tween-20);待幼苗萌出60 d后,选取长势良好的植株,分别将植物生长调节剂溶液充分喷洒在植株的全部叶面上,每组设置3个生物学重复,每个重复8株。以处理0 h为对照(CK),在处理1、2、4、8和12 h选取植株上长势良好且无病虫害的完整叶片,将采集的同组植株叶片混匀后置于-80 ℃冰箱中保存、备用,每个时间点采集的各组叶片的总质量约10 g。
按照上述方法提取总RNA并合成cDNA第1链。使用Primer Premier 6.0软件设计1对荧光定量检测引物,正向引物DcWRKY69-F2的序列为5′-G-G-A-A-G-A-A-G-A-G-C-A-G-G-A-A-G-A-A-G-A-A-G-3′,反向引物DcWRKY69-R2的序列为 5′-A-G-C-C-A-C-T-C-A-A-C-G-G-A-GA-A-T-G-T-A-3′。以胡萝卜Actin基因为内参基因[25],该基因正向引物Actin-F的序列为5′-C-G-G-T-A-T-T-G-TG-T-T-G-G-A-C-T-C-T-G-G-T-G-A-T-3′,反向引物Actin-R的序列为5′-C-A-G-C-A-A-G-G-T-C-A-A-G-A-C-G-G-A-G-T-A-T-G-G-3′。使用HieffTMqPCR® SYBR Green Master Mix(No Rox Plus)(上海翊圣生物科技有限公司)进行RT-qPCR反应,扩增体系总体积20.0 μL,包括HieffTMqPCR® SYBR Green Master Mix(No Rox Plus)(含Mg2+和dNTPs) 10.0 μL、100 ng·μL-1cDNA第1链2.0 μL、10 nmol·mL-1正向引物和反向引物各0.4 μL、ddH2O 7.2 μL。扩增程序为:95 ℃预变性5 min;95 ℃变性10 s、60 ℃退火30 s,共40个循环。在65 ℃逐步升温至95 ℃的过程中连续测量荧光,绘制熔解曲线。采用2-ΔΔCT法[26]计算DcWRKY69基因的相对表达量,并使用SPSS 20.0和EXCEL 2019软件进行差异显著性分析。
2 结果和分析
2.1 DcWRKY69基因的克隆
以胡萝卜叶片cDNA第1链为模板,使用特异引物DcWRKY69-F1和DcWRKY69-R1扩增得到1条长度约750 bp的目的片段。测序及序列分析结果(图1)表明:实验获得的DcWRKY69基因片段包含1个长度为783 bp的开放阅读框(ORF),编码260个氨基酸。
2.2 DcWRKY69转录因子的氨基酸序列分析
2.2.1 保守域预测 对胡萝卜WRKY69转录因子(DcWRKY69)氨基酸序列的保守域预测结果(图2)表明:DcWRKY69转录因子的氨基酸序列在第52至第110位含有1个保守的WRKY结构域,据此认为该转录因子属于WRKY超级家族。

*: 终止密码子 Stop codon.图1 胡萝卜WRKY69基因(DcWRKY69)的测序及序列分析结果Fig. 1 Sequencing and sequence analysis results of WRKY69 gene in Daucus carota var. sativa Hoffm. (DcWRKY69)

图2 胡萝卜WRKY69转录因子(DcWRKY69)的保守域预测Fig. 2 Prediction of conserved domain of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)
2.2.2 同源性比对分析 将DcWRKY69转录因子与NCBI数据库中西洋参(PanaxquiquefoliumLinn.)、橡胶树〔Heveabrasiliensis(Willd. ex A. Juss.) Muell. Arg.〕、木薯(ManihotesculentaCrantz.)、胡桃(JuglansregiaLinn.)、桃〔Prunuspersica(Linn.) Batsch〕、甜樱桃(P.aviumLinn.)、黄胡萝卜〔Daucuscarotasubsp.sativus(Hoffm.) Arcang.〕、拟南芥和芜菁(BrassicarapaLinn.)9种植物WRKY转录因子的氨基酸序列进行同源性比对。结果(图3)表明:DcWRKY69转录因子与这9种植物WRKY转录因子的氨基酸序列相似性较高,说明WRKY转录因子具有高度的保守性。DcWRKY69转录因子含有1个WRKY结构域,其锌指结构类型属于C2H2型,据此判断该转录因子属于Ⅱ类WRKY转录因子。
2.2.3 系统进化树分析 利用DcWRKY69转录因子与其他9种植物WRKY转录因子的氨基酸序列构建系统进化树。结果(图4)表明:这10种植物的WRKY转录因子被分成2个分支,其中,十字花科(Brassicaceae)植物拟南芥的WRKY69转录因子(AtWRKY69)与同科植物芜菁的WRKY69转录因子(BrWRKY69)聚为一个分支,其余8种植物的WRKY转录因子聚为另一个分支。总体来看,同科植物的WRKY转录因子间亲缘关系较近,但DcWRKY69与同科植物黄胡萝卜WRKY65转录因子(DcWRKY65)的亲缘关系并非最近。

DcWRKY69: 胡萝卜WRKY69转录因子 WRKY69 transcription factor in Daucus carota var. sativa Hoffm.; PqWRKY4: 西洋参WRKY4转录因子 WRKY4 transcription factor in Panax quiquefolium Linn.; HbWRKY69: 橡胶树WRKY69转录因子 WRKY69 transcription factor in Hevea brasiliensis (Willd. ex A. Juss.) Muell. Arg.; MeWRKY35: 木薯WRKY35转录因子 WRKY35 transcription factor in Manihot esculenta Crantz.; JrWRKY69: 胡桃WRKY69转录因子 WRKY69 transcription factor in Juglans regia Linn.; PpWRKY69: 桃WRKY69转录因子 WRKY69 transcription factor in Prunus persica (Linn.) Batsch; PaWRKY69: 甜樱桃WRKY69转录因子 WRKY69 transcription factor in Prunus avium Linn.; DcsWRKY65: 黄胡萝卜WRKY65转录因子 WRKY65 transcription factor in Daucus carota subsp. sativus (Hoffm.) Arcang.; AtWRKY69: 拟南芥WRKY69转录因子 WRKY69 transcription factor in Arabidopsis thaliana (Linn.) Heynh.; BrWRKY69: 芜菁WRKY69转录因子 WRKY69 transcription factor in Brassica rapa Linn. 方框示WRKY结构域 The box indicates WRKY domain; ▲: 锌指结构 Zinc finger structure.图3 胡萝卜WRKY69转录因子(DcWRKY69)与其他9种植物WRKY转录因子的氨基酸序列同源性比对结果Fig. 3 Homology comparison result of amino acid sequences of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69) and WRKY transcription factors in other 9 species

HbWRKY69: 橡胶树WRKY69转录因子 WRKY69 transcription factor in Hevea brasiliensis (Willd. ex A. Juss.) Muell. Arg.; MeWRKY35: 木薯WRKY35转录因子 WRKY35 transcription factor in Manihot esculenta Crantz.; JrWRKY69: 胡桃WRKY69转录因子 WRKY69 transcription factor in Juglans regia Linn.; DcWRKY69: 胡萝卜WRKY69转录因子 WRKY69 transcription factor in Daucus carota var. sativa Hoffm.; PpWRKY69: 桃WRKY69转录因子 WRKY69 transcription factor in Prunus persica (Linn.) Batsch; PaWRKY69: 甜樱桃WRKY69转录因子 WRKY69 transcription factor in Prunus avium Linn.; PqWRKY4: 西洋参WRKY4转录因子 WRKY4 transcription factor in Panax quiquefolium Linn.; DcsWRKY65: 黄胡萝卜WRKY65转录因子 WRKY65 transcription factor in Daucus carota subsp. sativus (Hoffm.) Arcang.; AtWRKY69: 拟南芥WRKY69转录因子 WRKY69 transcription factor in Arabidopsis thaliana (Linn.) Heynh.; BrWRKY69: 芜菁WRKY69转录因子 WRKY69 transcription factor in Brassica rapa Linn.图4 胡萝卜WRKY69转录因子(DcWRKY69)与其他9种植物WRKY转录因子的系统进化树Fig. 4 Phylogenetic tree of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69) and WRKY transcription factors in other 9 species
2.2.4 氨基酸组成及理化性质分析 不同植物WRKY转录因子的氨基酸组成及理化性质的分析结果(表1)表明:DcWRKY69及其他9种植物WRKY转录因子的氨基酸数量为247~296;理论相对分子质量差异较小,为28 560~32 470;理论等电点为pI 4.53至pI 6.51。在氨基酸组成方面,酸性氨基酸的比例最高,为21%~31%;碱性氨基酸和脂肪族氨基酸的比例接近,分别为14%~17%和13%~17%;芳香族氨基酸的比例最低,为6%~9%。总体来看,不同植物间WRKY转录因子的各类氨基酸比例差异较小。
由表1还可见:DcWRKY69转录因子的理论相对分子质量为30 030,理论等电点为pI 4.78,酸性氨基酸比例最高(27%),碱性和脂肪族氨基酸比例次之(分别为17%和15%),芳香族氨基酸比例最低(9%)。
2.2.5 亲水性和疏水性分析 DcWRKY69转录因子氨基酸序列的亲水性和疏水性分析结果(图5)表明:在亲水性区域,第123、第125和第126位的谷氨酸(Glu)及第124位的赖氨酸(Lys)的亲水性最强,第142位的天冬氨酸(Asp)和第143位的精氨酸(Arg)的亲水性较强;在疏水性区域,第99位的亮氨酸(Leu)的疏水性最强,第101和第257位的异亮氨酸(Ile)的疏水性较强。总体来看,DcWRKY69转录因子氨基酸序列中的大部分氨基酸为亲水性氨基酸,据此推测DcWRKY69转录因子属于亲水性蛋白。
表1 不同植物WRKY转录因子的氨基酸组成及理化性质分析1)
Table 1 Analyses on amino acid composition and physicochemical property of WRKY transcription factors in different species1)

转录因子Transcription factor登录号Accession No.氨基酸数量Number of amino acid理论相对分子质量Theoretical relative molecular mass理论等电点Theoretical isoelectric point(pI)比例/% Percentage碱性氨基酸Basic amino acid酸性氨基酸Acidic amino acid芳香族氨基酸Aromatic amino acid脂肪族氨基酸Aliphatic amino acidDcWRKY69XM_017382173.126030 0304.781727915PqWRKY4AEQ29017.127131 2804.531531814HbWRKY69AFX83949.125929 4004.801427714MeWRKY35XP_021611426.126129 6205.081526813JrWRKY69XP_018822131.125929 6906.511725717PpWRKY69XP_007201365.125829 3005.251624716PaWRKY69XP_021805196.128032 1704.851628615DcsWRKY65XP_017250159.124728 5604.671630815AtWRKY69OAP01678.127830 9304.961622814BrWRKY69AHB33864.129632 4704.821521813
1)DcWRKY69: 胡萝卜WRKY69蛋白 WRKY69 protein inDaucuscarotavar.sativaHoffm.; PqWRKY4: 西洋参WRKY4蛋白 WRKY4 protein inPanaxquiquefoliumLinn.; HbWRKY69: 橡胶树WRKY69蛋白 WRKY69 protein inHeveabrasiliensis(Willd. ex A. Juss.) Muell. Arg.; MeWRKY35: 木薯WRKY35蛋白 WRKY35 protein inManihotesculentaCrantz.; JrWRKY69: 胡桃WRKY69蛋白 WRKY69 protein inJuglansregiaLinn.; PpWRKY69: 桃WRKY69转录因子 WRKY69 transcription factor inPrunuspersica(Linn.) Batsch; PaWRKY69: 甜樱桃WRKY69转录因子 WRKY69 transcription factor inPrunusaviumLinn.; DcsWRKY65: 黄胡萝卜WRKY65蛋白 WRKY65 protein inDaucuscarotasubsp.sativus(Hoffm.) Arcang.; AtWRKY69: 拟南芥WRKY69蛋白 WRKY69 protein inArabidopsisthaliana(Linn.) Heynh.; BrWRKY69: 芜菁WRKY69蛋白 WRKY69 protein inBrassicarapaLinn.

图5 胡萝卜WRKY69转录因子(DcWRKY69)氨基酸序列的亲水性和疏水性分析Fig. 5 Analyses on hydrophilicity and hydrophobicity of amino acid sequence of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)
2.3 DcWRKY69转录因子的预测分析
2.3.1 信号肽及跨膜结构预测分析 胡萝卜WRKY69转录因子(DcWRKY69)的信号肽及跨膜结构预测结果表明:DcWRKY69转录因子的氨基酸序列不存在信号肽(图6)和跨膜结构(图7)。由于构成蛋白质跨膜结构的氨基酸大部分为疏水性氨基酸,因此,该预测结果也说明DcWRKY转录因子属于亲水性蛋白。
2.3.2 磷酸化位点预测分析 DcWRKY69转录因子的磷酸化位点预测结果(图8)表明:DcWRKY69转录因子的氨基酸序列中共有34个磷酸化位点,包括23个丝氨酸磷酸化位点、9个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点。
2.3.3 二级结构预测分析 DcWRKY69转录因子的二级结构预测结果(图9)表明:DcWRKY69转录因子的二级结构由α-螺旋(α-helix)、β-折叠(β-sheet)、延伸链(extended strand)和随机卷曲(random coil)组成,比例分别为21.92%、4.23%、11.92%和61.92%。
: C分值C-score; : S分值S-score; : Y分值Y-score.图6 胡萝卜WRKY69转录因子(DcWRKY69)的信号肽预测结果Fig. 6 Prediction result of signal peptide of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)

: 膜内Inside; : 膜外Outside.图7 胡萝卜WRKY69转录因子(DcWRKY69)的跨膜结构预测结果Fig. 7 Prediction result of transmembrane structure of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)

: 丝氨酸Serine; : 苏氨酸Threonine; : 酪氨酸Tyrosine; : 阈值Threshold.图8 胡萝卜WRKY69转录因子(DcWRKY69)的磷酸化位点预测结果Fig. 8 Prediction result of phosphorylation site of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)
2.4 不同植物生长调节剂对DcWRKY69基因表达的影响
分别对0.1 mmol·L-1茉莉酸甲酯(MeJA)、1.0 mmol·L-1水杨酸(SA)、0.1 mmol·L-1赤霉素(GA3)和0.1 mmol·L-1脱落酸(ABA)处理0、1、2、4、8和12 h后胡萝卜WRKY69基因(DcWRKY69)在其叶中的相对表达量进行比较,结果见图10。由图10可见:4种植物生长调节剂均能影响DcWRKY69基因的表达,但该基因相对表达量的变化存在明显差异。在MeJA处理下,DcWRKY69基因的相对表达量在处理1~4 h显著低于对照(处理0 h);在处理8 h显著高于对照,为对照的3.03倍;在处理12 h恢复至对照水平。在SA处理下,DcWRKY69基因的相对表达量在处理1、4和8 h显著低于对照;在处理2 h与对照水平相近;在处理12 h显著高于对照,为对照的2.53倍。在GA3处理下,DcWRKY69基因的相对表达量在处理1、2和4 h显著高于对照,并在处理1 h达到峰值,为对照的2.47倍;在处理8 h显著低于对照;在处理12 h略高于对照。在ABA处理下,DcWRKY69基因的相对表达量在处理1、2和4 h显著高于对照,并在处理4 h达到峰值,为对照的5.76倍;在处理8 h与对照水平相近;在处理12 h很低,基本检测不到。

: α-螺旋α-helix; : β-折叠β-sheet; : 延伸链Extended strand; : 随机卷曲Random coil.图9 胡萝卜WRKY69转录因子(DcWRKY69)的二级结构预测结果Fig. 9 Prediction result of secondary structure of WRKY69 transcription factor in Daucus carota var. sativa Hoffm. (DcWRKY69)
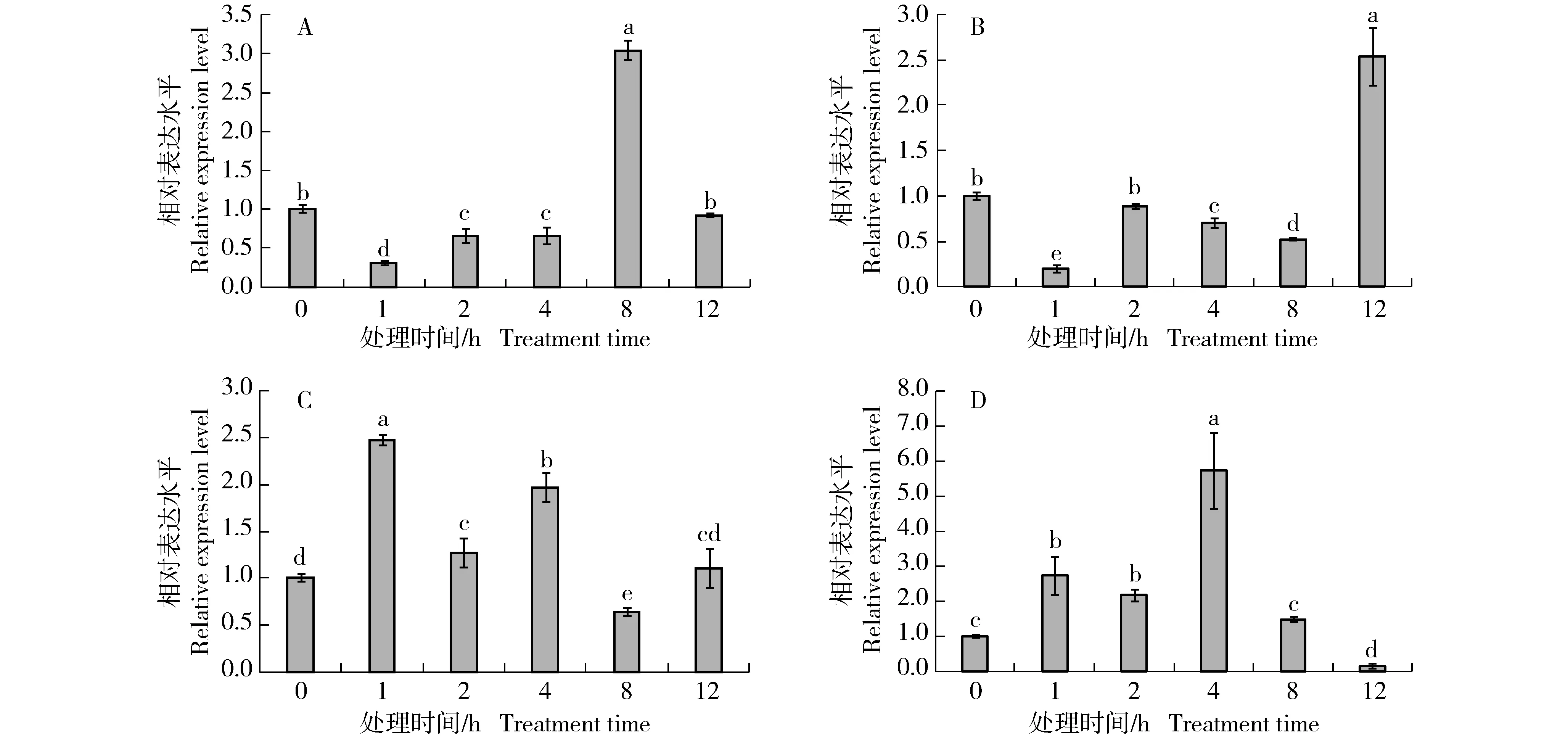
不同小写字母表示在0.05水平差异显著 Different lowercases indicate the significant difference at 0.05 level.A: 0.1 mmol·L-1茉莉酸甲酯 0.1 mmol·L-1 methyl jasmonate; B: 1.0 mmol·L-1水杨酸 1.0 mmol·L-1 salicylic acid; C: 0.1 mmol·L-1赤霉素 0.1 mmol·L-1 gibberellin; D: 0.1 mmol·L-1脱落酸 0.1 mmol·L-1 abscisic acid.图10 不同植物生长调节剂处理下胡萝卜WRKY69基因(DcWRKY69)在其叶中相对表达量的比较Fig. 10 Comparison on relative expression level of DcWRKY69 gene in Daucus carota var. sativa Hoffm. (DcWRKY69) in its leaf under different plant growth regulator treatments
3 讨论和结论
胡萝卜是重要的根菜类蔬菜,合理使用植物生长调节剂可调控其食用部位的品质[27]。WRKY转录因子在植物各种激素信号传递途径中扮演重要角色,例如:NPR1是水杨酸(SA)信号传递途径中最重要的蛋白之一,NPR1可直接调控拟南芥体内至少8个WRKY转录因子的表达[28];WRKY转录因子的多数靶基因(如ABF2、ABI5、DREB1α等)与脱落酸(ABA)信号通路相关[29];OsWRKY51和OsWRKY71基因通过调控糊粉层细胞内ABA和赤霉素(GA)信号传递途径间接调控水稻种子的萌发和休眠[30];PtrWRKY89基因在杨属(PopulusLinn.)植物SA防御信号通路中发挥作用[31]。本研究获得的DcWRKY69转录因子含有1个WRKY结构域,其锌指结构类型为C2H2型,属于Ⅱ类WRKY转录因子,并且,WRKY转录因子在进化过程中高度保守。
蛋白质磷酸化是蛋白质翻译后的一种重要修饰方式,在调节生命活动中起到“分子开关”的作用[32];信号肽是由10~40个氨基酸残基组成的短肽链,可以将蛋白质引导到细胞中具有不同膜结构的亚细胞器内[33]。预测结果表明:DcWRKY69转录因子共有34个磷酸化位点,这些磷酸化位点可能在维持蛋白质空间稳定性和调控植物生理生化反应过程中发挥重要作用;并且,DcWRKY69转录因子是不含跨膜结构和信号肽的亲水性蛋白,据此推测DcWRKY69转录因子可能是非分泌蛋白。
迄今为止,已发现多种植物WRKY转录因子对植物生长调节剂的响应作用[34-36]。本研究结果表明:在MeJA、SA、GA3和ABA处理0~12 h,胡萝卜叶中DcWRKY69基因的相对表达量存在明显差异,说明DcWRKY69基因表达对这4种植物生长调节剂均有响应,但在不同植物生长调节剂处理下该基因相对表达量的响应时间和强度存在差异,说明DcWRKY69基因可能参与胡萝卜对不同植物生长调节剂的响应过程,但其对不同植物生长调节剂的响应模式存在差异,具体作用机制有待进一步深入研究。

