吴茱萸属植物中喹唑啉生物碱的分布、生物活性和化学合成
王奇志, 严 奇, 靳 桐, 刘 飞, 邱 萍, 管福琴, 冯 煦
〔江苏省中国科学院植物研究所(南京中山植物园) 江苏省植物资源研究与利用重点实验室江苏省农业种质资源保护与利用平台, 江苏 南京210014〕
芸香科(Rutaceae)吴茱萸属(EvodiaJ. R. et G. Forst.)植物中多数为民间中草药[1],吴茱萸〔E.rutaecarpa(Juss.) Benth.〕的干燥近成熟果实为常用中药,始载于《神农本草经》,列为中品,为常用温中散寒药[2],临床应用已有2 000多年的历史。历版《中国药典》[3-5]均收载吴茱萸(Euodiae Fructus),其来源为吴茱萸、石虎〔E.rutaecarpavar.officinalis(Dode) Huang〕或疏毛吴萸〔波氏吴萸,E.rutaecarpavar.bodinieri(Dode) Huang〕的干燥近成熟果实,具有散寒止痛、降逆止呕和助阳止泻之功效,用于治疗厥阴头痛、寒疝腹痛、寒湿脚气、经行腹痛、脘腹胀痛、呕吐吞酸和五更泄泻。含吴茱萸的中成药有左金丸[6]、金匮温经丸[7]、四神片[8]和小儿健脾贴膏[9]等。
现代药理活性研究结果[10-13]表明:吴茱萸中丰富的喹唑啉生物碱为其药效物质,如吴茱萸碱(evodiamine,EVO)和吴茱萸次碱(rutaecarpine,RUT)等,由于含喹唑啉骨架的生物碱是一类重要的氮杂环化合物,结构独特,类型多变,具有抗肿瘤[10-11]、抗心律失常[12]和镇痛[13]等生物活性,已广泛应用于医药领域。20世纪初,研究者首次从吴茱萸中分离得到吴茱萸碱和吴茱萸次碱[14-15],并确定了二者的化学结构[16-17],喹唑啉生物碱研究取得了很大进展。本文重点综述了喹唑啉生物碱在吴茱萸属植物中的分布、生物活性及化学合成的现状,以期为其进一步的深入研究提供参考。
1 天然喹唑啉生物碱的分布
1.1 中国吴茱萸属植物名录
芸香科吴茱萸属植物的形态特征变异大,自建立以来在属及属下等级的划分上一直存在争议,有广义〔Evodia(s.l.)〕和狭义〔(Evodia(s.s.)〕之分。《中国植物志》[1]采纳广义观点,认为吴茱萸属植物全世界约有150种,分布于亚洲、非洲东部及大洋洲;中国吴茱萸属植物有20种5变种,分别属于吴茱萸组(Sect.EvodiaJ. R. et G. Forst.)、四数花组〔Sect.Tetradium(Lour.) Engl.〕和喙果组(Sect.EvodiocerasDode),除东北北部及西北部少数省(自治区)外,其余各地均有分布。而《Flora of China》[18]采纳狭义观点,对吴茱萸属植物的归属作了很大调整,将原吴茱萸属下的四数花组升级为四数花属(TetradiumLour.),使EvodiaLam.、蜜茱萸属(MelicopeJ. R. et G. Forst.)和四数花属分别独立成属,把分布于中国的部分原吴茱萸属植物合并,分别归属到四数花属和蜜茱萸属中,认为Evodia属植物中国没有分布。《中国植物志》和《Flora of China》对中国原吴茱萸属植物的分类处理见表1。
由于目前大多数文献及《中国药典》中吴茱萸属植物均按《中国植物志》的分类规则命名,因此,本研究按《中国植物志》的拉丁名进行总结和归纳。
表1 《中国植物志》和《Flora of China》对中国原吴茱萸属植物分类处理的比较结果
Table 1 Result of comparison on classification of originalEvodiaJ. R. et G. Forst. plants in China betweenFloraReipublicaePopularisSinicaeandFloraofChina

序号1)No.1)种(变种) Species (Variety)《中国植物志》Flora Reipublicae Popularis Sinicae《Flora of China》Flora of China吴茱萸组Sect. EvodiaE1单叶吴萸Evodia simplicifolia单叶蜜茱萸Melicope viticinaE2毛单叶吴萸Evodia simplicifolia var. pubescens单叶蜜茱萸Melicope viticinaE3∗三桠苦Evodia lepta三桠苦Melicope pteleifoliaE4毛三桠苦Evodia lepta var. cambodiana三桠苦Melicope pteleifoliaE5∗三刈叶吴萸Evodia lunur-ankenda三刈叶蜜茱萸Melicope lunu-ankendaE6三叶吴萸Evodia triphylla三叶蜜茱萸Melicope triphylla四数花组Sect. TetradiumE7∗牛紏吴萸Evodia trichotoma牛枓吴萸Tetradium trichotomumE8毛牛紏吴萸Evodia trichotoma var. pubescens牛枓吴萸Tetradium trichotomumE9∗蜜楝吴萸Evodia lenticellata牛枓吴萸Tetradium trichotomumE10∗吴茱萸Evodia rutaecarpa吴茱萸Tetradium ruticarpumE11∗波氏吴萸Evodia rutaecarpa var. bodinieri吴茱萸Tetradium ruticarpumE12∗石虎Evodia rutaecarpa var. officinalis吴茱萸Tetradium ruticarpumE13硬毛吴萸Evodia hirsutifolia吴茱萸Tetradium ruticarpumE14密果吴萸Evodia compacta吴茱萸Tetradium ruticarpumE15∗华南吴萸Evodia austrosinensis华南吴萸Tetradium austrosinenseE16∗楝叶吴萸Evodia glabrifolia楝叶吴萸Tetradium glabrifoliumE17∗云南吴萸Evodia ailanthifolia楝叶吴萸Tetradium glabrifoliumE18∗臭辣吴萸Evodia fargesii楝叶吴萸Tetradium glabrifolium喙果组Sect. EvodiocerasE19无腺吴萸Evodia fraxinifolia无腺吴萸Tetradium fraxinifoliumE20∗棱子吴萸Evodia subtrigonosperma牛枓吴萸Tetradium trichotomumE21∗石山吴萸Evodia calcicola石山吴萸Tetradium calcicolaE22四川吴萸Evodia sutchuenensis臭檀吴萸Tetradium. danielliiE23∗臭檀吴萸Evodia daniellii臭檀吴萸Tetradium danielliiE24∗丽江吴萸Evodia delavayi臭檀吴萸Tetradium danielliiE25密序吴萸Evodia henryi臭檀吴萸Tetradium daniellii
1)*: 表示已有相关研究报道的吴茱萸属植物IndicatingEvodiaJ. R. et G. Forst. plants which have related studies.
1.2 吴茱萸属植物中喹唑啉生物碱分析
根据喹唑啉生物碱化学结构式中A、B、C、D和E环中B、C和D环的裂环情况,将吴茱萸属植物中喹唑啉生物碱的骨架分为以下5种类型(图1):以吴茱萸碱为代表的化学结构式中具有完整的A、B、C、D和E 5环母核的Ⅰ型喹唑啉生物碱最多,其次为C环开裂的Ⅱ型喹唑啉生物碱,D环开裂的为Ⅲ型喹唑啉生物碱,C和D环均开裂的为Ⅳ型喹唑啉生物碱,B和C环均开裂的为Ⅴ型喹唑啉生物碱。
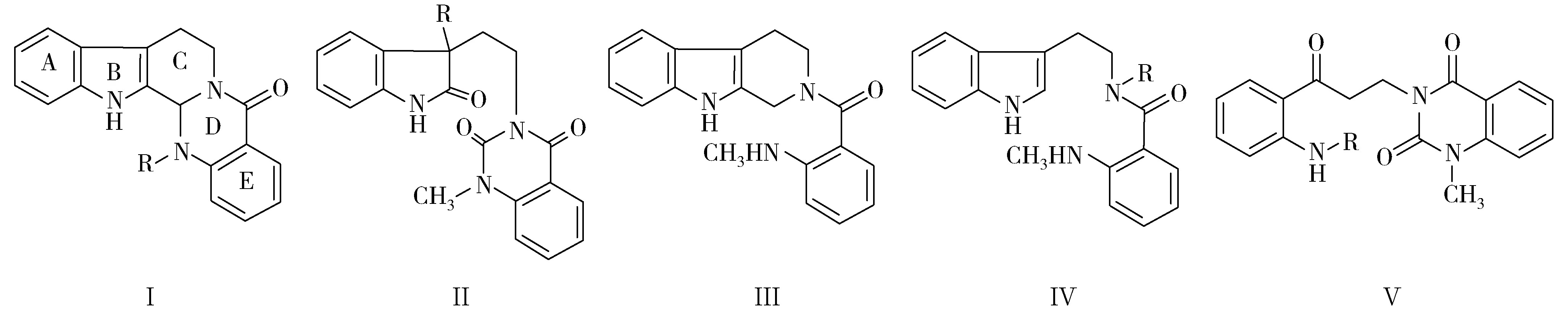
图1 吴茱萸属植物中喹唑啉生物碱的骨架类型Fig. 1 Skeleton types of quinazoline alkaloids in Evodia J. R. et G. Forst. plants
根据已有的吴茱萸属植物化学成分研究结果,对吴茱萸属植物中喹唑啉生物碱的分布情况进行了归纳,结果(表2)显示:已从吴茱萸属植物中分离得到51个喹唑啉生物碱,其中作者所在课题组分离得到47个[19-51],包括8个新化合物[25-29]。骨架类型属于Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ型的喹唑啉生物碱分别有31、13、3、3和3个,且主要集中在吴茱萸,其后依次为石虎、丽江吴萸(E.delavayiDode)、波氏吴萸、牛紏吴萸〔E.trichotoma(Lour.) Pierre〕、云南吴萸(E.ailanthifoliaPierre)和楝叶吴萸〔E.glabrifolia(Champ. ex Benth.) Huang〕,而吴茱萸属其他植物的化学成分研究报道较少。
表2 吴茱萸属植物中喹唑啉生物碱的分布情况
Table 2 Distribution status of quinazoline alkaloids inEvodiaJ. R. et G. Forst. plants

序号No.喹唑啉生物碱Quinazoline alkaloids 分子式Molecular formula相对分子质量Relative molecular mass骨架类型Skeleton type来源1)Source1)参考文献Reference1吴茱萸碱 evodiamineC19H17N3O303ⅠE7,E10,E11,E12,E17,E24[25,29,52-55]2羟基吴茱萸碱 hydroxyevodiamineC19H17N3O2319ⅠE10,E12[56]313β-丙酮基羟基吴茱萸碱13β-acetongl-hydroxy-evodiamineC22H21N3O2359ⅠE10[57]4羧基吴茱萸碱 carboxyevodiamineC20H17N3O3347ⅠE10[58]5去甲基吴茱萸碱 demethy evodiamineC18H15N3O289ⅠE12[59]614-甲酰基二氢吴茱萸次碱 14-formyldihydrorutaecarpineC19H15N3O2317ⅠE10,E11,E12[52-53]713β-羟甲基吴茱萸碱 13β-hydroxymethylevodiamineC20H19N3O2333ⅠE10[60]8吴茱萸次碱 rutaecarpineC18H13N3O287ⅠE10,E11,E12,E17,E24[29,52-55]9荷蒂芸香碱 hortiacineC19H15N3O2317ⅠE10[19]101-羟基吴茱萸次碱 1-hydroxyrutaecarpineC18H13N3O2303ⅠE10[61]117β-羟基吴茱萸次碱 7β-hydroxyrutaecarpineC18H13N3O2303ⅠE10,E11,E12,E16,E24[52-53,55,62-63]1210-羟基吴茱萸次碱 10-hydroxyrutaecarpineC18H13N3O2303ⅠE10[64]137,8-二羟基吴茱萸次碱 7,8-dihydroxyrutaecarpineC18H13N3O3319ⅠE10[61]14(7R,8S)-7-羟基-8-甲氧基-吴茱萸次碱(7R,8S)-7-hydroxy-8-methoxy-rutaecarpineC19H15N3O3333ⅠE10[61]15(7R,8S)-7-羟基-8-乙氧基-吴茱萸次碱(7R,8S)-7-hydroxy-8-ethoxy-rutaecarpineC20H17N3O3347ⅠE10[61]1613-N-甲基吴茱萸次碱 N13-methyl rutaecarpineC19H15N3O301ⅠE7[65]17吴茱萸次碱-1-O-β-D-葡萄糖苷1-O-β-D-glucopyranosylrutaecarpineC24H23N3O7465ⅠE10[66]18吴茱萸次碱-2-O-β-D-葡萄糖苷rutaecarpine-2-O-β-D-glucopyranosideC24H23N3O7465ⅠE10[66]19吴茱萸次碱-10-O-β-D-葡萄糖苷rutaecarpine-10-O-β-D-glucopyranosideC24H23N3O7465ⅠE10[67]20吴茱萸次碱-10-O-β-D-芸香糖苷rutaecarpine-10-O-β-D-rutinosideC30H33N3O11611ⅠE10[67]2113-甲基-13H-吲哚并[2′,3′:3,4]吡啶并[2,1b]喹唑啉-5-酮 13-methyl-13H-indolo[2′,3′:3,4]pyrido[2,1b]quinazolin-5-oneC19H13N3O299ⅠE11[68]22伪吴茱萸次碱 pseudorutaecarpineC18H13N3O287ⅠE10[19]23去氢吴茱萸碱 dehydroevodiamineC19H15N3O301ⅠE10,E11,E12[28,52-53]24去氢吴茱萸碱盐酸盐 dehydroevodiamine chlorideC19H16N3OCl337ⅠE10[20]25吴茱萸宁碱 evodianinineC19H13N3O299ⅠE10[25]26wuzhuyurutine AC17H11N3O2289ⅠE10[65]27吴茱萸庚碱 evodiagenineC19H13N3O299ⅠE10[26]28吴茱萸新碱 evodiaxinineC19H17N3O3335ⅠE10,E24[27]29(+) evodiakineC19H17N3O3335ⅠE10[69]30(-) evodiakineC19H17N3O3335ⅠE10[69]31双吴茱萸碱 dievodiamineC38H30N6O2602Ⅰ,ⅡE10[26]32吴茱萸酰胺Ⅰ wuchuyuamide ⅠC19H17N3O4351ⅡE7,E10,E11,E24[19,29,52,55]33吴茱萸酰胺Ⅱ wuchuyuamide ⅡC19H17N3O3335ⅡE10[70]34evollionine BC20H19N3O5381ⅡE10[71]35吴茱萸酰胺乙 goshuyuamide-ⅡC19H17N3O2319ⅡE10,E24[55,72]36羟甲基吴茱萸酰胺乙 13-hydroxymethyl goshuyuamide-ⅡC20H19N3O3349ⅡE10[73]37wuzhuyurutine CC18H13N3O3319ⅡE10[60]38wuzhuyurutine DC17H11N3O3305ⅡE10[60]39(S)-7-hydroxysecevodiamineC18H15N3O3321ⅡE10,E24[55,66]40wuzhuyurutine BC17H13N3O3307ⅡE10[60]41evodiamide AC20H19N3O5381ⅡE10[28]42evodiamide BC19H16N4O2332ⅡE10[28]
1)E7: 牛紏吴萸E.trichotoma(Lour.) Pierre; E10: 吴茱萸E.rutaecarpa(Juss.) Benth.; E11: 波氏吴萸E.rutaecarpavar.bodinieri(Dode) Huang; E12: 石虎E.rutaecarpavar.officinalis(Dode) Huang; E16: 楝叶吴萸E.glabrifolia(Champ. ex Benth.) Huang; E17: 云南吴萸E.ailanthifoliaPierre; E24: 丽江吴萸E.delavayiDode.
2 生物活性
2.1 对消化系统的作用
吴茱萸和干姜配伍的水煎剂可治疗食己吞酸和胃气虚冷[74]。临床研究表明:吴茱萸加粗盐加热贴敷神阙穴位可有效改善胃肠功能障碍[75]。另外,吴茱萸水提物具有抗转运和抗腹泻活性[76]。戴媛媛等[77]认为,50、100和200 mg·kg-1吴茱萸三氯甲烷提取物可以延缓实验动物小鼠胃排空,缓解离体肠管平滑肌痉挛,抑制胃肠运动。
李晓红等[78]以0.3 g·kg-1·d-1吴茱萸浸膏对Wistar雄性大鼠灌胃治疗,可减轻大鼠胃黏膜血管内膜增生性炎症,改善静脉性充血水肿及黏膜肌层增厚病变。王海燕等[79]对三硝基苯磺酸(TNBS)诱导的实验性结肠炎大鼠以40 mg·kg-1吴茱萸碱(EVO)灌胃给药,发现可有效修复大鼠结肠黏膜,抑制黏膜组织过度增生。Shen等[80]发现EVO可平衡大肠杆菌和乳酸杆菌的水平,其作用机制可能是通过抑制肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素6(IL-6)的产生,调节核因子-κB(NF-κB)信号和Nod样受体蛋白3(NLRP3)炎症小体。
2.2 对神经系统的作用
吴茱萸汤可治疗胸满脘痛和巅顶头痛[81],吴茱萸有安神定志的作用。临床研究已证实,用醋调吴茱萸粉末贴敷涌泉穴,可平衡脏腑阴阳气血,促进睡眠,有效治疗失眠[82]。陈洋等[83]通过小鼠腹腔注射乙酸致扭体反应和热板法研究吴茱萸不同溶剂提取物的镇痛效应,发现石油醚提取物和正丁醇提取物是吴茱萸镇痛的主要有效部位,且吴茱萸汤中包含至少7种辣椒素受体1(TRPV1)/瞬间受体电位离子通道(TRPA1)激动剂,表明吴茱萸汤可能通过该机制实现温中、散寒和止痛的作用。
韩兆丰等[84]以50~200 mg·kg-1吴茱萸碱(EVO)灌胃给药,发现EVO可明显降低人β淀粉样蛋白1-40(Aβ1-40)诱导的阿尔茨海默病(AD)模型小鼠海马神经细胞凋亡率。Ko等[85]发现EVO能显著抑制咖啡因诱导的兴奋,受试大鼠在自发活动实验中的过度运动减少,其机制与逆转GABA(γ-氨基丁酸)A受体亚单位表达减少有关,为吴茱萸治疗失眠提供了实验依据。
He等[86]认为吴茱萸次碱可作为乙酰胆碱酯酶抑制剂减少蛋白样淀粉聚集,具有治疗阿尔茨海默病的临床应用潜能。
2.3 对心血管系统的作用
近年来的研究发现中药吴茱萸有强心、抑制心肌细胞肥大和预防心肌缺血再灌注损伤等作用[86]。复方吴茱萸粉末醋调敷涌泉穴常用于降压和改善高血压[87]。林淑娴等[88]将100 mg·L-1吴茱萸总碱作用于心肌细胞24 h后,发现小鼠血管紧张素Ⅱ(AngⅡ)诱导的心肌细胞肥大受到抑制,其作用机制与增加心肌细胞NO生成、促进丝裂素活化蛋白激酶磷酸酶-1(MKP-1)表达从而增加丝裂原活化蛋白激酶(MAPK)去磷酸化有关。
周昕等[89]将吴茱萸碱(EVO)与小檗碱以质量比1∶1配伍,分别使用89.2和178.4 mg·kg-1的剂量灌胃,发现该组方的2个剂量组均能显著降低高胆固醇血症大鼠血清总胆固醇(TC)和甘油三酯(TG)以及肝脏TC水平。Ge等[90]的体外研究表明:EVO呈剂量依赖性抑制人血小板衍生生长因子BB(PDGF-BB)诱导的血管平滑肌细胞(VSMC)增殖,但不诱导细胞死亡,有治疗血管闭塞性疾病的潜在价值,其作用机制与EVO能减弱p38 MAPK和细胞外信号调节激酶1/2的磷酸化有关。Wang等[91]发现EVO可与三磷酸腺苷结合盒转运体A1抗体(ABCA1)直接结合,促进胆固醇逆向转运,为吴茱萸治疗动脉粥样硬化提供依据。
黄波等[92]以20 mg·kg-1吴茱萸次碱(RUT)灌胃给药,发现RUT可增加大鼠心肌钠钾ATP酶和钙ATP酶活性,抑制CaN活性,最终调节细胞内Ca2+浓度,对大鼠压力负荷型心肌肥厚有改善作用。杨晶等[93]发现,通过静脉注射100和300 μg·kg-1RUT可明显降低用质量分数10%水合氯醛(通过腹腔注射,剂量为300 mg·kg-1)引起的大鼠心肌梗死面积和血清肌酸激酶活性,抑制TLR4/NF-κB信号通路,保护心肌I/R损伤,促进降钙素基因相关肽(CGRP)释放。
2.4 抗菌抗炎作用
吴茱萸与黄连配伍制成的左金丸具有清肝泻火之功效[94]。近代研究表明黄连吴茱萸配伍在体内和体外均能有效抑制幽门螺杆菌生长[95]。吴茱萸外敷可以抑制严重脓毒症的炎症,缓解患者病情[96]。谢梅林等[97]发现吴茱萸提取物中的吲哚总生物碱对热板致痛和二甲苯致炎小鼠具有明显的镇痛和抗炎作用。
Chen等[98]研究表明:吴茱萸碱(EVO)可减轻肺组织学改变和炎症因子水平,明显改善酵母多糖所致的肺泡壁毛细血管扩张充血及炎性细胞浸润,降低肺湿干质量比,10 和 20 mg· kg-1EVO治疗有助于细菌清除,并在治疗第15天,肺部细菌数量显著降低,其机制与核因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)有关。Fan等[99]研究结果显示:EVO能够改善肺和肠组织的异常状态,抗炎症紊乱,其机制与EVO对抑制性卡巴蛋白(IκBα)磷酸化有抑制作用有关。
Heo等[100]研究发现,吴茱萸次碱可通过抑制还原型辅酶Ⅱ(NADPH)的激活减缓因ROS过度生成而引起的炎症反应,进而抑制p38 MAPK和胞外信号调控激酶(EPK)等炎症。
2.5 抗肿瘤作用
已有研究证明:吴茱萸碱(EVO)是多靶点的抗肿瘤药物,对乳腺癌[101-103]、肝癌[104-107]、肺癌[108-109]、结肠癌[110-113]、人黑色素瘤[114-116]、宫颈癌[117]、甲状腺癌[118-119]、胰腺癌[120]、膀胱癌[121]、前列腺癌[122-123]、白血病[124]、胃癌[125]、胶质母细胞瘤[126]、尿路上皮细胞癌[127]、卵巢上皮癌[128]、胆管癌[129]、骨肉癌[130]和口腔癌[131]等均具有治疗意义。
Liao等[101]以20 mg·kg-1EVO的剂量腹腔给药于BALB/C裸小鼠的NCI/ADR-RES异种移植瘤模型,发现EVO可浓度依赖性地抑制NCI/ADR-RES细胞的增殖,GI50值为0.59±0.11 μmol·L-1。Du等[102]将MDA-MB-231接种到6周龄雌性小鼠BALB/C无胸腺的乳腺脂肪垫中,腹腔注射10 mg·kg-1EVO能明显抑制体内乳腺癌细胞生长和肺转移,体外机制研究证明EVO可诱导G0/G1期阻滞和细胞凋亡,与B淋巴细胞瘤-2(Bcl-2)、细胞周期蛋白D1(cyclin D1)和周期蛋白依赖性激酶6(CDK6)表达下降以及促凋亡蛋白Bax和激酶抑制因子p27Kip1表达升高有关。Yang等[106]将培养的HepG2肝癌细胞注射到5周龄雌性BALB/C无胸腺裸鼠的右侧皮下,对模型动物以20 mg·kg-1EVO的剂量灌胃治疗13 d后发现EVO显著抑制肿瘤生长,还可抑制信号传导及转录激活因子(STAT3)DNA结合活性,下调原发性肝癌(HCC)中Bcl-2、cyclin D1、抗凋亡蛋白(Mcl-1)、血管内皮生长因子(VEGF)、生存素(survivin)、X连锁凋亡抑制蛋白(XIAP)、基质金属蛋白酶-9(MMP-9)和低氧诱导因子α(HIF1-α)的表达,说明EVO是肝癌的潜在治疗药物。Zhang等[110]在雌性无胸腺小鼠皮下注射LLC细胞建立实验动物肺癌模型,并以1 mg·kg-1EVO的剂量进行瘤内注射治疗,发现单独使用EVO的肿瘤体积小于注射二甲基亚砜(DMSO)作为的对照,使用EVO和选择性胞内磷脂酰肌醇激酶(PI3K)抑制剂(3-MA)的组合治疗的肿瘤体积减小最大,为联合用药治疗肺癌提供了新思路。Huang等[111]用HCT-116细胞接种到4周龄的BALB/C裸小鼠右下腋部,发现EVO可通过下调组蛋白去乙酰化酶抑制剂(HDAC3)影响核因子-κB(NF-κB)及抑癌基因p53编码蛋白的表达,抑制人结肠细胞系HCT-116的体内增殖。Hu等[132]以10 mg·kg-1EVO的剂量灌胃给药,在对雄性BALB/C小鼠BGC-823胃癌细胞来源的异种移植模型的治疗中,EVO和放疗联合组的抑瘤率和细胞凋亡水平明显高于其他组。
此外,吴茱萸次碱可较强抑制S180肉瘤细胞、H22肝癌细胞和人源HepG2肝癌细胞的体外增殖,IC50值分别为19.35、24.81和14.52 μg·mL-1[133]。Xu等[38]研究发现,吴茱萸庚碱可能是潜在的抗肿瘤光敏剂,其光致细胞毒性作用可能是通过抑制PI3K/蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)磷酸化和增加p38 MAPK磷酸化实现。Chen等[134]利用EVO衍生物设计了新型荧光探针来阐明10-羟基吴茱萸碱的抗肿瘤作用模式,该化合物分布在线粒体和溶酶体中,并通过自噬和凋亡机制发挥作用。
2.6 其他生物活性
李晓亚等[135]研究发现,吴茱萸碱(EVO)对前列腺素F2α(PGF2α)收缩的离体子宫平滑肌有舒张作用,对女性痛经有治疗作用。Zhao等[136]研究认为,EVO的硝酸盐衍生物在肿瘤和正常肝细胞之间表现出良好的细胞毒选择性,且分子作用机制揭示其通过线粒体相关的天冬氨酸蛋白水解酶(Caspase)依赖途径导致Bel-7402细胞的细胞周期阻滞于S期并诱导细胞凋亡。Yang等[137]以25 mg·kg-1EVO口服给药,发现EVO可改善腹腔注射CCl4建立肝纤维化大鼠模型的肝组织病理形态学异常。Hu等[132]使用MTT和克隆形成试验在体外证明EVO对辐射的增敏作用,表明EVO在体外能增强辐射对BGC-823细胞周期进程的抑制作用,在治疗26 d后,联合用药组(EVO和放疗联合治疗)的肿瘤质量显著低于其他组,化疗和EVO联合治疗组的肿瘤抑制率(48.8%)明显高于EVO组(12.1%)和放疗组(17.1%),因此,EVO可以作为人胃癌治疗中与放疗联合治疗的良好候选者。
高云星等[138]在博莱霉素气管滴注诱导肺纤维化大鼠模型中,通过皮下注射方式给药,发现300 mg·kg-1吴茱萸次碱(RUT)能明显改善肺组织损伤,显著降低肺组织胶原的沉积。王春华等[139]用夹闭法制造急性肾损伤大鼠动物模型,发现在60 mg·kg-1RUT剂量下具有抗缺血再灌注损伤作用,RUT能够抗脂质过氧化、清除自由基、抗细胞凋亡或阻断应激活化蛋白激酶(JNK)/p38丝裂原活化蛋白激酶(MAPK)信号通路途径的激活。
3 化学合成
在认识到喹唑啉生物碱的高生物活性[140]后,该类化合物的合成日益受到国内外研究人员的关注,尤其是吴茱萸碱[141-143]和吴茱萸次碱[144-150]。
3.1 吴茱萸碱及其衍生物的合成

Danieli等[154]通过构建(7S,13bS)-羧基吴茱萸碱和(S)-色氨酸之间的关系完成了(+)-EVO(S-构型)的合成。Nakayama等[155]通过使用Noyori的钌(Ⅱ)催化的不对称转移氢化反应,发现了1种EVO不对称全合成的简单方法。2013年,Christodoulou等[156]报道了一系列EVO衍生物的合成(图3)。以L-色氨酸为原料,经过2步反应,在甲酸和乙酸酐共同存在下转化为甲酰衍生物,用HCl的二氧六环溶液处理得到化合物,在吡啶存在下环化,以LiOH水解得到酸,进一步与各种胺反应得到所需的EVO衍生物(如化合物52)。同理,以D-色氨酸为原料,可以获得这类化合物的对映体化合物。此外,还能采用拆分外消旋混合物EVO的方法,用(1S)-10-樟脑磺酰氯处理外消旋EVO并进行柱层析分离,得到2个非对映体衍生物,然后对其水解得到纯的对映体(S)-EVO和(R)-EVO。研究发现,不同构型的EVO活性有所不同。抗肿瘤活性实验表明:化合物氮取代基为哌啶基时对H460细胞株具有显著的细胞毒活性。

图2 吴茱萸碱的合成过程Fig. 2 Synthesis process of evodiamine

图3 吴茱萸碱衍生物结构Fig. 3 Structure of evodiamine derivatives
2010年,Dong等[157]基于EVO结构的虚拟筛选,将烷基、苯甲酰基、苄基和酯基等多种基团引入EVO吲哚环的13-N位置,设计并合成了23种EVO衍生物(如化合物53),并对合成的EVO衍生物进行了抗肿瘤活性测试,其中14种化合物可作为人类拓扑异构酶Ⅰ(Topo Ⅰ)抑制剂,体外抗肿瘤活性较好,且对氯苯甲酰基衍生物的抗肿瘤活性最好,IC50值为0.049~2.600 μmol·L-1。
为改善EVO的抗肿瘤活性和溶解性,2013年,Song等[158]设计并合成了一系列13-N取代的吴茱萸碱二聚体衍生物(如化合物54),在干燥的N,N-二甲基甲酰胺(DMF)中,EVO首先被NaH还原,加入烷基卤或对甲苯磺酸酯后,在EVO吲哚环的13-N位发生取代反应得到目标化合物,其中部分化合物具有较好的抗肿瘤活性,对诱导细胞凋亡有较显著的影响。
Dong等[159]合成了一系列新的带有各种取代基的EVO衍生物(如化合物55),发现部分EVO衍生物的抗肿瘤活性较未修饰前显著增加,GI50值低于3 nmol·L-1。在1或2 mg·kg-1的剂量下,10-羟基吴茱萸碱衍生物显示出良好的体内抗肿瘤活性和低毒性,具备开发成新型抗肿瘤药物的可能。
3.2 吴茱萸次碱及其衍生物的合成
吴茱萸次碱(RUT)为吴茱萸生物碱的重要活性成分。自1927年以来,已报道了许多合成RUT及其衍生物的方法,其中,主要由邻氨基苯甲酸和色胺或其衍生物通过复杂的合成过程制备[160-161]。
RUT的合成方法主要是从RUT A、B、C、D和E五元环的不同构建角度进行分类(图4)。在早期的合成研究中,大部分合成方法是以邻氨基苯甲酸和色胺为原料,直到费希尔-吲哚合成(Fischer-indole)方法取得了长足的进步后,RUT的合成才取得了较大的发展,开始通过构建B、C和D环等各种不同的方法来合成RUT[162]。

图4 吴茱萸次碱结构Fig. 4 Structure of rutaecarpine
1)B和C环的构建:Fang等[163]通过铱(Ir)催化构建核心喹唑啉酮结构进而构建RUT。2-氨基苯甲酰胺与乙酰基保护的一元醇反应,构建2-取代的喹唑啉酮结构。在室温下,甲醇-水的混合物体系中,以K2CO3脱去乙酰基保护基,得到羟基类喹唑啉酮,再经过分子内Mitsunobu反应构建RUT的C环,该化合物与原位生成的苯胺的重氮盐反应得到相应的腙,经过进一步的费希尔-吲哚合成构建RUT的B环,从而得到RUT。
2)C环的构建:Bergman等[164]首先采用靛红酸酐与三氟乙酸酐反应,生成2-(三氟甲基)-4H-1,3-苯并噁嗪-2,4(1H)-二酮,再与色胺反应,通过分子内环化构建出目标产物的C环,在乙醇-水混合溶剂中用KOH脱去三氟甲基,从而获得RUT。
3)B、C和D环的构建:首先以邻氨基苯甲酰胺为前体原料,经过4步反应构建RUT的B环,然后构建C环,最后完成D和E环的构建,在整个反应中,采用改良的费希尔-吲哚合成,反应条件较温和,每一步产率均较高,可以达到53%[165-166]。
4)C和D环的构建:以C和D环的构建为主的反应大多是以色胺及其衍生物作为反应前体来合成RUT。Horváth-dóra等[167]以邻氨基苯甲酸和色胺的衍生物为反应原料,在三氯氧磷存在条件下以1种简洁高效的合成方法合成了RUT。此外,还有采用原甲酸三乙酯和色胺反应的方法,先合成N-甲酰基色胺二乙缩醛,再与邻氨基苯甲酸反应,合成3,14-二氢吴茱萸次碱,通过乙酸汞氧化后得到RUT。
近年来,对于RUT生物的研究也越来越受人们的关注。2010年,姜建辉[168]发展了一类取代RUT衍生物的新合成方法,获得2-甲氧基吴茱萸次碱及其衍生物orisuaveoline A、orisuaveoline B(化合物56)等化合物(图5)。具体方法为以色胺为原料,首先构建C环,进一步环合D环得到产物。Bubenyák等[169]通过用苯并噻二嗪-1,1-二氧化物对五元环体系的喹唑啉酮部分进行生物电子等排体替换,从而合成RUT衍生物(化合物57)。反应过程中通过活泼的亚甲基促进苯腙的形成,并通过费希尔-吲哚合成获得目标产物。生物活性测试表明,化合物57对Hela细胞显示出较好的细胞毒活性,能够促进细胞的凋亡诱导作用。

图5 吴茱萸次碱衍生物结构Fig. 5 Structure of rutaecarpine derivatives
3.3 其他喹唑啉化合物的合成
随着人们对喹唑啉化合物的研究越来越广泛,喹唑啉化合物的各种结构功能和药用价值也被进一步发现和利用,越来越受到人们的关注与重视。众多研究者设计合成了大量结构新颖的喹唑啉生物碱,如化合物58至化合物64(图6),不仅丰富了喹唑啉化合物的种类,也为进一步合成和修饰不同种类的喹唑啉生物碱提供了有价值的参考[170-174]。

图6 喹唑啉化合物结构Fig. 6 Structure of quinazoline compounds
4 结论和展望
植物分类归属及命名的变动,导致科研、应用及引用上的混乱,引起植物分类学界的广泛争论。目前吴茱萸属仍然存在各类群间关系、范畴不明确,尚未建立完善的属下分类系统等问题。《中国植物志》记载的吴茱萸属植物20种5变种中有15种已有研究报道,而《Flora of China》将原吴茱萸属植物合并后分别归属到四数花属和蜜茱萸属中,且认为Evodia属植物在中国没有分布。天然的喹唑啉生物碱主要分布于芸香科吴茱萸属植物中,是一类具有特殊生源合成途径、结构罕见和生物活性多样的特征性成分,可作为吴茱萸属植物分类的生化标记物,为该属植物的系统分类提供化学证据,值得进一步深入研究。从植物化学分类学角度来看,本研究认为《Flora of China》的划分与归并有一定的合理性。另外,喹唑啉生物碱也可以作为药材质量及其制剂安全性评价和药动学研究的标志物。
喹唑啉骨架的生物碱是一类重要的氮杂环化合物,结构独特,类型多变。吴茱萸属植物中发现的喹唑啉生物碱主要集中在吴茱萸,其次是石虎、丽江吴萸、波氏吴萸、牛紏吴萸、云南吴萸和楝叶吴萸,其余吴茱萸属植物有关喹唑啉生物碱的报道较少。已有的研究主要集中在吴茱萸,内容涉及化合物的提取分离、结构鉴定、含量测定、工艺、炮制、药理和临床等方面。从吴茱萸中分离得到的主要化学成分有喹唑啉生物碱、喹喏酮类生物碱、柠檬苦素类化合物、黄酮类化合物、苯并吡喃酮类化合物、三萜、甾体和挥发油等。目前,对吴茱萸有效成分药理活性的研究主要集中在吴茱萸碱、吴茱萸次碱和去氢吴茱萸碱上,但对吴茱萸中其他有效成分活性的研究也十分必要,如对结构新颖的喹唑啉二聚体双吴茱萸碱和吴茱萸酰胺C,以及喹唑啉糖苷类化合物吴茱萸次碱-1-O-β-D-葡萄糖苷和吴茱萸次碱-10-O-β-D-芸香糖苷等化合物进行抗肿瘤、抗农业致病菌和杀虫等方面的活性筛选。另外,建议对吴茱萸中具有良好应用前景的单体活性成分的天然药物可以重点研发。
对吴茱萸碱和吴茱萸次碱及其衍生物合成方法的报道较多,这些研究丰富了构建喹唑啉生物碱骨架的方法,为该类化合物的功能,尤其是药用价值研究提供了物质基础。因此,建议对有明确抗肿瘤作用的吴茱萸碱、吴茱萸次碱和去氢吴茱萸碱等活性成分进行结构改造,进一步研究其构效关系,增强其有效性,降低其毒副作用,以进一步开发利用吴茱萸。

