CXCR2蛋白在结肠腺癌组织中的表达及意义*
刘鸿章, 刘力, 周超熙, 李欣慧, 侯敏, 张刚, 刘超, 张涛, 贾雄杰, 林坤峰, 刘晓锐, 张爱民, 赵继东, 张香梅△
河北大学附属医院 1普外科, 2乳腺中心, 5功能科(河北保定 071000);河北医科大学第四医院 3外二科, 4肿瘤研究所, 9胸外科(河北石家庄 050011); 6保定市第一中心医院普外科(河北保定 071000); 7天津市胸科医院麻醉科(天津 300222); 8安新县中医院外科(河北保定 071000)
结肠癌(colon cancer)是世界范围内的常见恶性肿瘤,近年来其发病率呈明显上升的趋势[1]。现有的手术、化疗、放疗等治疗方式,对降低病死率、改善预后的程度有限,患者5年生存率仅50%左右。局部复发及远处转移是疾病治疗失败的关键原因,探寻预测结肠癌患者复发转移相关生物学指标及治疗靶点具有重要的临床意义[2]。趋化因子及其受体在肿瘤发生和转移中起着至关重要的作用[3]。CXCR趋化因子受体2型(CXCR2)在黑色素瘤、肺癌等的血管生成、肿瘤发生和转移中发挥重要作用[4]。肿瘤的生长和进展依赖于自身诱导的新生血管形成,肿瘤微环境中负责血管生成的内皮细胞主要通过表达CXCR2及相关因子来实现这一过程[5]。几个CXCR2参与肿瘤进展和血管生成的小鼠肿瘤模型证明,CXCR2及相关趋化因子的耗竭显著抑制了肿瘤生长,其机制与肿瘤微血管密度降低相关[6-8]。人肿瘤组织中CXCR2的表达水平升高与肝癌、肾癌、肺癌和胃癌的进展及不良预后显著相关[9-11]。然而,CXCR2在结肠腺癌及癌旁组织中的表达情况尚不清楚。本研究拟通过检测CXCR2 蛋白在结肠癌及癌旁组织中表达情况,并分析其与临床病理特征的关系,为结肠癌的诊疗及预后监测提供参考。
1 资料与方法
1.1 一般资料 收集2013年1月至2015年12月于河北大学附属医院腹部外科及河北医科大学第四医院外二科接受结肠癌根治术的 87例结肠癌患者癌组织石蜡标本及临床病理资料。其中,男41例,女46例,年龄41~79岁, 中位年龄53岁。同时收集相应的癌旁组织87例(取自结肠癌根治术中切除的病灶残端,距离癌组织边缘3 cm 以上,切缘阴性)。参照美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版分期系统对肿瘤进行分期,其中Ⅰ期16例,Ⅱ期34例,Ⅲ期37例。选取患者的病理组织学类型均为结肠腺癌,术前均未接受过化疗、放疗及靶向治疗,无远处转移灶。
1.2 方法
1.2.1 主要试剂 CXCR2鼠抗人单克隆抗体、DAB显色试剂盒、抗鼠免疫组化检测试剂盒购自武汉博士德生物技术有限公司,柠檬酸抗原修复液、PBS缓冲液购自北京中杉金桥生物技术有限公司,山羊血清封闭液购自北京博奥森生物技术有限公司。
1.2.2 免疫组织化学染色 所有标本均经10%中性甲醛固定,经常规脱水透明石蜡包埋,4 μm厚连续切片,免疫组化Max Vision TM一步法检测所有患者病理组织的CXCR2表达情况,并按照最新标准复诊原有病理切片。石蜡切片常规脱蜡至水后,以3% H2O2室温下孵育10 min,以阻断内源性过氧化物酶的活性。石蜡切片浸入柠檬酸钠缓冲液热(pH=6.0)抗原修复3 min,自然冷却20 min。滴加鼠抗CXCR2 单克隆抗体(1∶300),4℃孵育过夜。滴加酶标记的二抗,室温湿盒中孵育30 min。DAB显色,苏木精衬染,常规酒精梯度脱水、二甲苯透明、中性树胶封片、光镜观察实验结果。实验中以鼠源IgG1代替一抗作为同种型阴性对照。用慢性扁桃体炎组织切片作阳性对照。
1.2.3 免疫组化结果判定CXCR2表达水平的评分 所有免疫组化染色结果均经两位高年资病理科医生独立阅片完成。每张切片随机选择5个高倍(×400) 视野,以结肠癌细胞细胞质中出现棕黄色或棕褐色颗粒为阳性表达,按阳性细胞数占同类细胞的百分比分类,阳性细胞百分比≥25%判读为CXCR2表达阳性切片。
1.3 统计学方法 应用 SPSS 20.0统计软件,计数资料用率(%)表示,两组计数资料间的比较采用2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CXCR2在结肠腺癌及癌旁组织的表达 87例结肠腺癌组织中,CXCR2蛋白在癌巢中呈普遍表达,个别病例呈局灶性分布。高倍镜下观察,在结肠癌细胞的细胞核和细胞质均有CXCR2蛋白的阳性表达,在癌细胞胞质中呈现棕黄色或棕褐色的阳性颗粒(图1)。CXCR2 蛋白在结肠癌组织中的表达率为66.7%(58/87),在癌旁组织中的表达率为14.9%(13/87)。CXCR2 蛋白在结肠癌组织中表达率较癌旁组织显著升高,差异有统计学意义(2=48.181,P<0.001)。见表1。
2.2 CXCR2表达与结肠腺癌临床病理特征之间的关系 存在淋巴结转移的结肠腺癌组织中CXCR2蛋白的表达率较淋巴结阴性组显著升高,差异有统计学意义(P=0.006)。同时,临床Ⅲ期的结肠腺癌组织中CXCR2蛋白的阳性率较临床Ⅰ~Ⅱ期组显著升高,差异有统计学意义(P=0.039)。存在淋巴结转移和临床分期高的结肠腺癌CXCR2 蛋白表达显著增加,而CXCR2 表达在不同年龄、性别及组织学分级的分组比较中差异无统计学意义(P>0.05)。见表2。
3 讨论
趋化因子由一组结构相关的小分子肽(8~14 kD)组成,主要是碱性的可溶性肽,CXC型趋化因子是其中重要的一类。CXC表示两个半胱氨酸残基在N端附近的位置,X表示任何氨基酸(含半胱氨酸基序)。CXCR2是一个位于细胞膜上的7次跨膜G蛋白偶联受体,包括1个N端、1个C端、3个胞外和3个胞质环。CXCR2的N端位于细胞外,而C端位于细胞内,含有丝氨酸和苏氨酸残基,有助于CXCR2的磷酸化、内化和螯合过程[12]。当CXCR2与相应的配体在细胞外结合后,构象发生改变,激活细胞内偶联的G蛋白,启动相应的信号通路,如肿瘤坏死因子-α(TNF-α)/核因子κB (NF-κB)和蛋白激酶B(PKB/AKT)信号通路等。这些通路与肿瘤细胞的生存、增殖、血管生成、肿瘤生长和转移等病理过程密切相关,也与抗癌治疗的反应性及疗效密切相关[13]。
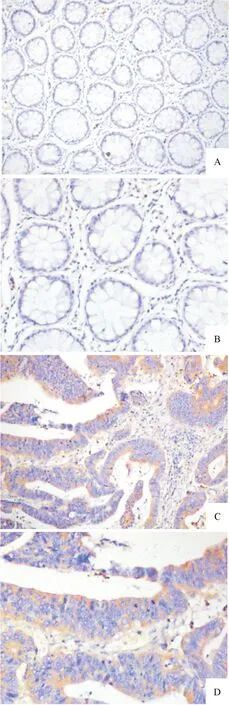
A: CXCR2在癌旁组织中的表达(×40); B: CXCR2在癌旁组织中的表达(×200); C: CXCR2在腺癌组织中的表达(×40); D: CXCR2在腺癌组织中的表达(×200)
图1 CXCR2在结肠腺癌及癌旁组织中的表达

表1 CXCR2在结肠腺癌及癌旁组织中的表达例(%)
CXCR2是人CXC趋化因子CXCL1、CXCL2、CXCL3、CXCL5、CXCL6、CXCL7和CXCL8的G蛋白偶联受体。最初的研究认为,CXCR2的主要免疫功能是调节中性粒细胞的迁移,因为它控制着这些细胞从骨髓组织的迁出,以及它们向炎症部位的迁入[14]。之后的研究证实,CXCR2不但是中性粒细胞迁移的关键介质,在肿瘤的发生、发展中也起着重要作用。在侵袭性肠腺癌小鼠模型中,降低CXCR2的表达后皮肤和肠道炎症性肿瘤的发生,及自发性腺癌的形成均受到显著抑制。同时,抑制CXCR2的功能,也显著降低了小鼠肠道肿瘤的发生,表明CXCR2拮抗剂在治疗癌症方面可能具有治疗和预防的潜力[15]。
本研究中,CXCR2 蛋白在结肠癌组织中的表达率66.7%(58/87)较癌旁组织14.9%(13/87)显著升高(P<0.001)。同时,存在淋巴结转移(P=0.006)、临床分期Ⅲ期(P=0.039)的结肠腺癌中CXCR2 蛋白表达,较淋巴结阴性、临床Ⅰ~Ⅱ期的显著增加,提示其与患者预后不良相关。当前,越来越多的证据表明,CXCR2在肿瘤细胞转移过程中的作用也十分重要。研究发现,CXCR2的缺失可以降低乳腺癌细胞的侵袭和转移潜能[16]。在鼠乳腺癌模型中,CXCR2信号通路对于吸引骨髓来源抑制细胞(MDSCs)进入肿瘤微环境起关键作用,后者是驱动肿瘤侵袭和转移的重要细胞成分之一[17]。与此同时,转移部位的肿瘤通过表达CXCR2进一步吸引MDSCs向转移灶的迁入,促进转移瘤局部微环境的建立。此外,最新的研究证明,中性粒细胞在乳腺癌细胞的转移定植过程中发挥重要作用,而这一过程的实现有赖于肿瘤细胞的CXCR2表达[18]。在小鼠肺癌原位瘤模型中敲除CXCR2能引发相关趋化因子的耗竭,并显著降低了肿瘤的生长速度及肿瘤组织的微血管密度,证实了CXCR2参与肿瘤进展和血管生成[19]。在前列腺癌和胰腺癌中也观察到类似的结果,敲除CXCR2的小鼠肿瘤较小,肿瘤血管生成减少[20-21]。有关CXCR2抑制剂在癌症临床治疗中的应用正处于开发之中[22]。
本研究证实了CXCR2 蛋白在结肠腺癌组织中高表达,与患者预后不良相关。最新的文献报道,亲代结肠癌细胞株与其诱导分化的耐药细胞株中CXCR2、CXCL1、2、3和IL-8蛋白表达水平存在显著差异,耐药细胞株的上述蛋白表达明显升高。CXCR2与CXCL2特异性结合后形成CXCL2-CXCR2轴,在促进细胞株耐药的产生、肿瘤形成、参与血管生成上发挥重要作用。利用siRNAs方法敲低耐结肠癌药细胞株的CXCR2表达后,其Gαi2蛋白、上皮间充质转化相关标志物等均显著降低,而敲低亲代细胞株的CXCR2表达后无此现象,证实了CXCL2-CXCR2轴通过Gαi2蛋白信号发挥作用[23]。
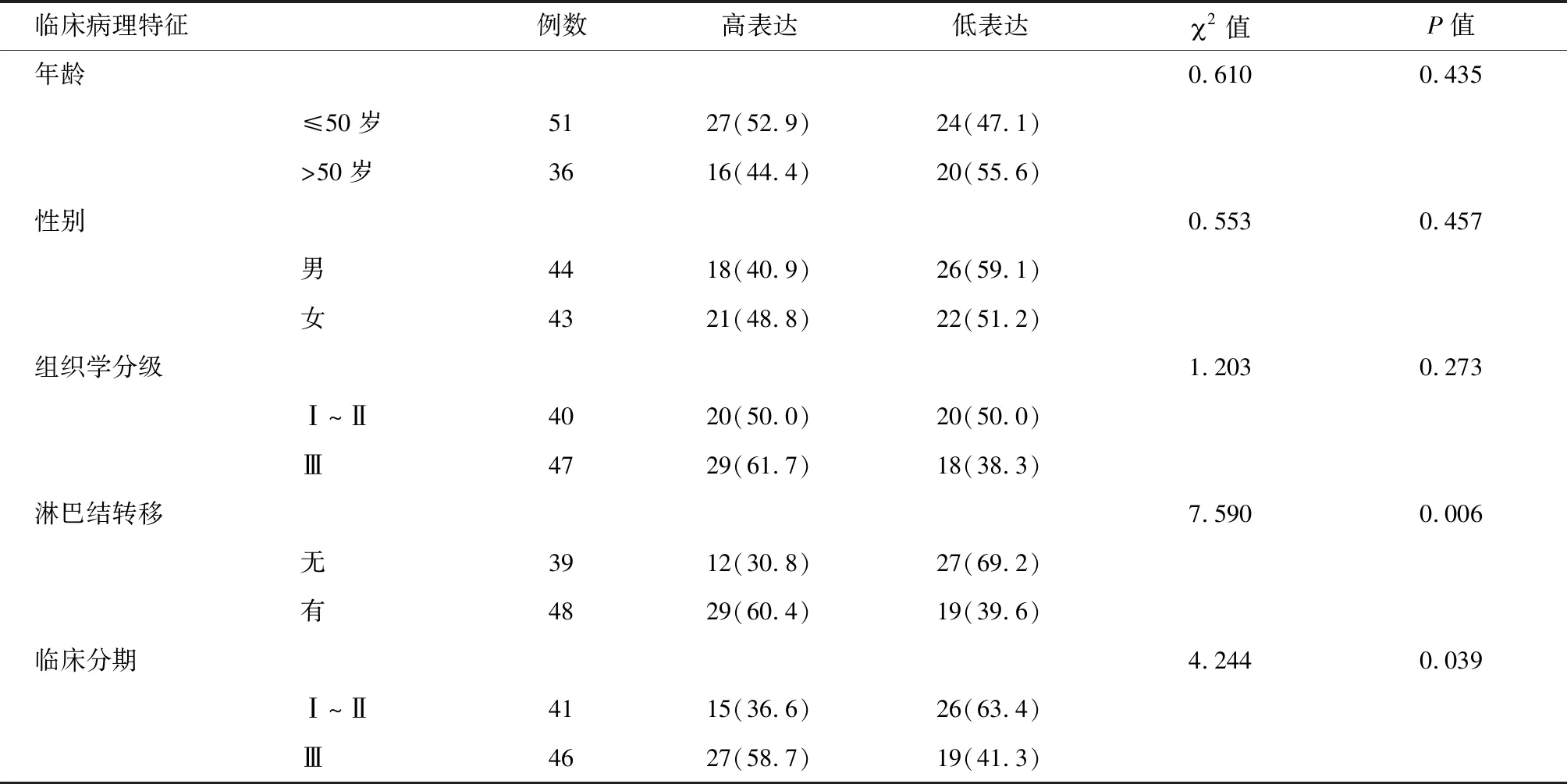
表2 CXCR2表达与临床病理特征之间的关系 例(%)
本研究结果提示了靶向CXCR2是治疗结肠癌及预防术后复发的可行方法之一。有学者发现在肝细胞癌患者中,受体相互作用蛋白激酶3 (Receptor-interacting protein kinase 3, RIP3)表达显著降低,而阻断趋化因子CXCL1-CXCR2轴能为抑制疾病进展相关的免疫治疗提供方法。证实了RIP3缺陷促进了CXCL1-CXCR2轴诱导的骨髓源性抑制细胞MDSCs向肿瘤组织的趋化的积累,进而促进了肝癌细胞的免疫逃逸和疾病进展。而CXCR2拮抗剂可显著抑制RIP3敲除小鼠的MDSC趋化性和HCC生长,为肝癌治疗提供了新思路[24]。
此外,骨转移是恶性肿瘤最常见的死亡原因之一,尤其对于发病率高的肺癌、乳腺癌等[25]。原发性肿瘤的治疗方式相对多,但当患者出现骨转移后,其治疗选择很少。新近的研究发现,CXCR2受体介导的信号转导在骨相关炎症过程中发挥重要作用,其配体CXC趋化因子如CXCL6和CXCL8(IL-8)在骨转移过程中促进骨吸收。研究者利用CXCR2-/-基因敲除小鼠,向其注射cl66-荧光素酶(Cl66-Luc)或4t1-荧光素酶(4T1-Luc)细胞,观察到CXCR2-/-小鼠骨破坏和骨转移减少,验证了CXCR2参与乳腺癌骨溶解和骨转移,为癌症骨转移提供了新方式[26]。
综上所述,CXCR2在肿瘤转移中起着重要作用。本研究证实了CXCR2在结肠腺癌中的广泛表达,存在淋巴结转移、临床分期Ⅲ期的结肠腺癌中CXCR2 蛋白表达显著增加,提示其与预后不良相关。CXCR2不但可作为结肠腺癌复发转移的检测指标,还可针对CXCR2开发相应的靶向抑制剂,为结肠癌的治疗提供更多方式。

