Ⅱ级星形胶质细胞瘤复发恶性变的相关分子特点观察*
孙晓玲, 张晓娟, 张清泉, 邱雷, 王林娜, 侯素平
哈励逊国际和平医院病理科(河北衡水 053000)
Ⅱ级星形胶质细胞瘤是一种呈浸润性生长的低级别胶质瘤。其在星形胶质细胞瘤中有较高发生率[1]。Ⅱ级星形胶质细胞瘤部分会恶性进展,若其发展为多形性胶质母细胞瘤等类型,则会严重影响患者生命安全。有研究表明弥漫浸润性星形胶质细胞瘤或者多形性胶质母细胞瘤的恶性进展与肿瘤基因分子亚型不同有关[2]。弥漫浸润性星形胶质细胞瘤后发生其增殖指数会发生一定变化,同时伴有重要功能分子缺失,诸多分子改变的特点均与基因分型密切相关,星形胶质细胞瘤基因分子表达差异对分子靶点药物研发有重要意义,是目前临床重点关注的课题。因此,本研究通过对收治的57例Ⅱ级星形胶质细胞瘤复发恶性变标本的相关分子特点进行回顾性分析,旨在通过基因分子亚型探索为临床制定Ⅱ级星形胶质细胞瘤复发恶性变治疗方案提供依据。具体报告如下。
1 资料与方法
1.1 一般资料 选取2017年7月至2018年8月收治的57例Ⅱ级星形胶质细胞瘤患者。根据临床进程不同将患者均分为3组(未复发组、复发进展组以及复发无进展组)。57例患者家属均对本研究知情并签署知情协议书,本研究获得伦理委员会批准。未复发组患者共有20例,患者年龄42~72岁,平均(55.38±5.36)岁,男14例,女6例。胶质瘤进展组共有19例,患者年龄41~73岁,平均(53.28±4.67)岁,男12例,女7例。胶质瘤无进展组共有18例,患者年龄41~73岁,平均(55.46±4.82)岁,男10例,女8例。3组患者资料差异无统计学意义(P>0.05)。
1.2 纳入和排除标准 纳入标准:(1)均在手术时经过组织学诊断[3];(2)临床资料完整具有可溯性;(3)均为非初诊病例;(4)首诊均为本院;(5)均为本院同一团队施术者。其中,未复发组纳入标准:临床资料显示患者行手术切除后医院持续随访5年,患者未复发。胶质瘤进展组纳入标准:临床资料显示肿瘤切除后肿瘤复发,判断依据为影像学检查、再次手术发现于原手术部位重新长出肿瘤。术后病理证实肿瘤进展为Ⅲ或Ⅳ级,为恶性病变。复发无进展组纳入标准:术后病理证实肿瘤进展为Ⅱ级改变。
排除标准:(1)临床资料不全者;(2)恶性肿瘤者。
1.3 仪器与试剂 CX31光学显微镜(购自北京索莱宝科技有限公司)、数码相机(上海歌凡生物科技有限公司)。5415 D离心机(购自Gibco公司。EPS-300稳压稳流电泳仪购自上海源叶生物科技有限公司。电子天平(品牌:GB303,产地:美国)。鼠抗人单克隆抗体购自美国Sigma公司。兔抗人单克隆抗体试剂盒购自宝日医生物技术北京有限公司。兔抗人单克隆抗体购自上海研谨生物科技有限公司。生物素标记二抗工作液购自Peprotech公司。分析纯二甲苯购自上海研生实业有限公司。p21、Ki-67、p27测序反应试剂均购自美国BD Biosciences公司。DNA Marker DL 2000由美国Thermo Forma公司提供。
1.4 免疫与组化染色步骤 选取57例Ⅱ级星形胶质细胞瘤切取组织标本作为观察对象,第一步57例Ⅱ级星形胶质细胞瘤标本中性甲醛溶液脱水固定;第二步为常规石蜡包埋。下一步为切片、免疫组化染色、10%过氧化氢室温处理10 min、蒸馏水洗、PBS洗、孵育且之后PBS洗、苏木素染细胞核。采用SP两步法进行免疫组化染色(染色强度评分共3分,无着色为0分,低度染色计1分,3分为重度着色;阳性判断指标以细胞质、细胞核着色即显示为棕色为阳性)。将57例Ⅱ级星形胶质细胞瘤的cDNA与不同稀释度的p21、Ki-67、TP53定植品按参考文献[4]的反应体系以及反应条件进行扩增。mRNA 的表达(反向引物为5′-TCAGACACCTTGCAGACCAG-3′;β-actin 作为内参照,正向引物为5′-ACAGAGCCTCGCCTTTGCCGATC-3′,反向引物为5′-ATCCTTCTGACCCATGCCCACCA-3′)、构建PCR反应体系、分析mRNA相对表达量。标本中的p21、Ki-67、TP53基因的拷贝数根据扩增曲线以及标准曲线进行计算。经过计算得出p21、Ki-67、TP53单位质量的蛋白表达水平。同时对p21、Ki-67、TP53进行基因测序。操作者共有两位,均有丰富的临床工作经验,并且对本次研究不知情,为单盲法判断。
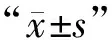
2 结果
2.1 3组57例Ⅱ级星形胶质细胞瘤标本TP53、p21、Ki-67蛋白质分子表达水平对比 复发进展组的TP53蛋白质分子表达水平明显高于未复发组、复发无进展组,差异有统计学意义(P<0.05)。复发无进展组TP53蛋白质分子水平明显高于未复发组,对比差异有统计学意义(P<0.05)。复发进展组p21、Ki-67与未复发组、复发无进展组差异无统计学意义(P>0.05)。见表1。
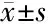

组别例数p21Ki-67TP53未复发组200.313±0.1470.354±0.1220.415±0.162∗△复发进展组190.342±0.1430.302±0.1260.702±0.131&复发无进展组180.331±0.1450.321±0.1230.635±0.126∗
*与复发进展组比较P<0.05;△与复发无进展组比较P<0.05
2.2 57例Ⅱ级星形胶质细胞瘤标本TP53、p21、Ki-67染色强度评分比较 复发进展组、复发无进展组TP53染色强度评分明显高于未复发组,差异有统计学意义(P<0.05)。复发进展组TP53染色强度评分最高,其余p21、Ki-67各组间对比差异无统计学意义(P>0.05)。见表2、图1。

表2 3组TP53、p21、Ki-67染色强度评分比较 分
*与复发无进展组比较P<0.05;△与复发进展组比较P<0.05

A:Ⅱ级星形胶质细胞瘤(HE); B:复发后p21(免疫组化);C:复发前TP53(免疫组化);D:复发后TP53(IHC)
2.3 TP53基因测序情况 在5例组织中发现6个(共4类)突变,包括外显子5、7、8三个外显子(各1例病变),另外1例同时存在2个突变。所有突变者都是恶性进展组病例。在临床基因序列测定中有较小的概率可发现TP53基因突变而TP53未表达的情况。
3 讨论
TP53是Ⅱ级星形胶质细胞瘤复发恶性变的国内外重点研究课题,其是一种被临床较早发现的细胞生长周期负调节因子[5-6]。TP53的核心作用具有调节细胞周期、介导损伤后细胞应激反应以及避免细胞癌变复发恶性变的作用,在避免基因组遗传稳定性受影响发挥了重要的保护作用,此外TP53在决定细胞是否启动DNA合成有着不可或缺的作用。
本研究发现TP53基因在免疫组化意义上过表达,结合现有国内外前瞻性研究分析其过表达意义,这可能是由于TP53基因突变,其介导的TP53蛋白半衰期较之正常TP53明显延长,继而导致TP53蛋白半衰期蓄积、免疫组织化学过表达[7-8]。临床上针对胶质瘤与TP53基因相关性的研究探讨较少,本次研究基于国外关于TP53基因的研究进行实验方案设计,论证了胶质瘤与TP53基因的相关性。
本次研究结果表明复发进展组、复发无进展组TP53染色强度评分明显高于未复发组, 复发进展组TP53染色强度评分最高,其余p21、Ki-67各组间对比差异无统计学意义(P>0.05)。这是因为TP53蛋白抗体不能准确识别野生型TP53与突变型TP53,Ⅱ级星形胶质细胞瘤复发恶性变过程中TP53基因突变、TP53蛋白过表达多为同时发生,在此过程中突变型TP53丧失了维持基因组稳定性以及降低基因突变率等作用[9]。常方圆等[10]在研究中针对恶性外周神经鞘膜瘤组织标本63例进行样本基因组异常情况检测,结果表明63例恶性外周神经鞘膜瘤组织样本中TP53的高表达率分别为30.2%(19/63),此研究结果提示TP53基因突变后功能失活使其监视细胞分裂、基因转录调控以及减慢细胞分裂等作用均发生了变化,TP53的高表达率在恶性外周神经鞘膜瘤发生发展过程中起重要作用。结合上述研究结果分析TP53在Ⅱ级星形胶质瘤中的作用:在正常状况下TP53野生型可起到抑制Ⅱ级星形胶质细胞瘤复发恶性变的作用,并通过监视作用DNA受到损伤或发生变异时促使其自我修复,而在缺乏TP53野生型的表达情况下,DNA损伤修复不能终止在G1期,其是Ⅱ级星形胶质细胞瘤复发恶性变的重要基础之一,这也是复发进展组TP53染色强度评分最高的原因[11-12]。
本次研究结果表明在5例组织中发现6个(共4类)突变,包括外显子5、7、8三个外显子(各1例病变),另外1例同时存在2个突变,这提示所有突变者都是恶性进展组病例TP53在自身结构上具有一定特点,如第5、7、8三个外显子的复等位基因呈现多态性,野生型TP53在5、7、8三个外显子发生突变后转化为突变型TP53基因,其是Ⅱ级星形胶质细胞瘤复发恶性变的重要分子特点之一。并且突变型TP53基因的种类较多,具有癌基因的作用,丧失了负调节作用等,突变型TP53基因后可促进Ⅱ级星形胶质细胞瘤细胞增殖、转化以及恶性病变[13-14]。Fan等[15]在研究中表明Ⅱ级星形胶质细胞瘤的发展过程中TP53发生等位基因丢失,蛋白过度表达等情况,意味着突变型TP53癌基因与Ⅱ级星形胶质细胞瘤的复发与进展有着密切关联,这与本次研究结果较为一致。近年来临床针对TP53基因的研究较多,如董雯等[16]在研究中针对星形胶质细胞活化过程中的信号通路进行分析,小鼠星形胶质细胞基因表达谱芯片检查结果提示p53信号通路在脑缺血再灌注后星形胶质细胞活化过程中具有重要作用,与本次研究认为p53信号通路介导Ⅱ级星形胶质细胞瘤病变的观点一致。此外目前临床研究已经证实TP53基因突变与人乳头瘤病毒感染有着明显关联,对促进宫颈癌的发生与发展有着重要作用,研究结果提示肿瘤抑制基因p53基因外显子突变后会丧失原有的抑癌作用,其是TP53基因突变后参与Ⅱ级星形胶质细胞瘤病变的有力佐证[17]。此外诸多临床研究表明NF-κB及ERK1/2酶介导的p53等编码基因在肿瘤发生与发展时起到了重要作用,肿瘤细胞增殖也主要是通过p53信号通路来完成,当p53尚未突变时其可阻止肿瘤细胞G0期进展至G1期,而随着p53基因突变,其丧失了监控肿瘤细胞增殖的作用,因此在肿瘤细胞G1期时外周血内p53阳性率明显上升,其提示Ⅱ级星形胶质细胞瘤进展及复发与p53阳性率上升有着密不可分的关联[18-19]。
有待进一步研究的问题:Ⅱ级星形胶质细胞瘤复发恶性变的分子特点对指导临床开展靶向治疗有积极意义,TP53基因突变的研究有待进一步深入[20]。由于本研究未采用大样本数据进行实验探索,未能深入探究Ⅱ级星形胶质细胞瘤复发恶性变的分子特点与Ⅱ级星形胶质细胞瘤复发的相关性,使得本次研究结果有一定局限性,突变型TP53基因促进Ⅱ级星形胶质细胞瘤细胞增殖的作用机制有待进一步探究。
综上所述,Ⅱ级星形胶质细胞瘤复发恶性变的分子特点包括TP53基因突变、蛋白质分子过表达,TP53基因突变对提示Ⅱ级星形胶质细胞瘤复发与进展具有重要的预示作用,值得临床重点关注。

