基于iTRAQ技术的天然富硒与非富硒水稻差异蛋白分析
曾 睿 张 果 郑腾达 粟 阳 叶小英 贾晓梅 朱建清
(四川农业大学水稻研究所1,成都 611130) (都江堰市农业农村局2,都江堰 611830) (成都农业科技职业学院3,成都 611130)
同位素标记相对定量和绝对定量技术(iTRAQ)是通过利用同位素标签标记的特异性标记多肽,经质谱分析对样品蛋白或肽段进行准确的定性鉴别和定量分析技术,同时可以对不同样品中蛋白质进行绝对或相对含量的比较,寻找差异蛋白及功能[1]。iTRAQ方法具有良好的定量和较高的重复性,能科学揭示不同生理状态的胞内蛋白质的动态变化过程。目前水稻蛋白质组学的研究发展迅速,已有在水稻各个组织器官、亚细胞表达、突变体、激素诱导和环境胁迫等方面的研究,获得水稻各生长发育阶段组织器官表达特异性以及水稻自身如何通过调控降低对逆境胁迫的影响[2-10],但在水稻品质营养研究中鲜见报道。
本实验采用iTRAQ技术对天然富硒与非富硒水稻进行定量蛋白质组学研究,分析两种不同基因型水稻蛋白质组表达水平的差异,并对差异蛋白质进行GO(gene ontology)功能注释和分类、KEGG代谢通路分析,以获得水稻不同基因型生物学相关的蛋白谱信息,找出天然富硒与非富硒水稻蛋白组表达水平的差异,从而对水稻富硒形成的蛋白质机制提供基础资料。
1 材料与方法
1.1 材料与试剂
通过引进“红宝石”红米种质资源,从现有的水稻品种中筛选出稻米硒含量高的种质资源作为亲缘,选育和培育富硒红米杂交稻Z3057A 、Z3057B。富硒红米杂交稻Z3057B(Oryza sativa L.)和非富硒水稻成恢 727(Oryza sativa L.),由四川农业大学水稻研究所四川省国际科技合作示范基地提供,Z3057B精米中硒元素含量为0.049 mg/kg,达到国家富硒稻米的标准(GB/T 22499—2008,硒含量为0.04~0.30 mg/kg)。
1.2 仪器与设备
Thermo DINOEX Ultimate 3000型高效液相色谱仪;色谱柱为Durashell C18(5 μm,10 nm,4.6×250 mm),Durashell C18分析柱(5 μm,10 nm,4.6×250 mm);AB SCIEX nano液相质谱仪,AB SCIEX分析柱 (75 μm内径,充填3 μm,12 nm的ChromXP C18柱料,长12 cm),NEW objective喷针(20 μm内径,喷针口的直径是10 μm),eksigent Chromxp Trap Column捕获柱(3 μm C18-CL,12 nm,350 μm×0.5 mm);Thermo CV200型真空离心浓缩机;5424 R冷冻离心机;UV-2202紫外分光光度计;7900HT定量PCR反应扩增仪。
iTRAQ Reagents-8plex Kit;BCA定量试剂盒;trizol;ReverTra Ace qPCR RT Kit;SYBR Green Realtime PCR Master Mix;甲醇、丙酮、乙腈、甲酸(色谱纯);胰酶(≥600活力单位/g)。
1.3 方法
1.3.1 蛋白提取
取5 g水稻样品放入200 μL TEAB溶解;15 min超声破碎,12 000 r/min离心20 min取上清;加入4倍体积的冷丙酮(含终浓度为10 mmol/L DTT)沉淀2 h; 12 000 r/min离心20 min,收集沉淀;加入800 μL的冷丙酮(含终浓度为10 mmol/L DTT)重悬沉淀; 12 000 r/min离心20 min,收集沉淀,然后风干沉淀;加入100 μL TEAB溶解蛋白。
1.3.2 蛋白质定量
采用Bradford定量方法定量总蛋白质[11];取11只EP管分别标记,精密量取BSA标准溶液(1 mg/mL)0、2、4、6、8、10、12、14、16、18、20 μL加入相应EP管中,测试样品取1 μL,加入100 μLBCA反应液,涡旋振荡20 s混匀后离心,60 ℃反应1 h,575 nm测定吸光值。制备标准曲线:y=0.392 7x-0.004 8,R2=0.991 4,定量结果见表1。

表1 样本定量结果
1.3.3 酶切和除盐
取100 μg蛋白质,体积整体调节到100 μL,然后加入500 μL50 mmol/L NH4HCO3稀释,加入2 μg Tryspin酶液;37 ℃消化过夜8~16 h;取出上述酶解液,加入等体积的0.1% FA酸化;取出Strata -X C18柱子先用1 mL甲醇活化,然后加入1 mL 0.1% FA平衡;将酸化后的酶解液加入到Strata-X C18柱子中,连续过3次;然后加入0.1%FA+5%乙腈清洗Strata-X C18柱子,连续清洗2次;取一个新的离心管,向Strata-X C18柱子中加入1 mL 0.1%FA+80%乙腈洗脱1次,收集1 mL液体;冷冻抽干后用20 μL 0.5M TEAB复溶。
1.3.4 标记和等量混合
标记采用8-plex标记(具体操作按照试剂盒说明书进行);多个样本标记完以后等量混合。样品标记为S727和S3057。
1.3.5 High pH C18分组分
将混合后的样本分成12个组分, LC-MS/MS条件:A为0.1% 甲酸,5% 乙腈;B为0.1 % 甲酸,95 % 乙腈;上样缓冲液:0.1% 甲酸,3 % 乙腈。LC-MS/MS的液相方法以90 min为例,上样5 μL。质谱结果见表2。

表2 LC-MS/MS质谱检测结果/%
1.3.6 蛋白质鉴定和生物信息分析
本次实验采用基于质谱方法的蛋白质组鉴定基本流程,即对MS/MS质谱数据经过系列优化处理后与数据库进行相似性比较打分从而进行蛋白鉴定。采用ProteinpilotTM V4.5对肽段的MS/MS的数据在水稻转录组数据库中进行检索。选择unused score≥1.3(即可信度水平在95%以上),每个蛋白至少包含一个unique肽段的蛋白为可信蛋白[12],对其进行t检验,当差异倍数达到1.5倍及以上(即up_regulate≥1.5和down_regulate≤0.67),且经过显著性统计检验其P≤0.05时,视为显著差异蛋白。利用注释工具对差异蛋白进行基因功能聚类GO分析,采用KEGG通路数据库对差异蛋白涉及的代谢通路进行分析。
1.3.7 荧光定量PCR(qPCR)验证
为了验证iTRAQ结果,选择部分差异蛋白进行mRNA表达水平的验证。按照Trizol试剂盒操作手册提取总RNA,取1 μg总RNA反转录成cDNA,步骤和体系按照说明书进行。以cDNA为模板,用Real-Time PCR内参基因actin引物做Q-PCR扩增,验证cDNA的质量。反应条件为95 ℃、1 min,1个循环;95 ℃、15 s,60 ℃、30 s,40个循环。实验重复3次,采用2-△△Ct进行相对表达量计算。引物序列使用Primer 5.0 设计和公布的序列(表3),反应程序参照 BIO-RAD CFX ConnectTM Flex Real-Time PCR System 进行。

表3 qPCR 引物序列
2 结果与分析
2.1 质谱鉴定结果
质谱数据经过Proteinpilot软件对水稻转录组数据库进行检索,报告置信度在95%以上的蛋白质共3 235个,其中定量蛋白质有3 161个;差异蛋白为401个,其中上调差异蛋白193个,下调蛋白208个。将鉴定蛋白质分布的理化性质主要范围通过图示化,蛋白分子质量的范围在8.2~611.3 ku之间,等电点的范围在3.48~12.77之间,疏水性的范围在-2.01~1.29之间,见图1。
2.2 生物信息学分析
2.2.1 GO注释
GO是全面描述生物体中基因和基因产物的属性,主要是对蛋白质的分子功能、细胞位置、生物过程进行分析。这401个差异蛋白中主要参与的分子功能有11个,其中占比例较高的前5个是催化活性(42.52%)、离子结合(40.63%)、转运蛋白活性(5.21%)、结构分子活性(4.24%)、酶调节活性(2.49%);细胞位置11个,所占比例较高的前5个是细胞(26.00%)、细胞组分(26.00%)、细胞器(22.30%)、细胞器组分(10.72%)、高分子复合物(5.79%);生物过程26个,其中所占比例较高的前5个主要是代谢过程(17.66%)、细胞过程(17.52%)、应激反应(9.75%)、生物调节过程(7.02%)、细胞组织合成过程(6.75%)。
2.2.2 COG注释
COG(蛋白相邻类的聚簇)是对蛋白质进行直系同源分类的数据库。将鉴定到的差异蛋白和COG数据库进行比对,预测这些蛋白可能的功能并对其做功能分类统计。排列前5位的是一般功能预测(16.91%);蛋白质转换、翻译修饰、蛋白伴侣(12.76%);参与翻译、核糖体结构和生物起源(8.8%);碳水化合物的运输代谢(8.7%);能量生产与转换(8%)。
2.2.3 Pathway代谢通路注释
在生物体内,不同蛋白相互协调行使其生物学行为,基于Pathway的分析有助于更进一步了解其生物学功能。KEGG是有关Pathway的主要公共数据库[13],通过Pathway分析能确定蛋白质参与的最主要生化代谢途径和信号转导途径。
KEGG代谢通路分析表明差异蛋白一共参与90个信号转导通路,其中排名前10的代谢通路为淀粉和蔗糖代谢通路(9.03%)、糖酵解和糖质新生代谢通路(9.03%)、内质网蛋白加工通路(6.94%)、核糖体代谢(6.6%)、光合生物碳固定通路(5.21%)、果糖和甘露糖代谢(4.86%)、半乳糖代谢(4.17%)、氨基酸和核苷酸糖代谢(4.17%)、嘌呤代谢(4.17%)、丙酮酸代谢(4.17%),见表4。


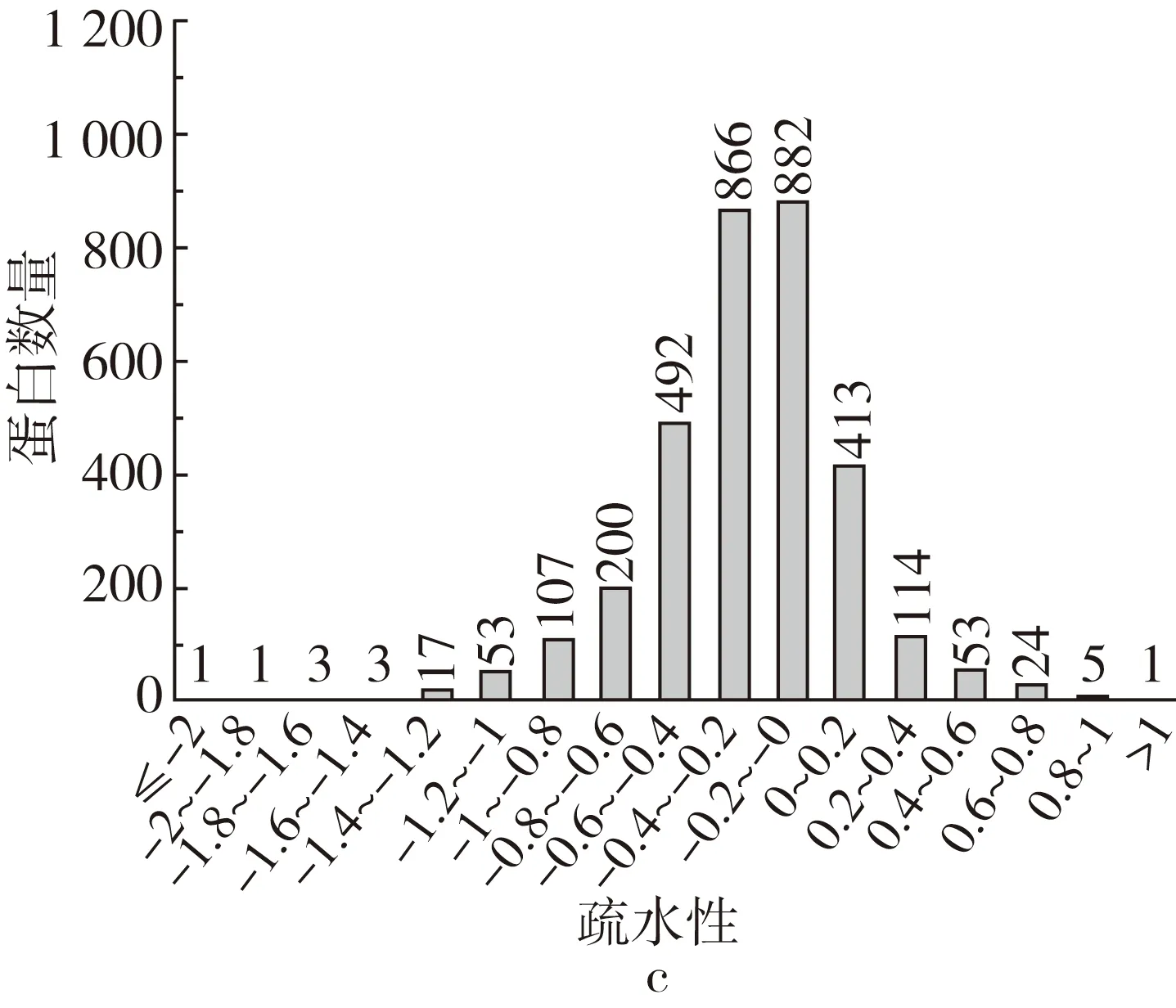
图1 差异蛋白的蛋白分子质量范围、等电点范围及疏水性范围

表4 差异蛋白的代谢通路分析
2.2.5 筛选蛋白的信息
根据差异蛋白的表达量、分子功能和代谢通路,筛选出77个目标差异蛋白,见表5。主要分成10类:氧化还原酶、转移酶、异构酶、热休克蛋白、裂解酶、水解酶、连接酶、合成酶、微管蛋白、肌动蛋白,分别有27、12、7、5、4、12、2、5、2、1个。
2.3 差异基因的qPCR验证
生物体中的基因组是遗传信息的储存体,mRNA是基因表达中间体,蛋白水平是基因功能的执行体,为了验证蛋白质在基因水平上的变化是否和蛋白水平一致,选择了OsAPx02、CatC、riPHGPX、CYS、metE5个蛋白质基因进行qPCR验证(图2)。结果显示,riPHGPX和metE基因的表达水平和蛋白水平呈现出一致性。此外,相对于S3057,S727蛋白下调的OsAPx02、CatC、CYS,在mRNA水平中出现相反的结果。很多研究报道了蛋白质组和转录组的不相关或负相关结果,主要可能是蛋白质的翻译后的修饰(磷酸化、糖基化等)影响蛋白质的分泌和降解[14];不同基因收到转录后调控影响的不一致,从而会导致不同基因水平表达会出现一定的差异;基因转录后mRNA的稳定性与特定的核苷酸及相应的结合蛋白有关[15]。

图2 差异蛋白的qPCR分析
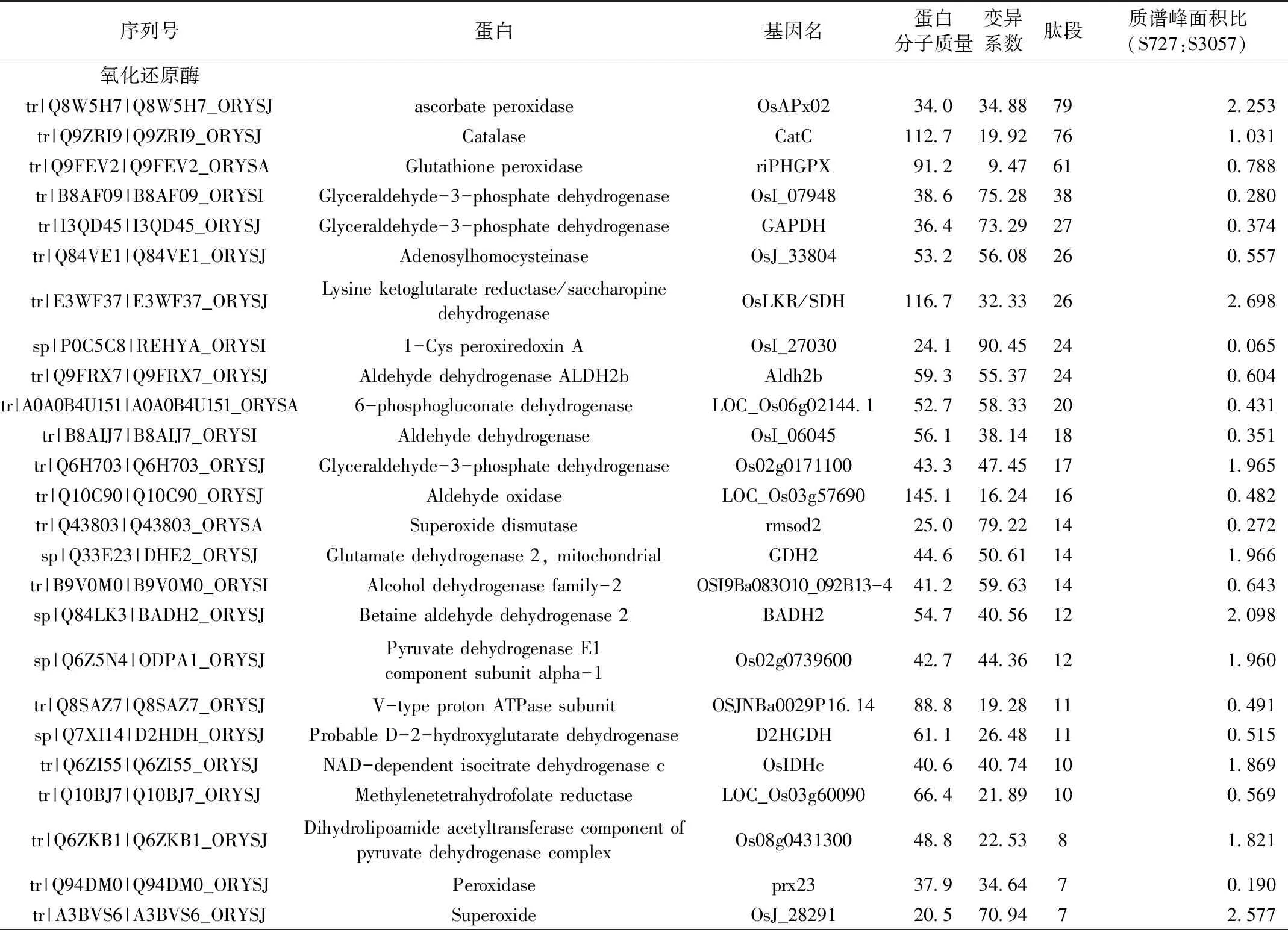
表5 富硒水稻与非富硒水稻之间显著差异的蛋白表达分析

续表5

续表5
3 讨论
实验结果表明,富硒与非富硒水稻在蛋白质组表达水平存在差异,差异蛋白为401个,其中上调差异蛋白193个,下调差异蛋白208个。生物信息学分析得出77个目标差异蛋白,主要分成氧化还原酶、转移酶、异构酶、热休克蛋白、裂解酶、水解酶、连接酶、合成酶、微管蛋白、肌动蛋白。以下为10类目标差异蛋白的功能定性分析。
在27个氧化还原酶中,与天然富硒水稻相比,非富硒水稻中有12个上调和15个下调,这些蛋白主要参与抗应激和生物调节合成过程。其中OsAPx02、CatC、riPHGPX 表达量较高,前两者为上调蛋白,后者为下调蛋白。OsAPx02属于APX(抗坏血酸过氧化物酶)基因家族,属于活性氧酶清除系统的重要成员之一,它参与了细胞内的多种活性氧代谢过程,为维持细胞的正常代谢起了非常积极的作用,研究表明OsAPx02基因可以提高水稻在抗旱、耐盐和耐低温环境下的生长发育作用[16]。CAT是植物体内重要的抗氧化酶,也是植物在生长过程中建立的防御系统关键酶,CAT能抑制H2O2的过量增长,是植物体内控制H2O2水平和植物细胞的氧化还原平衡的重要酶[17],CatC在水稻抗逆性方面起到重要作用,增强水稻的防御能力[18]。riPHGPX属于GSH-Px(谷胱甘肽过氧化物酶)基因家族,通过调控和催化细胞中氧化还原状态发挥重要作用[19]。在两种类型水稻氧化还原酶中,下调蛋白的数目高于上调蛋白,故氧化还原酶在天然富硒水稻中的抗应激、抗氧化和活性氧分解代谢等作用强于非富硒水稻。
在12个转移酶中,与天然富硒水稻相比,非富硒水稻中有4个上调、8个下调蛋白,这些蛋白主要参与碳水化合物和细胞内氨基酸代谢过程,其中CYS和metE的蛋白表达量较高,前者为上调蛋白,后者为下调蛋白。CYS能催化植物合成半胱氨酸[20]。metE参与甲硫氨酸的合成,在细胞代谢中联系蛋白质的合成、甲基转移、多胺和乙烯合成等重要的功能[21]。因此,天然富硒水稻转移酶的碳水化合物代谢和细胞内的氨基酸代谢能力优于非富硒水稻。
异构酶中有7个目标差异蛋白,其中3个上调蛋白,4个下调蛋白,主要参与植物碳水化合物代谢、含氮化合物代谢和植物逆境抗性作用等过程。其中OsI_05445的表达量较高,属于PDI(蛋白二硫键异构酶)基因家族,主要参与在逆境胁迫下对受损蛋白的修复,促进新生肽的合成[22, 23],说明天然富硒水稻在逆境胁迫条件的抗性能力强于非富硒水稻。
在5个目标差异热休克蛋白中,与天然富硒水稻相比,富硒水稻中1个位上调差异蛋白,4个位下调差异蛋白,这些蛋白主要参与抗应激和蛋白质折叠的生物过程。Os01g0180800和OJ1540_H01.1基因表达量最高,前者为Hsp70基因,是最保守和最重要的热激蛋白家族,Hsp70为生物体内组成型表达,在热激状态下表达量显著增加,主要参与新生肽链的成熟与分拣以及分泌蛋白向细胞器或胞外的转运[24]。后者为Hsp90基因,同样具有高度保守性,并参与植物细胞内多种蛋白的正确调控与维持其正常构象与功能,保证细胞在逆境胁迫下能正常存活[25],两者均为下调蛋白,因此在热休克蛋白方面,天然富硒水稻参与抗应激能力强于非富硒水稻。
在4个裂解酶中,与富硒水稻相比,非富硒水稻中有2个上调和2个下调蛋白,这些蛋白主要参与生物合成过程。其中GAD(谷氨酸脱羧酶)的表达量较高,为下调蛋白,GAD是γ-氨基丁酸(GABA)合成的关键酶,具有增进脑活力、安神、调解激素分泌、降血压、治疗癫痫、增强记忆力、改善更年期综合症等多种生物学功能。与非转基因对照比较,转基因植株具有更高的GAD活性和γ-氨基丁酸含量,说明可通过基因工程增强GAD表达来实现GABA累积的目的[26]。故裂解酶在天然富硒水稻中参与生物合成的作用强于非富硒水稻。
在12个水解酶中,与天然富硒水稻相比,非富硒水稻中有7个上调蛋白和5个下调蛋白,这些蛋白主要参与细胞组织调节和生物合成过程,其中PUL(极限糊精酶)基因的表达量最高,为上调蛋白, PUL属于淀粉合成途径中淀粉去分支酶(DBE),在种子发育整个中期和后期阶段高水平表达[27]。在2个连接酶中,主要参与小分子代谢过程,均为上调蛋白。因此,非富硒水稻在淀粉合成途径作用略强于天然富硒水稻。
在5种合成酶中,分别有1个上调和4个下调蛋白,主要参与抗应激和糖代谢过程,其中SUS(蔗糖合成酶)表达量最高,为下调蛋白,蔗糖合成酶为植物蔗糖代谢的关键酶[28],也参与固氮生物合成过程和非生物胁迫反应过程[29],这表明天然富硒水稻中合成酶的糖代谢过程强于非富硒水稻。此外,还有2个微管蛋白和1个肌动蛋白,均为下调蛋白,对于保持细胞形状、运动和信号传导起到关键作用。
4 结论
采用iTRAQ技术的水稻定量蛋白质组学研究方法,找出天然富硒水稻与非富硒水稻蛋白质组表达水平的差异,通过差异蛋白质的生物信息学分析发现,天然富硒水稻的抗应激、抗氧化、活性氧代谢、碳水化合物和氨基酸代谢较非富硒水稻强,但参与淀粉合成途径作用较非富硒水稻弱。由此可推测CYS和metE可能是导致两种类型水稻氨基酸差异的2种关键蛋白,OsAPx02、CatC、riPHGPX和HSP70、HSP90可能是调节两种类型水稻抗氧化和抗应激作用的蛋白基因,这将为以后进一步研究富硒水稻相关基因功能、编码的蛋白的功能及其相应的代谢通路等提供借鉴。

