术前外周血淋巴细胞与单核细胞比值和白蛋白在肾透明细胞癌预后评估中的价值
徐明彬,赵雨桐,黎承杨,赵嘉闻,马晨俊,廖乃凯,杨占斌,程继文
广西医科大学第一附属医院泌尿外科,广西 南宁 530021
世界范围内肾癌(renal cell carcinoma,RCC)在男性癌症患者中占第6位,女性中占第10位,两者分别在各种肿瘤中占到5%和3%的比例[1]。得益于在诊断、手术切除、免疫治疗和分子靶向治疗等方面取得的进展,目前RCC的5年生存率可以达到74%[1]。但是,由于药物治疗无效、局部复发和远处转移等原因,RCC患者在长期随访中生存率仍不理想。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是RCC最常见的类型,20%~30%的患者在诊断时就发现转移[1]。在局限性病变患者当中,行RCC根治术后仍然会有20%~30%发生转移[2]。转移是预后不佳的指标。转移性RCC患者单行干扰素治疗中位生存时间为7.8个月,行肾切除术后辅助干扰素治疗患者中位生存时间也仅为13.6个月[3]。Miyake等[4]发现晚期RCC合并下腔静脉癌栓患者,减瘤术后加行分子靶向治疗或细胞因子合并分子靶向治疗,患者中位生存时间也仅为16.2个月。除了转移因素,影响患者术后预后的因素还有很多,精准预测患者预后有重要的临床意义。目前已经有一些预测模型可以用于预测RCC患者的生存率,如TNM分期、Leibovich预后分数、Fuhrman分级及Mayo临床分期、大小、分级和坏死(stage,size,grade and necrosis,SSIGN)分数等[5]。但是,精确预测个体肿瘤患者的预后是一件非常困难的事,目前的模型多以临床病理学参数作为依据,存在着检测困难、费用高、结果滞后、预测精度有限等缺点,需要不断的补充和改进。
越来越多的证据表明,全身炎性反应与各种肿瘤存在密切关系[6],炎症在肿瘤的发展演进中起着重要的作用[7]。全身炎性反应可以在外周血中反映出来,比如中性粒细胞、血小板计数、C反应蛋白,可以用于评估RCC患者的预后[8]。这些实验室指标都有对应的比值,如中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)[8]、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)[9]和淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)[10],这些指标已经被用于预测多种肿瘤的预后。在这些炎症指标中,LMR是预测ccRCC患者预后最早和最可信的指标[6]。另外,血清白蛋白是一种专门在肝脏合成的急性期蛋白,炎症、应激等全身因素也会影响血清白蛋白水平。血清白蛋白的减少不仅是一种营养不良的状态,也是一种持续的全身炎性反应[11]。贫血和低蛋白血症作为营养和炎症的重要指标,被广泛报道与包括RCC在内的各种癌症的预后较差有关,因此,白蛋白和血红蛋白也可以作为RCC的预测指标[12-13]。
为了提高RCC患者预后评估的准确性,已经有学者将RCC特异性标志物与传统临床病理学参数结合起来,获得较好的结果[6,8-10]。然而目前相关的研究报道仍然较少。本研究探讨外周血LMR和白蛋白与RCC患者临床病理学参数的关系,探讨LMR和白蛋白在传统临床预测模型的基础上对ccRCC预后评估的应用价值。
1 资料和方法
1.1 临床资料
选取2012—2015年在广西医科大学第一附属医院住院确诊ccRCC并行肾切除或肾部分切除术的147例患者。选取标准:病理学检查证实的ccRCC患者。排除标准:非ccRCC、其他肿瘤、双侧RCC、急性或慢性炎症、术前常规实验室检查未能获取的患者。术前患者临床特征包括年龄、性别、肿瘤大小、TNM分期、Fuhrman分级和肿瘤坏死。肿瘤根据2010年美国癌症联合会癌症分期标准[14]进行分期及Fuhrman进行分级[5]。肿瘤大小定义为肿瘤最大直径,肿瘤坏死定义为显微镜下标本有无凝固型坏死。术前实验室检查在术前1周内收集。按SSIGN 0~3分、4~7分、≥8分,把患者分成低危、中危、高危3个组进行分层研究[5],同时,LMR和白蛋白作为二分类变量分别组合成4个组进行分析。所有患者术后随访常规行体格检查、实验室检查、胸片、腹部超声、泌尿系统CT或MRI。前2年每半年复查1次,2年后每年复查1次。总生存期(overall survival,OS)定义为术后至任何原因导致的死亡或随访结束时间。所有患者均签署书面知情同意书,本研究获得广西医科大学第一附属医院伦理道德委员会的批准。
1.2 外周血LMR和白蛋白检测
所有患者外周血于手术治疗前1周用乙二胺四乙酸管收集。采用西斯美康全自动血液学系统检测淋巴细胞和单核细胞的绝对计数,LMR是根据绝对血细胞计数计算的。采用日立7600检测血清白蛋白。
1.3 统计学处理
采用SPSS 21.0、Graphpad Prism 5.0和R语言软件进行统计分析。采用Graphpad Prism对健康体检者及RCC患者淋巴细胞、单核细胞及LMR进行对比。LMR与患者临床病理资料行χ²检验,采用Kaplan-Meier法计算生存率,不同分组患者生存率比较采用log-rank检验。单因素分析有意义的纳入多因素分析,行COX模型分析预后的独立危险因素。因为缺乏公认的LMR截点,我们采用LMR的中位数3.42来确定截点[10]。采用R语言的“rms”数据包来创建列线图。白蛋白水平以40 g/L来确定截点[10]。预测预后采用C指数[15],范围从0.5(没有预测价值)到1.0(完美预测)。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床特征
本研究共纳入108例男性患者和39例女性患者。中位随访时间是45个月(3~65个月)。研究期间共有28例患者死亡。研究期间发现6例患者出现肿瘤转移,其中3例死亡。中位生存时间为36个月。血红蛋白118~142 g/L,中位数130 g/L。白蛋白38~43 g/L,中位数41 g/L。LMR 2.3~4.4,中位数3.3。患者临床特征详见表1。

表1 患者一般临床特征Tab.1 Patient's general clinical characteristics
选取147名健康体检者作为对照,其中78名男性,69名女性。RCC患者和健康体检者的年龄和性别差异无统计学意义(P>0.05)。健康体检者白蛋白35.3~50.2 g/L,中位数42.1 g/L。单核细胞(0.18~3.04)×109/L,中位数0.50×109/L。淋巴细胞(0.41~6.35)×109/L,中位数2.02×109/L。LMR 0.13~11.37,中位数4.32。与健康体检者相比,RCC患者外周血LMR较低(P<0.001),单核细胞计数较高(P=0.008),淋巴细胞计数较低(P=0.006,图1)。
2.2 LMR和白蛋白与其他临床特征的关系
LMR和白蛋白与其他临床特征关系见表2。由表中可见低LMR与高Fuhrman分级(P=0.006)和肿瘤坏死(P=0.039)密切相关;而低白蛋白与高Fuhrman分级(P<0.001)和高SSIGN(P=0.001)有关。
2.3 单因素分析
单因素分析情况见表3。结果提示LMR、白蛋白、TNM分期、Fuhrman分级、肿瘤大小、肿瘤坏死与OS相关,而年龄、性别、肿瘤部位、血红蛋白与OS无关。
进一步把各个变量进行分层研究。根据TNM分期和SSIGN分数进行分组,TNMI+Ⅱ为早期肿瘤,TNM Ⅲ+Ⅳ为晚期肿瘤。SSIGN分成3个组,0~3分为低危组,4~7分为中危组,≥8分为高危组。采用单因素分析LMR和白蛋白与患者生存的关系。在SSIGN低危组中,LMR是OS的独立预后因素(P=0.015)。LMR越低,患者的生存率越低(P=0.001)。在SSIGN中危组和高危组中,白蛋白是OS的独立危险因素(P=0.004)。白蛋白越低,患者生存率越低(P<0.001,图2)。
把LMR和白蛋白结合起来分成4个组,发现患者LMR越低、白蛋白越低,患者预后越差(P<0.001,图2)。在早期肿瘤中,LMR和白蛋白越低死亡风险越高(P<0.001,P=0.001,图3)。而在晚期肿瘤中,白蛋白是OS的独立预后因素(P=0.041,图3)。
2.4 多因素分析
将单因素分析中与OS相关的因素进行多因素分析,结果发现,LMR和白蛋白是OS的独立预后因素(HR=0.370,95% CI:0.145~0.942,P=0.037;HR=0.325,95% CI:0.136~0.775,P=0.011);TNM分期和Fuhrman分级也是OS的独立预后因素(表3)。
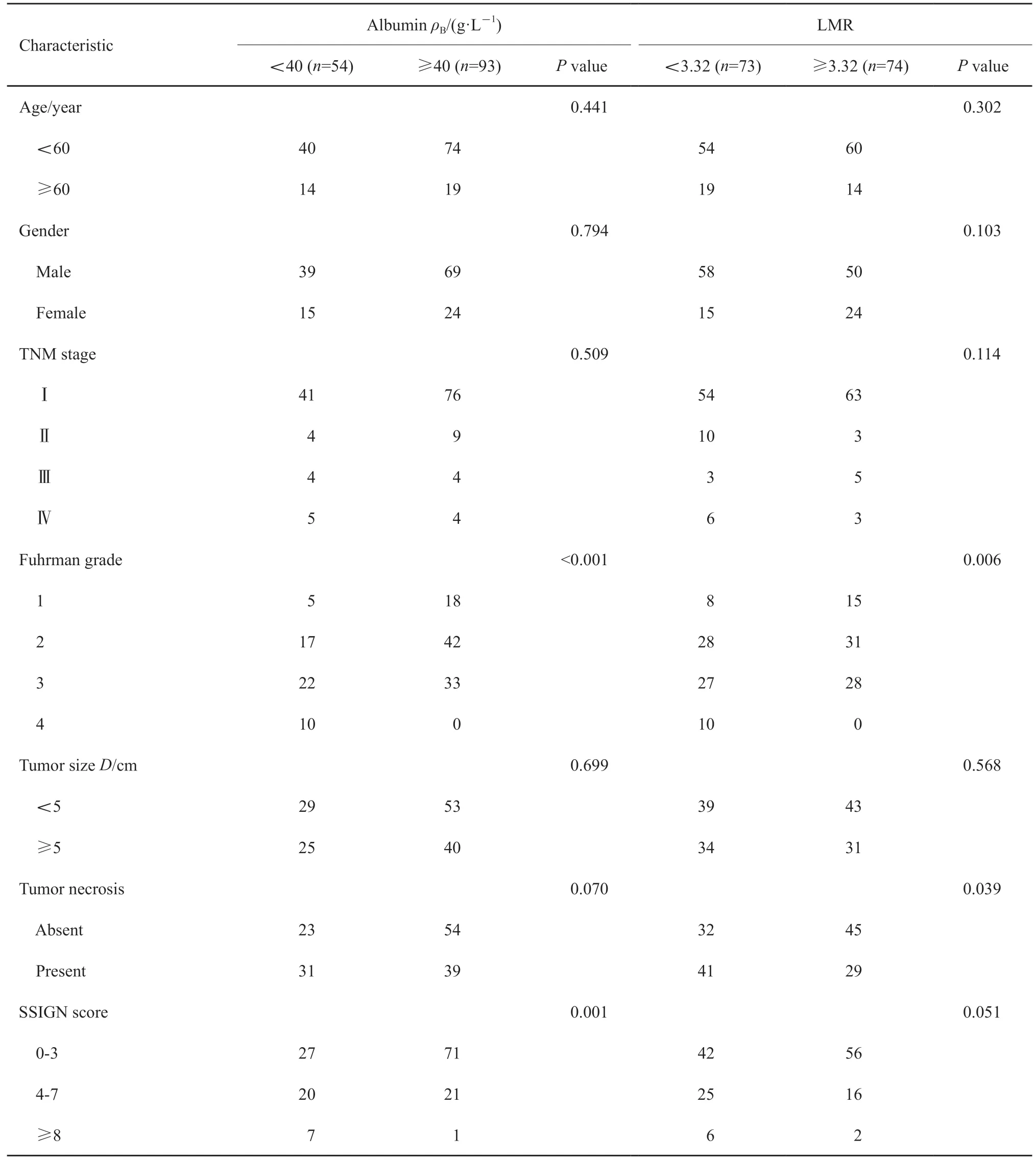
表2 LMR和血清白蛋白和临床病理特征的关系Tab.2 Associations of LMR and serum albumin with clinicopathological characteristics
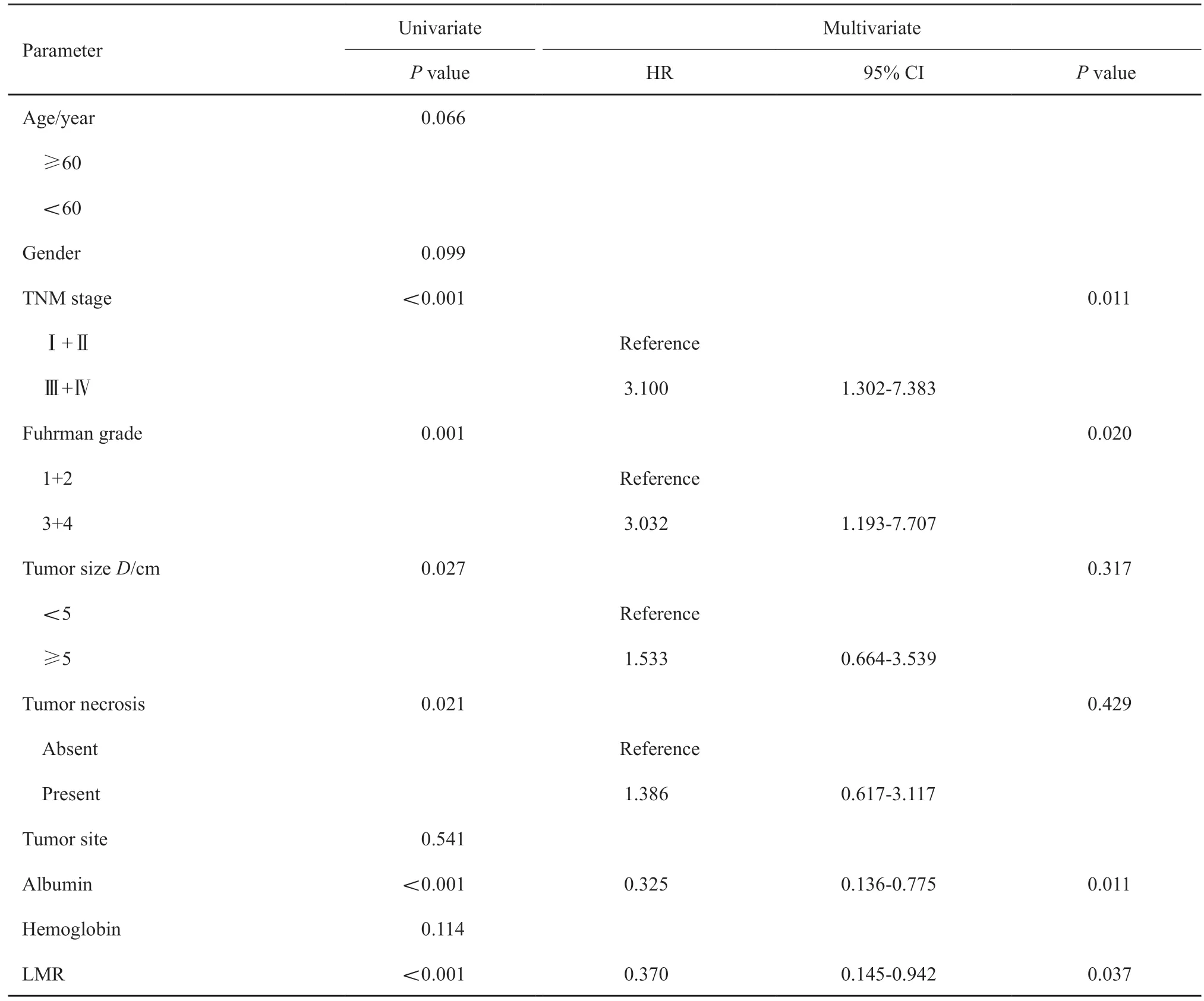
表3 OS的单因素分析及多因素分析Tab.3 Univariate and multivariate COX proportional hazards regression analyses for OS
在多因素分析进行危险分层时发现,LMR在男性(HR=0.293,95% CI:0.098~0.883,P=0.029)和早期肿瘤(H R=0.069,9 5%CI:0.009~0.530,P=0.010)中是OS的独立预后因素(表4)。而在男性(HR=0.286,95% CI:0.112~0.730,P=0.009)、年龄<60岁(HR=0.211,95% CI:0.066-0.680,P=0.009)、晚期肿瘤(H R=0.200,9 5%CI:0.041~0.982,P=0.047)、Furhman分级3+4(HR=0.252,95% CI:0.079~0.800,P=0.019)、肿瘤大小<5 cm(HR=0.065,95% CI:0.009~0.493,P=0.008)、肿瘤坏死(HR=0.236,95% CI:0.074~0.755,P=0.015)中,白蛋白越低,患者预后越差(表5)。
2.5 LMR和白蛋白加入传统预后模型前后C指数变化
C指数用来评价模型的预测能力,C指数越高,评价模型的预测能力越强。将LMR和白蛋白加入传统的TNM分期和SSIGN模型中进行评估。TNM分期的C指数为0.60,加上LMR和白蛋白之后C指数分别为0.71和0.78;SSIGN模型C指数为0.77,加上LMR和白蛋白之后C指数分别为0.79和0.81。把LMR和白蛋白加入传统预后模型TNM分期和SSIGN分数后,C指数为0.82,这表明LMR和白蛋白加入传统预后模型后预测精准程度增加(表6)。
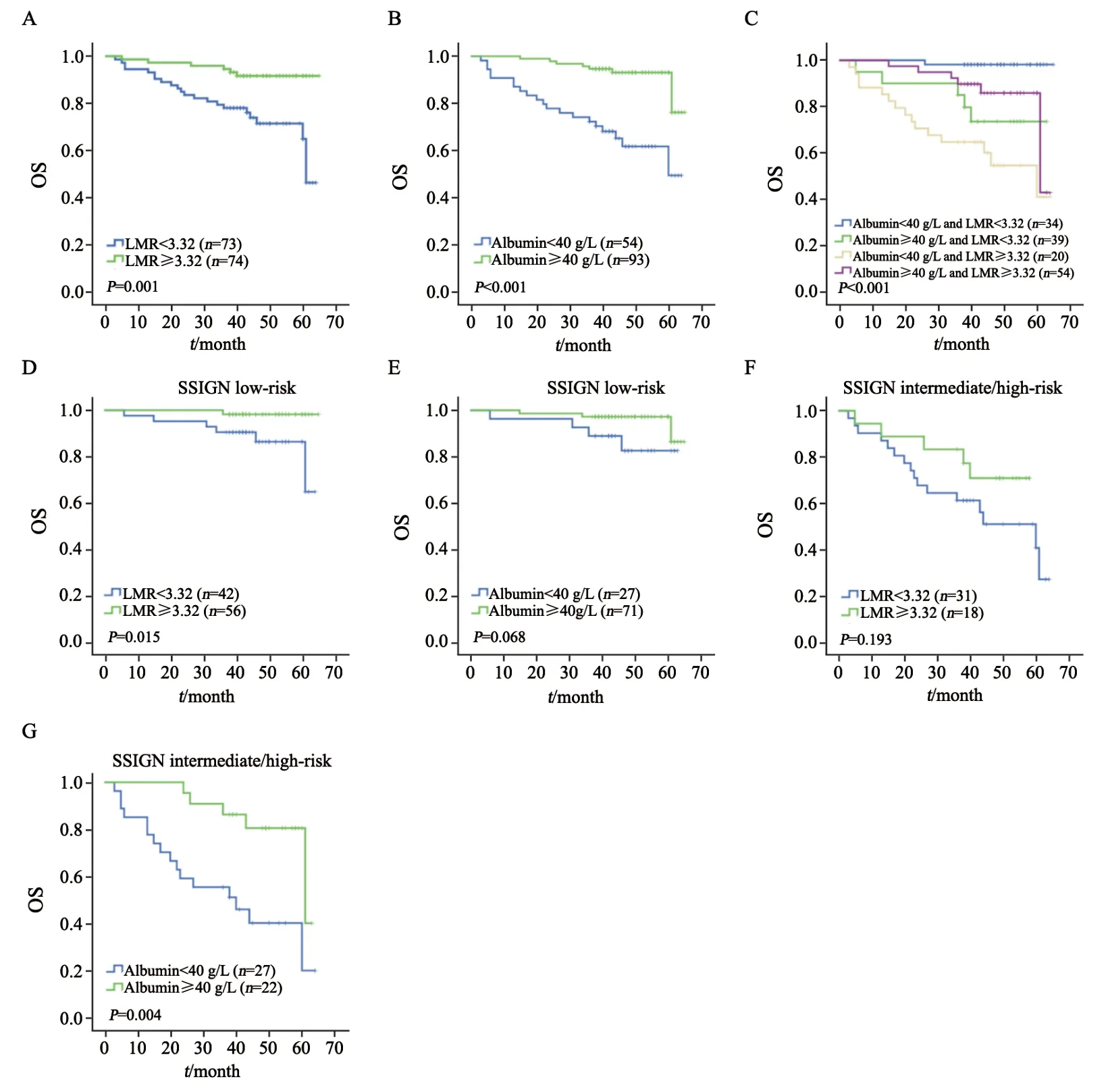
图2 ccRCC患者术前LMR和白蛋白生存分析Fig.2 Kaplan-Meier analysis for OS of ccRCC patients according to preoperative LMR and serum albumin
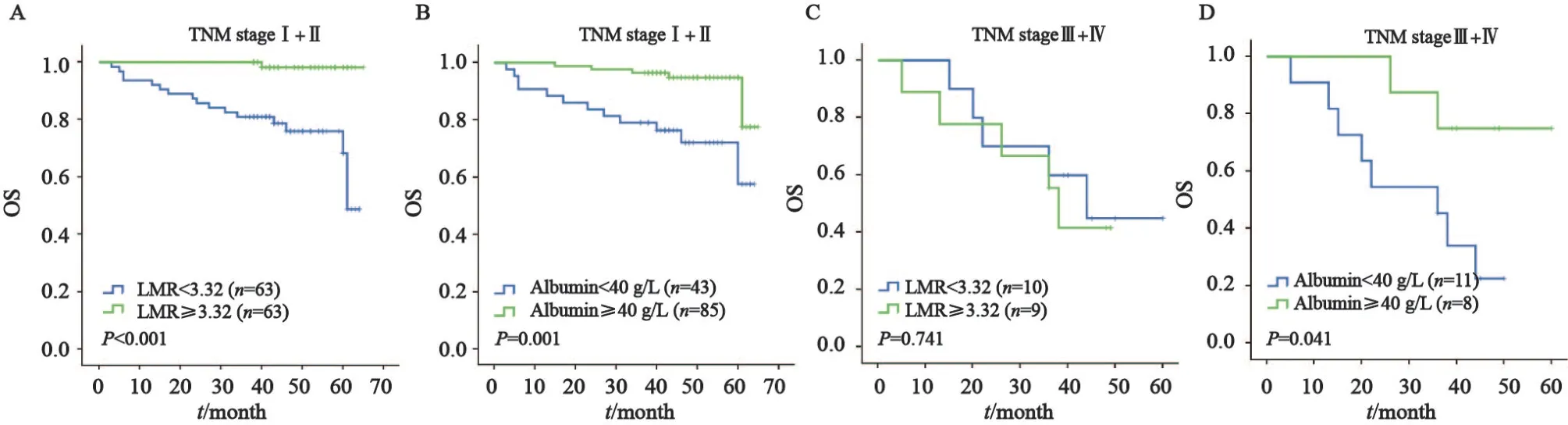
图3 ccRCC患者术前LMR和白蛋白在早期阶段和晚期阶段的生存分析Fig.3 Kaplan-Meier analysis for OS of ccRCC patients according to preoperative LMR and serum albumin in early stage and advanced stage
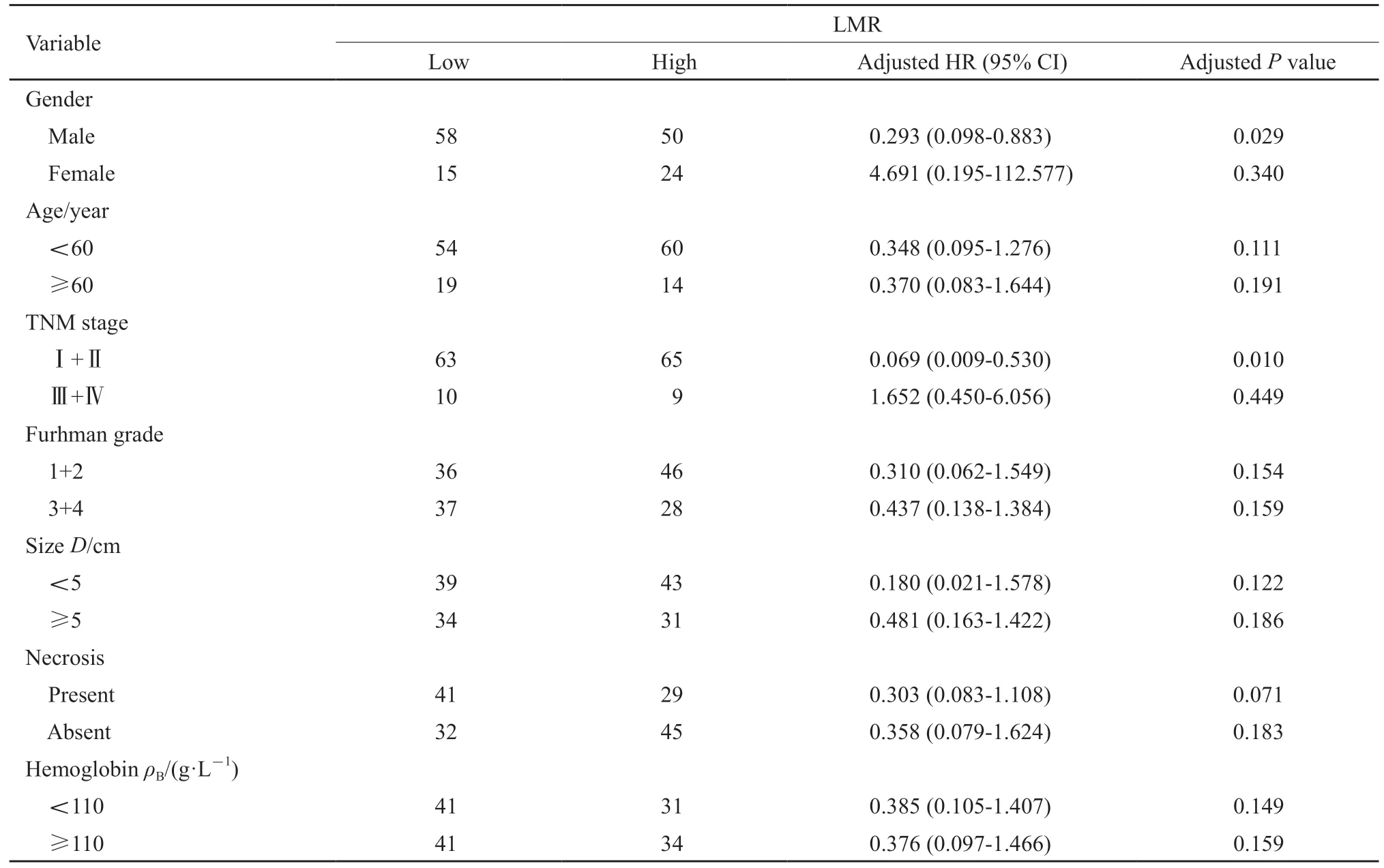
表4 OS的LMR分层分析Tab.4 Stratified analysis of LMR for OS

表5 OS的血清白蛋白分层分析Tab.5 Stratified analysis of serum albumin for OS

表6 LMR和血清白蛋白在ccRCC中的预后价值Tab.6 Prognostic role of LMR and serum albumin in ccRCC
2.6 列线图
为了预测ccRCC患者的生存率,我们根据COX回归模型分析,采用所有OS的独立预后指标,包括TNM分期、Fuhrman分级、LMR、白蛋白,建立列线图(图4A),结果发现可以预测患者术后3~5年内的生存率。在列线图中,总分越高,预后越差。本列线图预测3和5年生存率的校准曲线在理想的模型内验证下表现良好(图4B、C)。
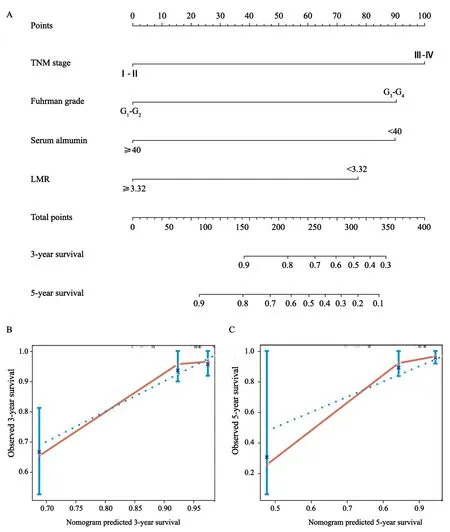
图4 列线图预测肾切除术后ccRCC患者3和5年生存率Fig.4 Nomogram for predicting 3-and 5-year OS of ccRCC patients after nephrectomy
3 讨 论
很久以来炎症就被发现与癌症相关,在肿瘤的发展演进中起着重要的作用[16]。肿瘤相关炎症是指在肿瘤组织、癌症修复、血管生成中炎性细胞的浸润和肿瘤介质的分泌[17]。炎症可能诱发肿瘤微环境的改变,促进肿瘤的演进[18]。淋巴细胞能增强肿瘤免疫监视和抑制肿瘤细胞增生、浸润和转移[19]。当较少的淋巴细胞存在的时候,对肿瘤的免疫应答是不足甚至是缺乏的[20]。而当外周血释放淋巴细胞趋化因子时,往往表明患者预后良好[21]。总的来说,淋巴细胞减少可能反映了机体较差的免疫防御[20]。单核细胞浸润在肿瘤组织中也可以影响肿瘤的发展演进[17]。巨噬细胞是一种分化程度更高的单核细胞,来自于单核吞噬细胞系的细胞,这些细胞具有特定的表型特征[22]。巨噬细胞促进肿瘤细胞的迁移、侵袭和内吞以及肿瘤相关的血管生成[23-24]。由于巨噬细胞的各种表型的形成,单核细胞通常会促进肿瘤的恶性过程。单核细胞通过调节肿瘤细胞对内皮细胞的黏附能力在乳腺癌转移中发挥重要作用[25]。有研究观察到巨噬细胞在肿瘤形成中的血管生成和血管重构中起着重要作用[26-27]。因此,各种巨噬细胞表型的发育促进了肿瘤的形成。炎症细胞和介导因子可能反映在肿瘤微环境的外周循环中,在很多肿瘤中,LMR越低则提示患者死亡风险越高[28]。本研究旨在分析炎症标志物与ccRCC患者预后的关系,结果证实LMR是OS的独立预后因素,LMR越低,患者的生存率越低,进一步提示炎症在肿瘤的发展演进中确实发挥作用。
血清白蛋白是一种肝脏合成的蛋白,它是多种矿物质、激素和脂肪酸的载体分子,也有助于维持肿瘤毛细血管内的压力。血清白蛋白具有急性期蛋白的特点,其血池受多种炎症条件的影响[29]。既往研究发现,血清白蛋白通过调节自分泌生长调节因子的活性,抑制人乳腺癌细胞系的增殖[30]。白蛋白合成可能受到营养不良和系统性炎症的抑制,导致低蛋白血症,从而削弱人体的免疫防御机制[31]。在透析患者中,低蛋白血症比营养不良更容易引起全身炎症。癌症可以激活促炎细胞因子如白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α导致低血清白蛋白浓度[32]。目前已经发现术前血清蛋白是RCC患者的独立预测因子[33],术前血清白蛋白能准确预测局部RCC患者的预后[34]。Morgan等[34]研究发现,术前RCC患者白蛋白越低,术后死亡风险越高。He等[35]提出术前血清白蛋白对球蛋白比值(albumin to globulin ratio,AGR)可以预测RCC患者死亡率,术前低AGR患者的OS明显短于术前高AGR的患者。本研究中,白蛋白是OS的独立预后因素,白蛋白越低,患者生存率越低,与上述研究结果一致。
进一步的分层研究发现,在早期肿瘤中,LMR与OS显著相关,而在晚期肿瘤中差异无统计学意义;而白蛋白在早期肿瘤和晚期肿瘤中均是OS的独立预后因素。这可能与晚期患者数量较少有关。本研究结果提示,低LMR和低白蛋白与晚期肿瘤阶段和不良的预后有关,高LMR和高白蛋白与肿瘤早期阶段和良好的预后有关。此外,将LMR和白蛋白结合起来分组分析发现,患者LMR越低、白蛋白越低,患者预后越差。另外,本研究发现,LMR、白蛋白、TNM分期和Fuhrman分级是OS的独立预后因素。Gu等[22]研究发现,LMR、Fuhrman分级、肿瘤坏死、靶向治疗在多因素分析中是OS的独立预后因素。但Gu等[22]分析的是转移性RCC患者的预后,本研究则包含早期和晚期RCC患者,并且剔除了有靶向治疗的患者,因此本研究适合不同阶段的RCC患者。
本研究将LMR和白蛋白加入传统的TNM分期和Fuhrman分级中进行评估,结果C指数上升,提示这种结合模型在RCC患者预后上有较好的预测价值。然而,将这些经常需要的血液学和实验室标志物与传统的临床病理学特征相结合在RCC中的预后价值,目前仍存在争议[36]。为了更加精准地进行预后评估,目前已经建立了一些列线图来预测多种肿瘤。列线图在预测肿瘤预后上已经被证明比传统的分期系统更加准确[37]。Chang等[38]将SSIGN结合LMR之后C指数从0.71上升到0.75,认为术前LMR可显著提高中高危非转移性ccRCC患者预后的预测精确度。Chang等[10]将血清白蛋白和LMR结合,建立了新的预后评分—系统性炎症评分(systemic inflammation score,SIS),发现高SIS与高TNM分期、高SSIGN和不良预后相关,结合TNM分期、Fuhrman分级和淋巴管浸润,将SIS纳入预后列线图,预测OS的C指数为0.82,增强了预测的精准性。Gu等[39]建立列线图,根据T分期、M分期、肿瘤坏死程度、肉瘤样百分比和NLR来预测肉瘤样RCC患者术后1、2、3年内的死亡率,C指数为0.78。Gu等[40]将血红蛋白和LMR结合起来建立了一种新的预后标志物—全身炎症反应指数(systemic inflammation response index,SIRI),发现SIRI水平高与不良预后、体积大的肿瘤、高T分期、高Fuhrman分级、肿瘤坏死及微血管浸润存在密切联系。结合Fuhrman分级、组织学、肿瘤坏死、靶向治疗、SIRI,形成列线图,预测转移性RCC患者行肾切除术后1~2年内的生存率,C指数为0.75。以上这些研究结果可能有助于临床医师更好地对RCC术后需要辅助治疗、术后密切随访或参与临床试验的患者进行分层。本研究采用LMR和白蛋白,以及Fuhrman分级和TNM分期建立列线图,结果发现可以预测患者术后3~5年内的生存率。该列线图预测3和5年生存率的校准曲线在理想的模型内验证下表现良好。该列线图的C指数为0.82,验证了该图在RCC患者预后上有较好的预测价值。
LMR和白蛋白来源于常规实验室检查,这些参数在外周血中,容易测量,经济,检测简单,容易被广大患者接受,因此可以成为理想的评估ccRCC患者预后的指标[8,41]。本研究结果也进一步提示LMR和白蛋白可以应用于ccRCC患者预后评估当中。然而,本研究仍存在一些局限性:①因为本研究为回顾性分析,会存在选择性偏倚;② LMR的预后价值需要在更大的人群和其他肿瘤人群中进一步研究;③因为临床上没有公认的LMR截点,所以用LMR的中位数来估计其临床价值;④ 由于肿瘤晚期患者数量较少,没有明确评估LMR与晚期肿瘤的关系。
综上所述,本研究发现外周血低的LMR和白蛋白是ccRCC患者不良预后的独立危险因素。将LMR和白蛋白纳入常规的临床病理参数中,可以提高ccRCC患者术后预后的精准性。

