miR-762在胰腺癌中的表达及对胰腺癌细胞生物学行为的影响
焦志凯,冯宁宁,张越山,康 希,杨宝明,李建坤,曹 恒,董 彪,付炯辉,王顺祥
河北医科大学第四医院肝胆外科,河北 石家庄 050011
胰腺癌是中国常见的恶性程度较高的消化道恶性肿瘤之一,危害极大[1-2]。因此,探索胰腺癌发生、发展的分子机制对于疾病防治具有重要的临床意义。miRNA是由18~22个核苷酸组成的内源性非编码RNA,能够与靶基因3'非编码区特异性结合,从而在转录后水平调控靶基因表达。研究发现,多种miRNA在肿瘤组织中异常表达[3-4]。其中miR-762已被证实在乳腺癌、卵巢癌等多种肿瘤组织中高表达,通过调控靶基因表达参与细胞增殖、凋亡、侵袭转移等过程[5-6]。但miR-762在胰腺癌发生、发展中的作用报道较少。本研究检测了miR-762在胰腺癌组织和细胞株中的表达情况,并分析了miR-762在胰腺癌细胞增殖、侵袭转移中的作用及机制。
1 材料和方法
1.1 组织标本及细胞株
收集2016年1月—2019年1月于河北医科大学第四医院行胰腺癌根治术的胰腺癌组织标本35例(包括癌组织及距离其3~5 cm的癌旁组织),术后均经病理学检查确诊,且术前未接受放化疗。人胰腺癌细胞株BxPC-3、PANC-1、AsPC-1、SW-1990和人正常胰腺上皮细胞HPDE购自中国科学院典型培养物保藏委员会细胞库。
1.2 主要试剂及仪器
RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)、TRIzol购自美国Gibco公司;miR-762模拟物(mimics)、miR-762抑制物(inhibitors)及其阴性对照序列(scramble序列)购自上海吉凯制药技术有限公司;LipofectamineTM2000购自美国Invitrogen公司;实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR)试剂盒、反转录试剂盒购自日本Takara公司;鼠抗人E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)抗体购自美国Abcam公司。Chemi DocTM XRS+化学发光凝胶成像系统购自美国Bio-Rad公司;7300型RTFQ-PCR扩增仪购自美国ABI公司。
1.3 细胞培养
细胞用含10%FBS的RPMI-1640培养基,在37 ℃、CO2体积分数为5%的培养箱中常规培养。取对数生长期的细胞接种于6孔板,待细胞融合达80%时采用LipofectamineTM2000将miR-762 mimics、miR-762 inhibitors及其scramble序列分别转染至PANC-1细胞中,不进行转染的细胞为空白对照组。实验重复3次。
1.4 CCK-8实验检测细胞活性
细胞消化后制成单细胞悬液,以2×103个/孔的密度接种于96孔板,每孔200 μL。分别于培养0、1、2、3、4 d时进行CCK-8实验,每孔加入10 μL CCK-8溶液,继续培养2 h,测定450 nm处的吸光度(D450)值。实验重复3次。
1.5 流式细胞术检测细胞凋亡率
转染48 h后收集细胞,4 ℃ 1 000 r/min离心5 min,弃上清,PBS洗涤2次,重悬细胞,加入Annexin V和碘化丙啶(propidium iodide,PI)各5 μL,37 ℃避光染色20 min,采用流式细胞术检测细胞凋亡情况。实验重复3次。
1.6 划痕实验检测细胞迁移能力
转染48 h后,各组细胞接种于6孔板,待细胞融合达100%时用10 μL枪头在培养板底部做一均匀划痕,PBS洗涤3次,加入含2%FBS的新鲜培养基,在倒置显微镜下观察划痕后即刻、48 h时的细胞迁移情况,计算划痕愈合率。划痕愈合率(%)=(划痕后即刻划痕宽度-48 h划痕宽度)/划痕后即刻划痕宽度×100%。实验重复3次。
1.7 Transwell侵袭实验检测细胞侵袭能力
转染细胞48 h后,各组细胞制成1×105/mL的细胞悬液,取200 μL接种到预铺Matrigel基质胶的Transwell上室,下室加入200 μL含10%FBS的培养基,在37℃、CO2体积分数为5%的培养箱中培养24 h后,用棉签刮去基质胶和未穿膜细胞,多聚甲醛固定,0.1%结晶紫染色,显微镜下随机选取5个视野计数穿膜细胞数,求平均值。实验重复3次。
1.8 RTFQ-PCR检测基因mRNA
TRIzol提取细胞总RNA,按照反转录试剂盒说明书合成cDNA。取2 μL cDNA为模板,在ABI 7300型RTFQ-PCR仪上进行PCR扩增。U6为内参照基因,采用2-△△CT法定量目的基因mRNA相对表达量。miR-762及U6引物序列如下:miR-762上游引物5'-ACACGGGGCUGGGGCCGG GGCCGAGCGCCTC-3',下游引物5'-CTCAGG GGCUGGGGCCGGGGCCGAGCCAGA-3';U6上游引物5'-CTCGCTTCGGCAGCACA-3',下游引物5'-AACGCTTCACGAATTTGCGT-3'。E-cadherin、N-cadherin、vimentin及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因引物序列如下:E-cadherin上游引物5'-TGCCCAGAAAATGAAAAAGG-3',下游引物5'-GTGTATGTGGCAATGCGTTC-3';N-cadherin上游引物5'-GAGAACTTTGCCGTTGAAGC-3',下游引物5'-GTGTATGTGGCAATGCGTTC-3';Vimentin上游引物5'-GAGA ACTTTGCCGT TGAAGC-3',下游引物5'-GCTTCCTGTAGGTG GCAATC-3';GAPDH上游引物5'-CTCTGCTCCT CCTGTTCGAC-3',下游引物5'-GCGCCCAA TACGACCAAATC-3'。实验重复3次。
1.9 蛋白质印迹法(Western blot)检测蛋白表达
转染48 h后,提取细胞总蛋白,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,S D S-PA G E)分离后电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,10%脱脂奶粉封闭2.0 h,加入特异性一抗温育过夜,TBST洗膜3次,加入二抗室温温育1.5 h,TBST洗膜3次。ECL化学发光法显色、定影,设GAPDH为内参照蛋白。实验重复3次。
1.10 统计学处理
2 结果
2.1 miR-762在胰腺癌组织和细胞株中的表达
RTFQ-PCR结果显示,胰腺癌组织中miR-762 mRNA表达量为0.91±0.28,显著高于癌旁组织(0.32±0.08)(t=12.30,P=0.000)。胰腺癌细胞株BxPC-3、PANC-1、AsPC-1、SW-1990中miR-762 mRNA的表达量分别为0.57±0.08、1.22±0.32、0.79±0.21、0.96±0.11,显著高于正常胰腺上皮细胞HPDE(0.31±0.08)(t=-4.61、-6.04、-4.67、12.03,P=0.010、0.004、0.010、0.000,图1)。

图1 miR-762在胰腺癌和正常胰腺上皮细胞中的表达Fig.1 Expression of miR-762 in pancreatic cancer and normal pancreatic epithelial cell lines
2.2 转染miR-762 mimics、miR-762 inhibitors对PANC-1细胞miR-762表达的影响
RTFQ-PCR结果显示,转染24 h后,空白对照组、阴性对照组、miR-762 mimics组、miR-762 inhibitors组miR-762 mRNA表达量分别为1.16±0.21、1.12±0.24、9.45±1.23、0.39±0.10。与阴性对照组比较,miR-762 mimics 组miR-762 mRNA表达量显著增加,miR-762 inhibitors组miR-762 mRNA表达量显著降低(t=-13.70、5.10,P=0.000、0.007,图2)。
2.3 miR-762对PANC-1细胞增殖的影响
CCK-8实验结果显示,转染后第2~4天,与阴性对照组比较,miR-762 mimics组D450显著增加,miR-762 inhibitors组D450显著降低(P<0.01,图3)。
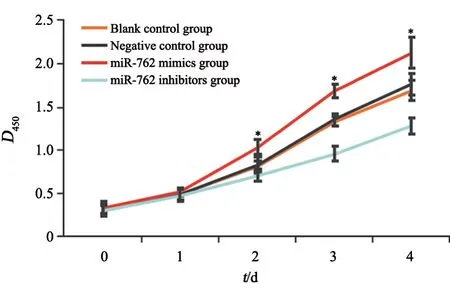
图3 miR-762对PANC-1细胞增殖的影响(CCK-8实验)Fig.3 Effect of miR-762 on proliferation of PANC-1 cells (CCK-8 assay)
2.4 miR-762对PANC-1细胞凋亡的影响
流式细胞术结果显示,转染48 h后,空白对照组、阴性对照组、miR-762 mimics组、miR-762 inhibitors组细胞凋亡率分别为(10.15±2.43)%、(10.00±1.95)%、(3.40±0.77)%、(22.64±3.71)%。与阴性对照组比较,miR-762 mimics组细胞凋亡率显著降低,miR-762 inhibitors组细胞凋亡率显著增加(t=7.95、-7.41,P=0.001、0.002,图4)。

图4 miR-762对PANC-1细胞凋亡的影响(流式细胞术)Fig.4 Effect of miR-762 on apoptosis of PANC-1 cells (flow cytometry)
2.5 miR-762对PANC-1细胞侵袭转移的影响
划痕实验结果显示,转染48 h后,空白对照组、阴性对照组、miR-762 mimics组、miR-762 inhibitors组细胞迁移距离分别为(1.04±0.27)μ m、(1.00±0.24)μ m、(1.79±0.16)μm、(0.34±0.10)μm。与阴性对照组比较,miR-762 mimics组细胞迁移距离显著延长,miR-762 inhibitors组细胞迁移距离显著缩短(t=-11.29、7.68,P=0.000、0.002)。Transwell侵袭实验结果显示,转染48 h后,空白对照组、阴性对照组、miR-762 mimics组、miR-762 inhibitors组穿膜细胞数分别为(196.40±25.13)个、(188.20±26.04)个、(279.40±20.31)个、(92.80±11.08)个。与阴性对照组比较,miR-762 mimics组穿膜细胞数显著增加,miR-762 inhibitors组穿膜细胞数显著减少(t=-4.91、6.67,P=0.008、0.003,图5)。
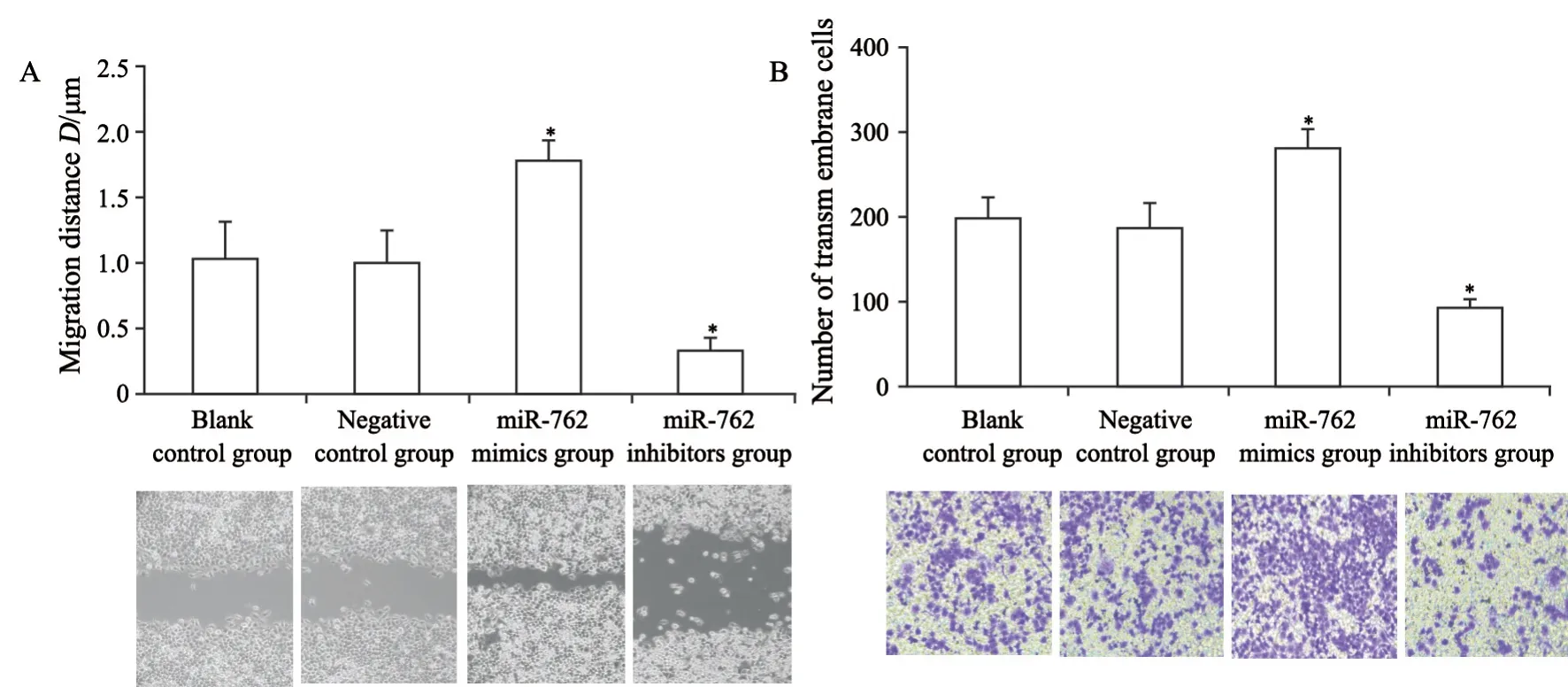
图5 miR-762对PANC-1细胞侵袭转移的影响Fig.5 Effect of miR-762 on invasion and migration of PANC-1 cells
2.6 miR-762对PANC-1细胞上皮-间质转化(epithelial-mesenchymal transformation,EMT)相关标志物的影响
Western blot结果显示,转染48 h后,与阴性对照组比较,miR-762 mimics组上皮细胞标志物E-cadherin表达量明显降低,间质表型细胞标志物N-cadherin、vimentin表达量明显增加(t=7.87、-6.11、-4.53,P=0.001、0.004、0.011);而miR-762 inhibitors组上皮细胞标志物E-cadherin表达量明显增加,间质表型细胞标志物N-cadherin、vimentin表达量明显降低(t=4.13、5.31、6.78,P=0.014、0.006、0.002,图6)。
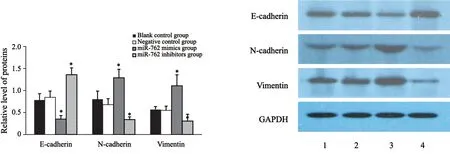
图6 Western blot检测EMT相关蛋白表达Fig.6 Expression of EMT-associated proteins detected by Western blot
3 讨 论
胰腺癌预后极差,与其早期易发生侵袭转移密切相关[7]。研究发现,多种miRNA表达失调在胰腺癌细胞增殖、凋亡及侵袭转移方面发挥重要作用[8-10]。因此,寻找与胰腺癌发生、发展密切相关的miRNA具有积极意义。miR-762与肿瘤关系密切,Hou等[5]发现卵巢癌组织高表达miR-762,与患者预后呈负相关,还发现抑癌基因menin是其下游靶基因。Li等[6]也证实乳腺癌组织和细胞株高表达miR-762,可靶向下调IRF7基因表达。但miR-762在调控胰腺癌发生、发展中的作用尚不清楚。本研究结果表明,胰腺癌组织及4种胰腺癌细胞株中miR-762呈高表达,提示miR-762可能参与了胰腺癌的形成及进展。在此基础上,本研究采用基因干扰技术在胰腺癌PANC-1细胞中过表达和抑制表达miR-762,并采用CCK-8、流式细胞术、划痕实验和Transwell侵袭实验检测调节miR-762表达对PANC-1细胞增殖、凋亡及侵袭转移的影响,结果发现,上调miR-762表达能够显著增强PANC-1细胞的增殖及侵袭转移能力,并抑制其凋亡;相反,下调miR-762表达能够显著抑制PANC-1细胞的增殖及侵袭转移能力,并促进其凋亡。
EMT是肿瘤耐药、干细胞样特性形成及获得更高恶性程度的关键环节[11-14]。在此过程中,上皮标志物E-cadherin表达量降低,而间质标志物N-cadherin、vimentin表达量升高。本研究结果表明,过表达miR-762能够显著上调胰腺癌细胞N-cadherin、vimentin表达,下调E-cadherin表达;而抑制miR-762表达能够显著下调胰腺癌细胞N-cadherin、vimentin表达,上调E-cadherin表达,证实miR-762可能参与调控胰腺癌细胞EMT进程。
综上所述,miR-762在胰腺癌组织和细胞株中异常高表达,通过影响EMT进程促进胰腺癌细胞的增殖和侵袭转移,提示miR-762有可能成为胰腺癌诊断和治疗的潜在靶点。然而,miR-762调控胰腺癌细胞生物学行为的具体靶点仍需深入研究。

