以天青石矿为原料生产高纯硫酸锶工艺研究
李积升 ,魏 明
(1.青海中科盐湖科技创新有限公司,青海西宁810008;2.中国科学院青海盐湖研究所)
1 高纯硫酸锶的应用与联产工艺现状
1.1 高纯硫酸锶应用现状
天青石属稀有金属矿产,其中最有工业利用价值的成分是硫酸锶,国际上已将天青石列为战略物资。中国是世界上最大的天青石生产国,国内现已探明储量为 1 500 万 t[1](以硫酸锶计),青海省柴达木盆地大风山是中国典型的陆相碳酸盐-硫酸盐沉积组合锶矿床,也是中国目前储量最大的锶矿床[2],青海省的天青石储量占中国总储量的80%[3]。以天青石为原料生产的锶产品作为新型材料工业的原料[4],广泛应用于电子、合金、超导材料等领域。硫酸锶作为天青石的主要成分存在于白云岩、石灰岩、泥灰岩和含石膏黏土等[5]的沉积岩中。青海省具有天青石资源优势,天青石精矿平均品位为68%[6]。天青石精矿的主要成分为 SrSO4、CaSO4、CaCO3、SiO2、BaSO4,在后续的生产中需要选择先进的工艺生产出高品质的产品才能增强产品在市场上的竞争力,并且需要坚持产品的系列化和可持续开发的思路,才能使青海省锶产品的生产企业有能力参与国内外市场的竞争,推动青海省锶资源的产业化发展。
高纯硫酸锶作为锶铁氧体的主要原料广泛应用于磁性材料行业[7],如在汽车、家用电器、工业自动控制等电子产品中以优良的磁性能和低廉的价格得到广泛应用。高纯硫酸锶作为人体软骨素用药的主要成分,对骨关节炎发作有抑制作用[8]。在冶炼行业,在金属、非金属中添加适量的硫酸锶,可以改善材料的某种性能或使其具有特殊的性能。高纯硫酸锶添加到玻璃中可吸收紫外线和X射线,是用作阴级射线管面板的理想材料,因此液晶彩电已成为高纯硫酸锶市场消费的主流[9]。硫酸锶也能产生鲜艳的红色火焰[10],常用于烟火的生产。另外,硫酸锶在油漆、涂料中的应用也较多。
1.2 高纯硫酸锶联产工艺现状
目前,众多研究者主要以天青石矿为原料,生产出工业级碳酸锶[11-15]以后,再生产硝酸锶[16]和氯化锶[17-18]等产品。但是对高纯硫酸锶的生产工艺鲜有报道。目前联产工艺也可以生产高纯硫酸锶,其是以天青石矿为原料,经过复分解转化、分解煅烧、浸取及复分解反应等制得高纯硫酸锶产品,工艺流程见图1。

图1 联产工艺生产高纯硫酸锶部分工艺流程图
1)复分解转化。天青石精矿主要成分为硫酸锶,在碳酸氢铵和氨水过量25%并且碳酸氢铵溶液质量分数为15%条件下,维持反应温度为70℃达到3 h,使硫酸锶最大限度地转化为碳酸锶,此时天青石精矿中的水不溶物和其他转化而来的碳酸盐沉淀物均混在碳酸锶中。通水冷却至室温,进行液固分离、洗涤,得到粗碳酸锶、硫酸铵母液和洗液。粗碳酸锶于105~110℃烘干,然后进行焙烧。硫酸铵母液中和蒸发回收副产品硫酸铵,洗液循环返回复分解转化过程。硫酸锶复分解转化反应方程式:
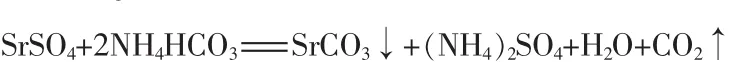
2)粗碳酸锶焙烧。复分解转化得到的粗碳酸锶,添加少量助剂,在1 250℃焙烧分解2~3 h,使之转化成氧化锶熟料和二氧化碳。未分解的粗碳酸锶和不分解的物质混在氧化锶熟料中,在浸取过程中予以去除。碳酸锶焙烧分解反应方程式:
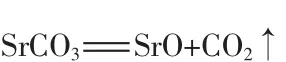
3)氧化锶熟料浸取。粗碳酸锶经高温焙烧得到的氧化锶熟料是活性较高的碱性氧化物,该碱性氧化物与水反应生成氢氧化锶,浸取过程即是利用氧化锶与水反应生成氢氧化锶并放出大量热的特点,并根据其中各组分溶解度的不同,控制分离条件以达到纯化锶的目的。反应过程中,浸取温度在80℃以上,水量为该温度下饱和水量的1.1倍,保温浸取1 h以上并在该温度下进行热分离,即可得到相对纯净的氢氧化锶溶液 (直接碳化得到的碳酸锶就能满足国标优等品的要求),再经结晶、干燥得到氢氧化锶;滤渣洗涤后回收返回参与反应。氧化锶热水浸取反应方程式:

4)制备高纯硫酸锶。将氧化锶浸取得到的氢氧化锶加热溶解,加入回收的硫酸铵溶液,生成硫酸锶沉淀;产生的氨气吸收成氨水,用于复分解转化反应。反应方程式:

1.3 联产工艺存在的问题
以天青石矿为原料的联产工艺经过多道工序生产硫酸锶。联产工艺是发展锶盐下游产品最完善的工艺,生产锶盐产品品种多,是一种理想的生产方法。但是,联产工艺对矿石含量要求高、能耗高、生产工艺长、消耗大量化工原料造成除杂困难、生产成本高,而且硫酸锶收率低、产品质量欠佳,产生的废气、废水、废渣对环境的危害十分严重。因此,急需寻求一种工艺简单、成本低廉、回收率高的生产技术。
2 碳还原法制备高纯硫酸锶
2.1 原理及工艺流程
碳还原法工艺过程简单[19],设备不复杂,其是采用回转窑对天青石矿进行处理。先将天青石精矿中的SrSO4与煤粉按照一定的比例发生氧化还原反应得到可溶性SrS(俗称“黑灰”),然后对黑灰进行热水浸取、除杂、复分解反应等生产高纯硫酸锶。该工艺具有工艺流程短、设备简单、产品质量稳定等优点。
碳还原法制备高纯硫酸锶的原理及工艺流程(见图2):将天青石精矿和煤粉按照一定的质量比配料,在回转窑中煅烧,矿石中的SrSO4被还原成可溶性的SrS,熟料用水浸取,SrS溶入水中,经过多次浸取除杂得到纯净的Sr(OH)2,然后与稀 H2SO4发生复分解反应,经过分离、干燥得到高纯度的SrSO4产品。反应方程式:

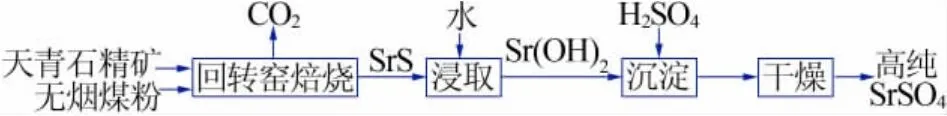
图2 碳还原法制备高纯硫酸锶工艺流程图
2.2 结果与讨论
2.2.1 煅烧温度对硫酸锶转化率的影响
固定条件:天青石精矿和煤粉质量比为5∶1,煅烧时间为50 min。考察煅烧温度对硫酸锶转化为硫化锶效率的影响,结果见图3。从热力学角度分析,在 500 ℃以上时[20],SrSO4的还原反应均可发生,因此煅烧实验设置600℃为起始温度。从图3看出,当还原温度为600℃时,SrSO4转化率还不到26%;煅烧温度为800℃时,SrSO4转化率还不到36%;煅烧温度为1 000℃时,SrSO4转化率为69%;煅烧温度为1 200℃时,SrSO4转化率达到91.95%;再提高煅烧温度为1 300℃,SrSO4转化率达到92.05%,SrSO4转化率变化很小。因此,选择煅烧温度为1 200℃[21]。
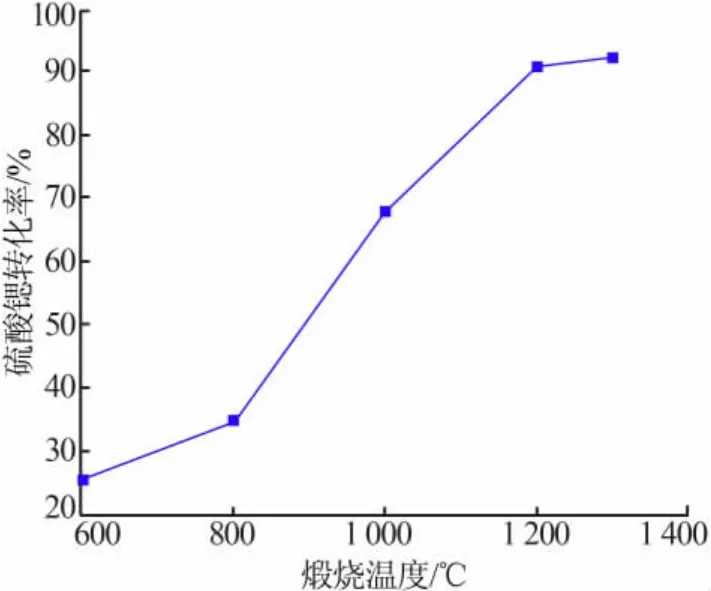
图3 煅烧温度对SrSO4转化率的影响
2.2.2 天青石精矿和煤粉质量比对硫酸锶转化率的影响
固定条件:煅烧温度为1 200℃,煅烧时间为50 min。考察天青石精矿和煤粉质量比(简称配料比)对硫酸锶转化为硫化锶效率的影响,结果见图4。从图4看出,配料比为3.0∶1时,SrSO4转化率达到51.65%;随着配料比的增加硫酸锶转化率逐渐上升,当配料比达到5.0∶1时,SrSO4转化率达到91.95%;继续增加配料比至5.5∶1,SrSO4转化率为92.39%,SrSO4转化率变化不大。因此,选择配料比为5.0∶1。

图4 配料比对SrSO4转化率的影响
2.2.3 浸取温度对氢氧化锶浸取率的影响
固定条件:浸取时间为120 min,固液质量比为1∶6。考察浸取温度对氢氧化锶浸取率的影响,结果见图5。SrS是强碱弱酸盐,遇热水会发生水解。SrS溶入热水中,经过多次浸取除杂[22],得到纯净的Sr(OH)2。由于 Sr(OH)2在水中的溶解度随温度的升高而增大[23],同时在加热条件下会增大SrS的水解率,所以用热水浸取。由图5可知,当浸取温度为50℃时,Sr(OH)2浸取率为 52.02%;随着浸取温度升高,Sr(OH)2浸取率逐渐增大,当浸取温度为90℃时,Sr(OH)2浸取率为 68.96%;继续提高浸取温度达到 100℃时,Sr(OH)2浸取率为 69.02%,氢氧化锶浸取率变化不显著。因此,选择浸取温度为90℃。同时,在此温度下除去熟料中的 Ca、Ba、Mg 等杂质[24],保证 SrS能够完全转化成 Sr(OH)2。
2.2.4 溶液配比对硫酸锶收率的影响
将 Sr(OH)2溶液和 3 mol/L的 H2SO4溶液按照不同的质量比(简称溶液配比)混合,在常温下(25~30℃)搅拌反应60 min,过滤,滤出结晶,将结晶用少量硫酸锶饱和溶液淋洗,抽干水分,烘干结晶,制得高纯SrSO4产品。考察溶液配比对硫酸锶收率的影响,结果见图6。由图6可知,当溶液配比为1∶0.5时,SrSO4收率为68.25%;随着稀H2SO4加入量增加SrSO4收率逐渐增大,当溶液配比为1∶1.1时SrSO4收率为95.52%;随着稀H2SO4加入量继续增加至1∶1.2,SrSO4收率达到 96.02%,与过量 10%结果相差无几。因此,选择硫酸过量10%,即Sr(OH)2溶液和稀H2SO4溶液质量比为1∶1.1。
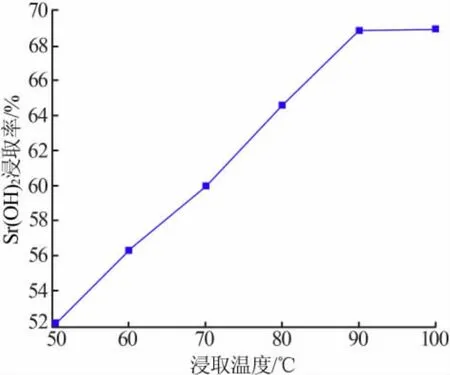
图5 浸取温度对Sr(OH)2浸取率的影响
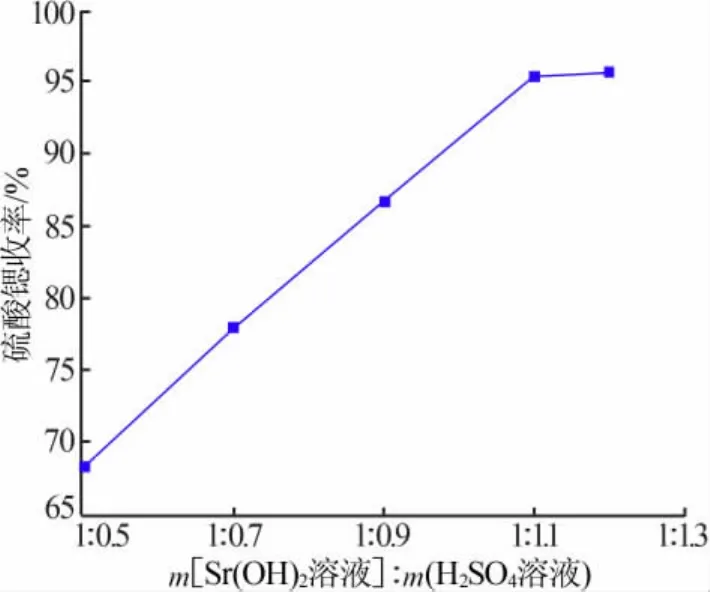
图6 溶液配比对SrSO4收率的影响
2.2.5 产品质量及收率
通过单因素实验确定了最佳工艺条件:煅烧温度为1 200℃、天青石精矿和煤粉质量比为5∶1、硫化锶浸取温度为 90℃、Sr(OH)2溶液与 3 mol/L的H2SO4溶液质量比为1∶1.1。在此条件下进行3次实验,高纯SrSO4收率分别为95.51%、95.55%、95.52%,平均收率为95.53%。实验制备的高纯硫酸锶产品为白色,各项指标达到化学纯要求。具体指标见表1。

表1 高纯硫酸锶产品质量
3 结论
1)碳还原法制备高纯硫酸锶工艺简单、便于生产控制、稳定性好,适用于工业化生产。2)通过单因素实验确定最佳工艺条件:在煅烧温度为1 200℃、天青石精矿和煤粉质量比为5∶1条件下,SrSO4转化为SrS的效果最好;在热水浸取硫化锶的温度为90℃条件下,氢氧化锶的收率最高;在Sr(OH)2溶液和3mol/L的H2SO4质量比为1∶1.1条件下,高纯SrSO4的收率最高。3)实验制备的高纯SrSO4的平均收率为95.53%。实验制备的SrSO4产品为白色,纯度为99.3%,各项指标达到化学纯的要求。

