虹鳟鱼IHNV-M蛋白微球疫苗的制备及其免疫效果
潘璇 田晟源 田洋 李全振 赵宝华


摘要:使用本实验室保存的重组菌株BL21(DE3)(pET-22b-m)经过IPTG诱导,并且经SDS-PAGE验证,在21.6 Ku处有目的蛋白表达;运用乳化-复乳化的方法,制备IHNV-M蛋白微球疫苗。运用灌胃的方法,将制备好的IHNV-M蛋白微球疫苗免疫虹鳟鱼后,经ELISA测定血清中抗体效价。普通虹鳟鱼组和美国金鳟鱼血清中抗体效价分别为1∶128 000和1∶25 600。
关键词:造血器官坏死病病毒;基质蛋白M;微球疫苗;免疫原性
造血器官坏死病病毒(Infectious haematopoietic necrosis virus,IHNV)是一种线性单股负链RNA病毒,属于弹状病毒科(Rhabdoviridae),诺拉弹状病毒属(Novirhabdovirus),可引起鳟鱼等冷水鱼患造血器官坏死病(infectioushematopoietic necrosis, IHN)。IHN是危害水产养殖鲑鱼类的一种非常重要的病毒性疾病,是中国的二类疫病[1]。IHN是以鲑鱼造血器官和其他内脏器官的出血坏死为主要特征的急性、全身性、致死性的疾病;并且具有较强的致病性和高度传染性[2-3]。虹鳟是我国主要冷水鱼养殖种类之一,IHN严重制约着我國冷水鱼养殖产业的发展[4]。目前我国对IHN陆续开展了流行病学、病原学及防控技术等研究,取得了较大进展。其中针对IHNV的检测方法主要有免疫学方法[5]以及分子生物学方法[6-8]等。
本研究通过分子生物学技术,基于本实验室之前对基质蛋白M的研究[9],利用乳化-复乳化的方法制备了IHNV-M微球疫苗,并且对所制备的微球疫苗进行免疫原性分析,为IHNV的防治提供新的思路。
1材料与方法
1.1实验菌株及实验用鱼
菌株BL21(DE3)(pET-22b-m)和BL21(DE3)(pET-22b),由本实验室构建保存。虹鳟鱼取自河北省涞源县昌源鱼场(用于实验的虹鳟鱼保证其体内无抗体)。
1.2诱导重组菌株表达
将重组菌株BL21(DE3)(pET-22b-m)和转化有空质粒的大肠杆菌BL21(DE3)(pET-22b)分别接种于含氨苄青霉素的LB液体培养基中,条件为37 ℃,180 r/min,过夜摇培活化后接种于含氨苄青霉素的LB液体培养基中,V(菌种)∶V(LB)=1∶100,37 ℃,200 r/min摇培,当 OD600达到0.4~0.6 时,加入IPTG至终浓度为0.8 mmol/L,26 ℃,180 r/min诱导培养6 h.诱导的菌体破碎后粗提可溶性蛋白。
1.3虹鳟鱼M蛋白口服微球疫苗制备
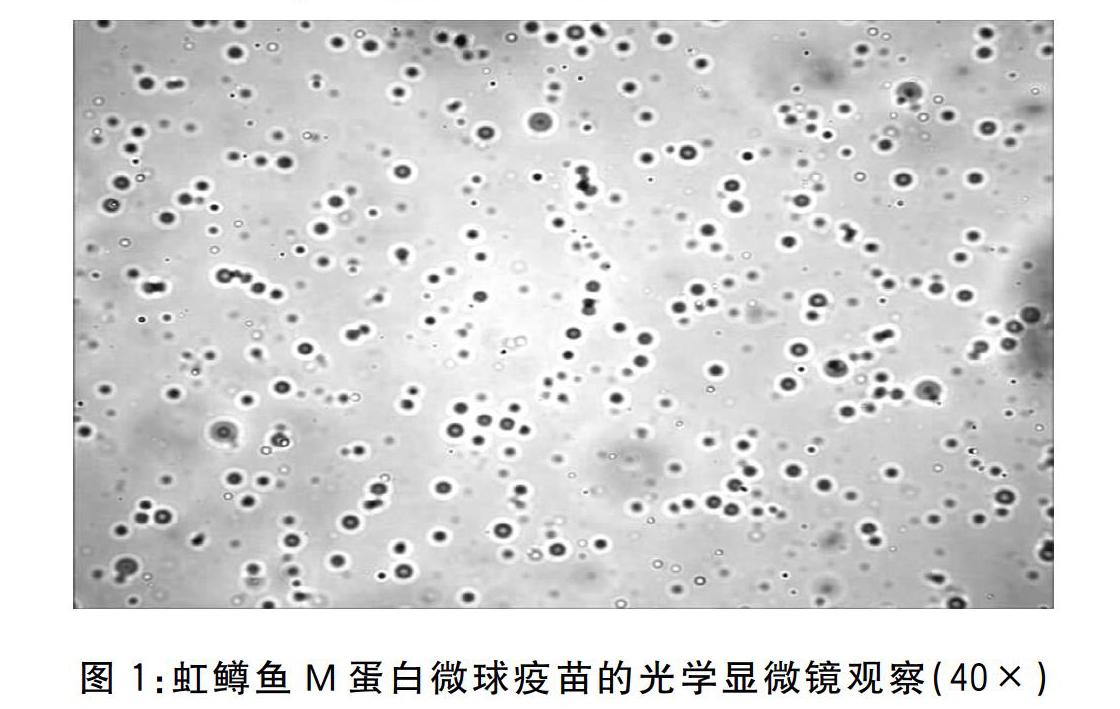
取2 mL M蛋白抗原,加入2 mL 2%的海藻酸钠溶液(4 ℃),加入8 mL大豆油(1%乳化剂Span80)用玻璃棒搅拌混匀后均值乳化(3档,30 min)制备油水预乳液。使用注射器加2 mL 3%的CaCl2-乙酸溶液(4 ℃,60~90滴/min),预乳化后静置30~60 min,吸出上层的油相和水,将混合液离心,8 000 r/min,5 min。使用生理盐水(4 ℃)重悬洗涤沉淀3次,离心弃上清。加入6 mL 1%的壳聚糖溶液,预乳化后8 000 r,5 min,4 ℃离心,弃上清。再分别用75%乙醇和超纯水各洗涤三次沉淀,离心弃上清。将沉淀转移至玻璃培养皿中,加入超纯水制成悬浊液(液面高度不超过1 cm),-80 ℃冷冻过夜后,转至冷冻干燥机进行干燥。
1.4虹鳟鱼M蛋白微球的包裹率及载抗原量的测定
称取100 mg冻干微球疫苗,加入10 mL 006 mol/L的柠檬酸三钠溶液,超声破碎10 min,4 ℃,4 000×g离心10 min,取上清液1 mL,用BCA法测定蛋白浓度,计算回收抗原蛋白总量,重复3次取平均值。按以下公式计算微球的蛋白包裹率以及载抗原量。
包裹率(%)=M实测/M理论×100%
载抗原量(%)=M实测/M×100%
式中:M实测为实际测定的虹鳟鱼M蛋白的质量,M理论为理论上虹鳟鱼M蛋白的质量,M为测量所用的微球疫苗总质量。
1.5虹鳟鱼M蛋白微球疫苗的安全性试验
1.5.1免疫虹鳟鱼血清中抗体效价的测定使用1 mL的注射器采集免疫虹鳟鱼的血液样本,每组随机取5个样本,做好标记,4 ℃静置3 h后离心,取血清,-20 ℃保存。
包被:用包被液将检测抗原M蛋白稀释。包被抗原浓度为10 μg/mL,然后按每孔100 μL加到酶标板上,4 ℃过夜,酶标板预先用紫外线处理15 min;封闭:用洗液洗板3次,将封闭液按每孔200 μL加入到酶标板上,37 ℃放置30 min进行封闭;加待测样品:用洗液洗板3次后,对血清进行倍比稀释,再在酶标板孔中加入相应稀释好的血清。后放置于37 ℃,30 min;洗板三次,加入酶标二抗,每孔100 μL,37 ℃放置30 min;加入显色液:洗板三次,每孔加入100 μL显色液,37 ℃放置30 min;加入终止液:每孔加入50 μL终止液;酶标仪上450 nm下读数,记录数据。
1.5.2分组及免疫实验用鱼共4组,将规格为 75~150 g 的虹鳟鱼随机分为3组,分别为普通虹鳟空白对照组、普通虹鳟一组、普通虹鳟二组,另将规格为50 g左右的美国金鳟分为1组,每组50尾,将鱼分好组放入小型养殖池中。为保证免疫剂量尽量精确,免疫方式采用灌胃法,每组的免疫剂量见表1,一免14 d后进行二免,二免14 d、28 d、55 d后尾静脉取血,测定M蛋白抗体的效价。
驯养一周,免疫前虹鳟鱼禁食12 h。根据每组设定的免疫剂量称量疫苗(见表1),溶于400 μL的PBS。用灌胃针分别灌服微球疫苗,空白对照组不做任何处理。将免疫好的虹鳟鱼放回到正常的池中饲养。初次免疫后14 d同剂量加强免疫一次,空白对照组不做处理。14 d、28 d、55 d后,每组鱼随机取5尾鱼,用1 mL注射器于尾静脉处采血,用于测定M蛋白抗体的效价。
2结果
2.1虹鳟鱼M蛋白微球疫苗粒径、包裹率及载抗原量
虹鳟鱼M蛋白微球疫苗粒径8.0~28.0 μm,平均粒径15.3 μm。微球平均包裹率为5710%。平均载抗原量为1.71%。
2.2虹鳟鱼血清中抗体效价测定
用免疫血清为一抗,BL21(DE3)(pET-22b-m)表达产物为抗原,HRP-羊抗鼠IgG抗体为酶标二抗,进行ELISA检测,结果表明微球疫苗具有很好的免疫原性(见表2,表3,表4)。微球疫苗免疫55 d后普通虹鳟一组(免疫剂量为10 mg/尾)、普通虹鳟二组(免疫剂量为20 mg/尾)和美国金鳟组(免疫剂量为10 mg/尾)虹鳟鱼血清中抗体效价分别为1∶12 800,1∶12 800,1∶25 600。
2.3虹鳟鱼的微球疫苗免疫试验
将重组菌株BL21(DE3)(PET-22b-m)表达的M蛋白通过乳化-复乳化的方法制备成微球疫苗,采用灌胃的方法免疫虹鳟鱼,对照组不做处理,二免2周后检测血清中的抗体效价,
结果表明,灌胃微球疫苗对普通虹鳟幼鱼有一定的保护作用,其效价为1∶12 800。普通虹鳟一组和普通虹鱒二组表现出一样抗体效价,说明增加剂量对虹鳟鱼的效价没有太大影响。另外,使用相同剂量的微球疫苗对普通虹鳟鱼和美国金鳟鱼进行免疫后,发现个体较小的美国金鳟鱼血清中产生的抗体效价为1∶25 600,明显高于普通虹鳟鱼组,此结果说明,该微球疫苗相对于虹鳟鱼体重的免疫剂量越大效果越好。
3讨论
春夏交替时节是虹鳟鱼造血器官坏死病(IHNV)的高发时节,给渔民带来了巨大的经济损失。虹鳟鱼幼鱼在感染IHNV后会出现体色变黑,腹部膨胀,肛门处拖着不透明或棕褐色的假管型黏液粪便。鱼鳃苍白,头部之后的侧线上方皮下出血等症状,致死率高达100%[10]。
目前国内对于IHNV的M蛋白的报道比较少见,对其疫苗的免疫效果研究也并不深入。本文中,作者采用乳化-复乳化法[11]利用海藻酸钠-壳聚糖包被M蛋白, 通过灌胃微球疫苗的方法免疫虹鳟鱼, 采用间接ELISA法检测免疫后虹鳟鱼的血清抗体水平。结果显示, 通过灌胃微球疫苗免疫的虹鳟鱼对IHNV具有明显的抵抗作用。目前,国内外对虹鳟鱼IHNV的预防研究方法广泛,例如:核酸疫苗[12]、活载体疫苗[13]、灭活苗[14]、DNA疫苗[15]等。本文主要研究的是蛋白疫苗,目前,这种疫苗的可控性较高,并且可以达到免疫剂量好控制、免疫方法易操作的目标。故本文研究的蛋白疫苗更有应用前景。
参考文献:
[1] LaPATRA, SCOTT E.The use of serological techniques for virus surveillance and certification of finfish[J]. Annual Review of Fish Diseases, 1996, 6((not defined)):15-28.
[2] 茆安婷, 尹玉伟, 代静,等. 传染性造血器官坏死病毒研究进展[J]. 中国兽医杂志, 2017(10):88-91.
[3] 王全意. 虹鳟鱼传染性造血器官坏死病防控技术[J]. 甘肃畜牧兽医, 2018, 48(08):63-65.
[4] 胡潜. 传染性造血器官坏死病毒(IHNV)研究进展[J]. 现代农业科技(07):273-277.
[5] 焦雪, 吉尚雷, 张培军, 等. 传染性造血器官坏死病病毒(IHNV)分离株病原学研究及全基因组序列分析[J]. 中国兽医杂志, 2017(03):41-44.
[6] 高欣. 虹鳟鱼IHNV甘肃分离株全基因图谱的绘制及灭活苗的研制[D].兰州:甘肃农业大学,2017:44-51.
[7] KIM C H , DUMMER D M , CHIOU P P,et al. Truncated particles produced in fish surviving infectious hematopoietic necrosis virus infection: Mediators of persistence[J]. Journal of Virology, 1999, 73(1):843-849.
[8] ARN MARTINEZ. Nested PCR improves detection of infectious hematopoietic necrosis virus in cells coinfected with infectious pancreatic necrosis virus.[J]. Journal of Virological Methods, 1999, 81(1-2):1-9.
[9] 安红艳, 孙红岩, 高洁,等. 虹鳟鱼造血器官坏死病病毒(IHNV)m基因的表达及免疫原性分析[J]. 河北师范大学学报(自然科学版), 2016(5):434-438.
[10] 李守湖. 传染性造血器官坏死症活载体疫苗的研制[D]. 兰州:甘肃农业大学,2017:44-48.
[11] 包德才, 樊兆敏, 赵莹,等. 膜乳化-复乳化法制备载蛋白高分子微球[J]. 渤海大学学报(自然科学版), 2008, 29(4):303-307.
[12] 李渊, 赵景壮,刘淼,等. 传染性造血器官坏死病核酸疫苗的构建及其抗性基因对环境细菌抗性的影响[J]. 中国水产科学,2018,25(1):220-227.
[13] 李守湖. 传染性造血器官坏死症活载体疫苗的研制[D]. 兰州:甘肃农业大学,2017:33-43.
[14] 高欣. 虹鳟鱼IHNV甘肅分离株全基因图谱的绘制及灭活苗的研制[D].兰州:甘肃农业大学,2017:44-50.
[15] BALLESTEROS N A , ALONSO M , SYLVIA RODRIGUEZ SAINT-JEAN, et al. An oral DNA vaccine against infectious haematopoietic necrosis virus (IHNV) encapsulated in alginate microspheres induces dose-dependent immune responses and significant protection in rainbow trout (Oncorrhynchus mykiss)[J]. Fish Shellfish Immunol, 2015, 45(2):877-888.
Preparation and Immune Effect of Rainbow Trout IHNV-M Protein Microsphere Vaccine
PAN xuan1,TIAN Shengyuan1,TIAN Yang2,LI Quanzhen2,ZHAO Baohua1
(1.College of Life Sciences, Hebei Normal University, Shijiazhuang 050024, China; 2. Hebei Provincial Fisheries Technology Extension Center, Shijiazhuang 050035, China)
Abstract:The recombinant strain BL21(DE3) (pET-22b-m) preserved in our laboratory was induced by IPTG, and confirmed by SDS-PAGE;the target protein was expressed at 21.6Ku. IHNV-M protein microsphere vaccine was prepared by emulsification-double emulsion method. The prepared IHNV-M protein microsphere vaccine was used to immunize rainbow trout with the method of intragastric administration, and the antibody titer in serum was determined by ELISA. The antibody titers in the serum of the common rainbow trout group and the American golden trout were 1∶128 000 and 1∶25 600, respectively.
Key words:hematopoietic necrosis virus; matrix protein M; microsphere vaccine; immunogenicity

