一株苯酚降解菌的筛选、鉴定及相关降解特性
陈禹竹,唐琦勇,顾美英,朱 静 ,刘晓静,崔卫东 ,张志东,
(1. 新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091;2. 新疆大学生命科学与技术学院,乌鲁木齐 830046;3. 新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
0 引 言
【研究意义】苯酚(Phenol,C6H5OH),又名石炭酸,是一种酚类化合物,毒性大,难降解[1]。环境中的苯酚主要来自炼焦、炼油、制取煤气、制造酚及其化合物和用酚作原料等工厂工业排放的各种含酚废水和废气等[2],不经处理的含酚废料进入大气或渗入地下,污染大气、地下水和农作物等,进入环境中对动植物及人类健康造成极大威胁[3],苯酚是国内外环境优先监测的持久性有机污染物之一。传统的苯酚的处理方法多为物理化学法,主要有萃取脱酚法、吸附法[4]、紫外线法[5]、臭氧化法[6]、超声降解法[7]、光催化氧化法[8]等,但这些方法多数成本较高,操作复杂,难以普遍推广,而生物降解法是利用微生物对酚类物质的降解而达到去除目的,该方法具有经济高效、无二次污染等特点因而被广泛使用[9]。筛选出既能耐受高盐条件又有高效降解苯酚能力的微生物菌株具有重要意义。【前人研究进展】目前,已从污水处理厂、焦化厂、石油污染土壤等环境分离到一些苯酚降解菌,包括有假丝酵母[10]、假单胞菌[11]、苍白杆菌[12]、产碱菌属[13]、红球菌属[14]、不动杆属[15]、芽孢杆菌[16]等,均对苯酚具有较好的降解作用。【本研究切入点】由于苯酚工业污水成分复杂,含盐量较高,会使一些降解菌的生长速率和降解速率迅速下降[17],限制了大多数降解微生物在污水处理中的应用,使得处理相关污水时一般会进行稀释或进行前处理,无形中增加了处理系统的工作负荷。研究筛选苯酚化合物相关降解微生物,确定其相关功能特性。【拟解决的关键问题】以苯酚为筛选压力,从中国辐射污染区盐爪爪根际微生物中分离筛选得到一株苯酚高耐受菌,分析其生物学鉴定及其相关特性,研究菌株对苯酚和酚类化合物玉米赤霉烯酮的降解特性,为苯酚及酚类化合物的生物降解提供新的研究材料,为开发利用相关菌株奠定科学依据。
1 材料与方法
1.1 材 料
1.1.1 样品采集
盐爪爪于2018年4月采自中国辐射污染区某汇水区,该区域属于典型的干旱荒漠地区。采集盐爪爪完整植株,尽可能地保证其根部的完整性,利用无菌细毛刷轻刷根部收集根际土壤样品,土样经充分混匀后转移至无菌离心管中,于4℃下保存备用。
1.1.2 培养基
R2A培养基:胰蛋白胨0.25 g/L,酸水解酪蛋白0.5 g/L,酵母浸粉0.5 g/L,可溶性淀粉0.5 g/L,丙酮酸钠0.3 g/L,蛋白胨0.25 g/L,葡萄糖0.5 g/L,K2HPO40.3 g/L,MgSO40.1 g/L,琼脂 20 g/L(固体培养基),pH 7.0。
无机盐培养基:K2HPO42.25 g/L,KH2PO42.25 g/L,(NH4)2PO41.0 g/L,MgCl2·6H2O 0.2 g/L,CaCl20.01 g/L,FeCl3·6H2O 0.02 g/L,NaCl 20 g/L,琼脂 20 g/L(固体培养基),pH 7.0。
LB培养基:胰蛋白胨10.0 g/L,氯化钠10.0 g/L,酵母浸粉5.0 g/L,琼脂 20 g/L(固体培养基),pH 7.2。
1.1.3 主要仪器
电子天平,奥豪斯仪器(上海)有限公司;生化培养箱,上海福玛实验设备有限公司;振荡器(摇床),上海天呈实验仪器制造有限公司;紫外分光光度计,日本岛津公司;高效液相色谱仪,美国安捷伦科技公司。
1.2 方 法
1.2.1 菌株分离筛选
无菌条件下称取5.0 g根际土壤样品,置于装有50 mL含有1 g/L苯酚和2% NaCl的R2A液体培养基中,于30℃、120 r/min条件下振荡富集培养4 d,吸取上述培养物悬液1 mL,经梯度稀释后,涂布至含有1 g/L苯酚和2% NaCl的R2A培养基平板上,于30℃下恒温培养3~15 d,待菌落长出后,菌株根据菌落的形态、大小及颜色进行初步筛选,分离纯化后接至R2A培养基斜面上,于4℃下保存备用。
1.2.2 菌株分子鉴定
采用菌落克隆方法,利用细菌16S rRNA基因通用引物27F和1492R进行PCR扩增。PCR产物经切胶纯化回收后,送至北京鼎国生物技术有限公司进行测序。所测得序列经手工校对后,通过EzTaxon数据库(http://www.ezbiocloud.net/eztaxon/identify)进行比对,调取同源性最高的模式菌株序列,使用MEGA 7.0进行ClustalX多重比对,并使用NJ法构建系统发育树,自举值(Bootstrap)为1 000,初步获得菌株的生物学分类地位。
1.2.3 菌株的抗逆特性及功能特性
菌株的生长温度测定采用含有2% NaCl的R2A培养基进行;菌株的耐盐特性测定采用含有不同浓度NaCl的R2A培养基进行;耐苯酚特性测定采用含有不同浓度苯酚的R2A培养基进行;菌株的酯酶、淀粉酶、蛋白酶、果胶酶特性分别采用加有1%的吐温80、可溶性淀粉、脱脂奶粉和果胶的R2A培养基进行。
1.2.4 菌株利用芳香族化合物生长性况
分别配置含1 g/L的苯、二甲苯、二苯胺、I-萘胺和对羟基苯甲酸的无机盐培养基,接入实验菌株,培养3~5 d后,测量不同芳香族化合物菌液OD600,确定其生长情况。
1.2.5 苯酚测定
利用4-氨基安替比林分光光度法[18]测定苯酚的含量。配制苯酚标准溶液,准确称取0.100 0 g苯酚,配置成100 mg/L的苯酚溶液。分别移取1、2、4、6、8和10 mL苯酚标准溶液置于50 mL比色管中,稀释定容至刻度。在6支比色管中分别加入0.5 mL氨水-氯化铵缓冲液,混匀,此时pH为10±0.2,然后加入1.0 mL的2% 4-氨基安替比林溶液,再加入1.0 mL的8%铁氰化钾溶液,充分混匀,放置10 min后,立即于510 nm波长处,以水为参比,测定其吸光度。最后绘制吸光度对苯酚浓度的标准曲线。
样品溶液经预处理后测定苯酚含量,移取1 mL样品溶液,在7 000 r/min下离心1 min,取1 mL上清液,用于检测苯酚含量。

1.2.6 菌株苯酚降解特性
挑取一环活化菌株菌苔,接种到装有5 mL LB液体培养基的大试管中,于30℃、120 r/min条件下,培养16 h,以2%的接种量接种菌液至苯酚初始浓度为0.5、0.75、1.0、1.25和1.5 g/L的R2A液体培养基中,于30℃、120 r/min条件下培养,连续培养7 d并取样,测定不同苯酚初始浓度下菌株苯酚的降解情况。
1.2.7 菌株对玉米赤霉烯酮的降解特性
同样方法制备种子培养液,以2%的接种量接种菌液至含有10 μg/L玉米赤霉烯酮的LB液体培养基中,于30℃,120 r/min条件下培养,连续培养7 d并取样,测定不同培养时间下菌株降解玉米赤霉烯酮的降解特性。检测方法如参考文献[19]采用的HPLC法进行。
2 结果与分析
2.1 菌株筛选
利用含有1%苯酚的R2A培养基筛选培养3~15 d,经菌落形态观察,共挑取各类菌株72株,通过进一步的苯酚耐受性筛选和苯酚降解率的初步测定,优选出一株编号为YZZ-9的菌株,该菌为革兰氏阳性、球菌,菌落直径2~3 mm,菌落淡黄色、光滑、不透明,边缘不规则。图1
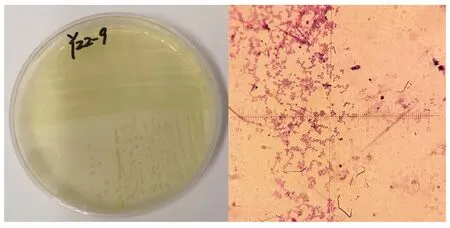
图1 菌株YZZ-9的菌落和菌体形态
Fig. 1 Colony and cell morphology of the Strain YZZ-9
2.2 菌株的分子鉴定
菌株YZZ-9通过16S rDNA序列PCR扩增和测序,并与EzTaxon数据库进行相似度比较,同时调取菌株相似性最高模式菌株序列,利用NJ法构建系统进化发育树,该菌株归属于考克氏属(Kocuria),其与Kocuriapalustris(沼泽考克氏菌)DSM 11925T同源性最高,达到100%,确定其为沼泽考克氏菌分离株。图2
2.3 菌株的抗逆特性及功能特性
研究表明,该菌株可以最高耐受3.5 g/L的苯酚,10%的NaCl,可在10~45℃下生长,可以产生酯酶和淀粉酶。表1
表1 菌株抗逆特性及功能特性
Table 1 Stress resistance and functional characteristics of strains

抗逆特性StressResistance结果Result产酶情况Enzymeproduction结果Result苯酚0~3.5g/L酯酶+NaCl0~10g/L淀粉酶+温度10~45℃蛋白酶-pH5.0~11.0果胶酶-
注:“+”表示有活性;“-”表示无活性
Note: “+” indicates active; “-” indicates inactive
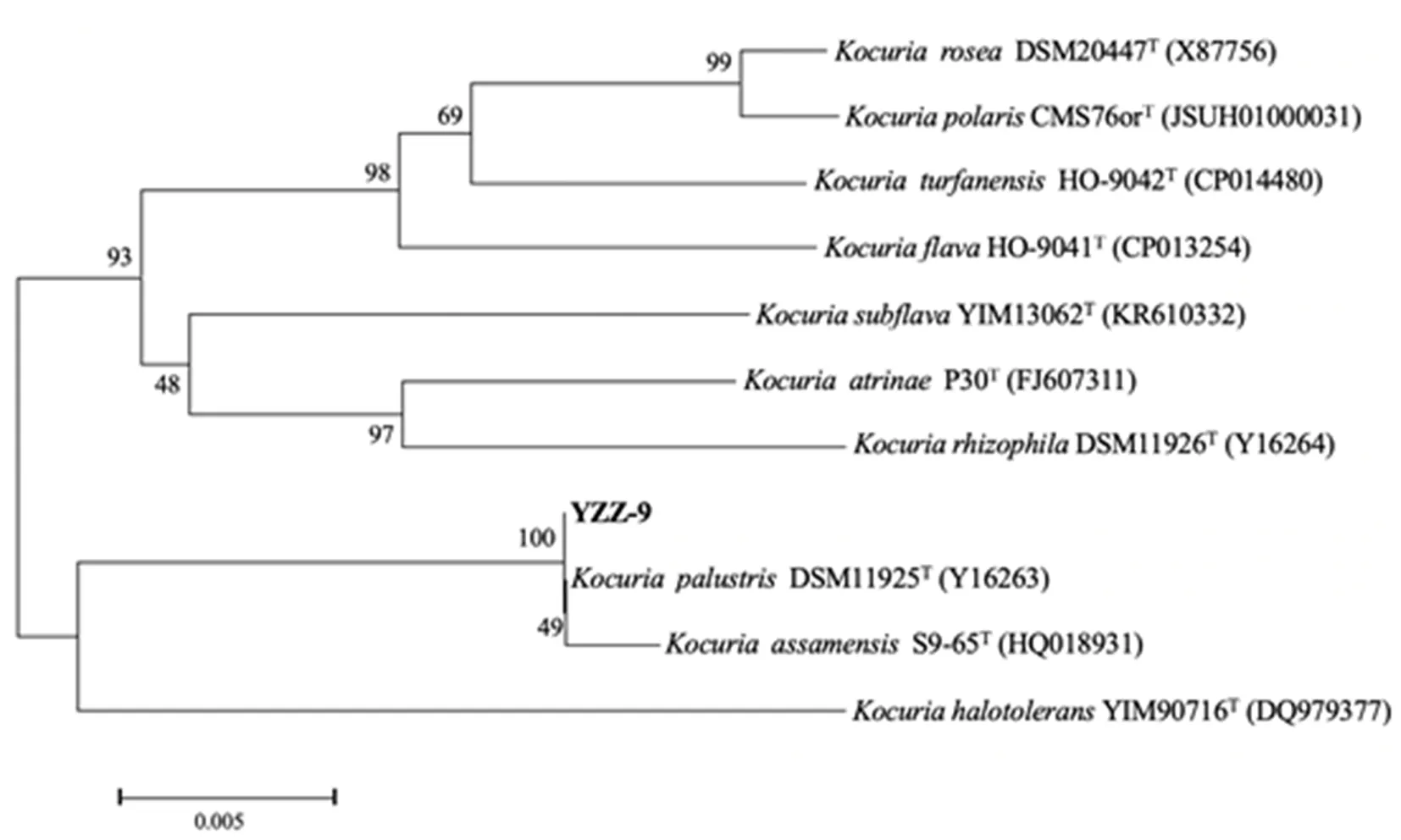
图2 基于菌株YZZ-9的NJ进化树
Fig. 2 Neighbor-Joining tree based on the Strain YZZ-9
2.4 菌株利用芳香族化合物生长
研究表明,菌株YZZ-9具有多种芳香族化合物的利用能力,其中对I-奈胺的利用生长最好,最大生长OD600可达到0.496,其次为苯酚,OD600可达到0.176,而对苯和对羟基苯甲酸二甲苯几乎不利用。图3

图3 菌株利用芳香族化合物生长情况
Fig. 3 Growth of strains utilizing aromatic compounds
2.5 菌株对苯酚的降解特性
2.5.1 苯酚标准曲线
根据吸光度与苯酚浓度的对应关系,以苯酚浓度为横坐标、吸光度为纵坐标,绘制标准曲线,在0~1.6 g/L具有较好的线性关系,方程为y=1.226 2x-0.001,相关指数R2=0.999。图4
2.5.2 菌株苯酚降解特性
研究表明,选择的几个浓度下培养,菌体生长至48 h时其OD600均不再增长,尽管苯酚的增加对菌体生长有一定的影响,但整体来说影响不大。图5
不同初始苯酚浓度对菌株降解苯酚的效果影响较大,当培养基初始苯酚浓度为0.5 g/L时,菌株在48 h内可将苯酚完全降解,但随着苯酚初始浓度的增高,完全降解所需的时间逐渐延长,当苯酚浓度达到1.25 g/L,苯酚降解效率明显降低,120 h内仅降解率为24.4%,而当浓度达到1.5 g/L时,菌株对苯酚的降解基本停滞,120 h时降解率不足5.0%。图6

图4 苯酚浓度对应吸光度曲线
Fig. 4 Working curve of phenol concentration corresponding to absorption

图5 不同初始苯酚浓度下菌体生长情况
Fig.5 The growth of bacterium in different initial phenol concentrations

图6 菌株在不同苯酚浓度下降解情况
Fig. 6 Degradation of bacteria in different phenol concentrations
2.6 菌株对玉米赤霉烯酮的降解情况
研究表明,菌株YZZ-9在含有10 μg/mL玉米赤霉烯酮的LB培养基中能很好的生长,其在培养18 h后即达到对数期后期,其后进入稳定期。菌株对玉米赤霉烯酮的降解,随着菌体增加缓慢发生,但降解过程主要发生在稳定期,玉米赤霉烯酮的降解速率也有所加快,至培养144 h时菌株对培养基中玉米赤霉烯酮降解率可达68.9%。图7
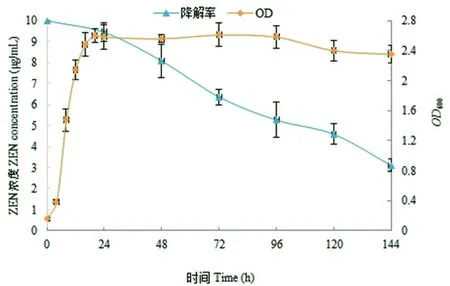
图7 菌株YZZ-9的生长曲线和玉米赤霉烯酮的降解曲线
Fig. 7 Growth curve of the Strain YZZ-9 and degradation curve of zearalenone
3 讨 论
植物根际存在着丰富多样的微生物种群,具有较强的污染物降解能力。Tejeda-Agredano MC等[19]发现向日葵的根际微生物对土壤中的多环芳烃具有很好的降解能力,李乔平[20]研究发现豆科植物根际菌群对菲具有较好的降解能力,申圆圆[21]从红三叶草根际土壤中分离出一株高效石油降解菌。这些具有高效降解能力的植物根际微生物,为生物修复土壤、水体中有毒有害化合物提供了科学依据。苯酚作为典型的酚类化合物,其毒性大,难降解,进入环境中会对动植物及人类健康造成极大威胁。
近年来,发现盐环境中存在着多样的苯酚降解微生物。其中,对新疆艾丁湖中苯酚降解菌多样性研究[22]发现,所分离的拟诺卡氏(Nocardiopsis)菌属、Bacillus、Gracilibacillus、Pontibacillus、Halobacillus、Marinococcus和Halomonas属均可降解苯酚,但降解效率较低。盐爪爪是典型的盐生植物,广泛分布在盐碱荒漠生境[23],在其生长过程中,其根际土壤的多种离子浓度显著提高,会形成根际“离子岛”效应。前期研究发现[24],其存在着丰富的微生物多样性,其中70%的分离株具有耐受10% NaCl的能力,40%的分离株可耐受不同浓度的重金属胁迫。在其根际微生物碳源代谢过程中,发现其根际存在较强的酚酸类化合物降解的功能,为实验的开展奠定了基础。
目前,国内外已分离筛选出许多苯酚降解菌。Zhenghui Liu等[25]从石化废水中分离出一株苯酚降解菌株PA,经鉴定为醋酸钙不动杆菌(Acinetobactercalcoaceticus),该菌株在48 h内能去除91.6%的初始浓度800 mg/L的苯酚,对苯酚浓度的耐受性高达1 700 mg/L。魏霞等[26]从污水处理厂的活性污泥中分离出一株苯酚降解菌,初步鉴定菌株属于红球菌(Rhodococcussp.),该菌株能耐受4%的盐度,在48 h内对1.5 g/L苯酚的降解率在90%以上。Hui Liu等[27]从土壤样品中分离出一种能够降解高浓度苯酚的新型酵母菌株TrichosporonmontevideensePHE1,该菌株在18 h内可降解99.5%初始浓度为1 200 mg/L的苯酚,能耐受2 500 mg/L浓度的苯酚。研究通过以苯酚为筛选压力,从盐爪爪根际微生物中通过富集、平板分离获得一株对苯酚具有良好降解能力的菌株YZZ-9,经16S rDNA序列分析,确定该菌株属于Kocuriapalustris(沼泽考克氏菌),两者16S rDNA序列同源性达到100%。相关研究表明,Kocuria属具有较强的抗逆特性和污染物降解能力[28-29]。通过实验验证,菌株YZZ-9也具有较好的苯酚、温度和盐碱耐受性,同时可以利用多种苯类化合物为单一碳源而生长。
研究中,通过对培养基中不同浓度苯酚下菌株的生长和苯酚降解特性分析发现,随着培养基中的苯酚浓度增加,菌株对苯酚降解效率明显下降,完全降解所需的时间明显的延长。当培养基浓度低于1.0 g/L时,菌株可在120 h内完全降解;当苯酚浓度达到1.25 g/L时,仍具有一定的降解效果;当苯酚浓度达到1.5 g/L时,培养基中的苯酚降解几乎被抑制。如赵宇虹[30]等和刘桂萍[31]等也发现当苯酚浓度增加会明显降低菌株的降解效率,一般认为,这主要是因为高浓度苯酚通过抑制菌体生长造成的结果。研究发现,随着培养基中的苯酚浓度增加菌体生长有所下降,但影响有限,如当苯酚浓度为0.5和1.5 g/L时,两者OD值最高相差不足30%,但苯酚的降解效率相差却极大,高浓度苯酚可能通过其它机理抑制菌株对苯酚的降解,相关研究还有待进一步分析。
同时,研究也发现菌株YZZ-9可明显降解玉米赤霉烯酮。玉米赤霉烯酮全名为6-(10-羟基-6-氧代-反式-1-十一碳烯基)-β-环戊酸内酯,是由真菌产生的一种非甾体类雌激素真菌毒素,是世界范围内谷类作物的常规污染物,危害极大[19]。通过实验发现,菌株对玉米赤霉烯酮降解过程主要发生在稳定期,菌株培养至144 h时,对培养基中玉米赤霉烯酮降解率可达68.9%,为相关生物降解玉米赤霉烯酮提供了科学材料。由于玉米赤霉烯酮分子中含有酚类结构,菌株是否以破坏其分子中的苯环结构进而达到降解玉米赤霉烯酮,相关降解机制还有待进一步分析。
4 结 论
4.1 通过富集、平板分离获得一株对苯酚具有良好降解能力的菌株YZZ-9,经16S rDNA序列分析,确定该菌株属于Kocuriapalustris(沼泽考克氏菌),两者16S rDNA序列同源性达到100%。该菌株具有较好的苯酚、温度和盐碱耐受性,同时可以利用多种苯类化合物为单一碳源而生长。
4.2 菌株的生长随着培养基中的苯酚浓度加而下降,但影响不明显,而对苯酚降解效率影响较为明显。当培养基中苯酚浓度不断增加,完全降解所需的时间明显的延长。当培养基浓度低于1.0 g/L 时,菌株可在120 h 内完全降解;当苯酚浓度达到1.5 g/L,培养基中的苯酚降解几乎完全被抑制。
4.3 菌株YZZ-9可明显降解玉米赤霉烯酮,但降解过程主要发生在稳定期,菌株培养144 h时,对培养基中玉米赤霉烯酮降解率可达68.9%。

